常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-06-06 09:00:00 细胞资源库平台 访问量:215
英文标题:Full-length GSDME mediates pyroptosis independent from cleavage
中文标题:全长 GSDME 介导不依赖裂解的细胞焦亡
发表期刊:《Nature Cell Biology》
影响因子:17.3
作者单位:
厦门大学生命科学学院细胞应激生物学国家重点实验室
作者信息:
Bo Zhou1,2, Zhi-hong Jiang1,2, Meng-ran Dai1,2, Yuan-li Ai1, Li Xiao1, Chuan-qi Zhong1, Liu-Zheng Wu1, Qi-tao Chen1, Hang-zi Chen,Qiao Wu
细胞焦亡的经典机制:细胞焦亡(pyroptosis)是一种由gasdermin(GSDM)家族蛋白介导的程序性细胞死亡形式。传统观点认为,GSDM蛋白需要被蛋白酶切割,释放其N端片段(GSDM-NT),才能转移到细胞膜上形成孔洞,从而执行焦亡。C端结构域(GSDM-CT)通常通过分子内相互作用抑制N端结构域的活性,维持GSDM的自抑制状态。
GSDM的激活方式多样性:除了蛋白酶切割外,GSDM的激活还可能通过其他机制实现,例如:通过突变破坏C端和N端结构域之间的相互作用界面。通过氧化或棕榈酰化等翻译后修饰改变蛋白构象。
活性氧(ROS)在焦亡中的作用:ROS通过氧化蛋白质中的半胱氨酸残基,形成分子内或分子间二硫键,从而调控蛋白质功能。已有研究表明Tom20通过氧化感知ROS,启动黑色素瘤细胞中的GSDME介导的焦亡。死亡受体6(DR6)感知α-酮戊二酸增强的ROS,促进GSDMC介导的焦亡。谷胱甘肽过氧化物酶4(GPX4)的缺失会增强caspase-11对GSDMD的切割,从而诱导焦亡。
紫外线(UVC)辐射与细胞死亡:UVC是短波紫外线(200–280 nm),具有强破坏性,可诱导多种细胞死亡形式(如凋亡、NETosis、坏死性凋亡等)。然而,UVC诱导焦亡的研究较少。
细胞实验
(1)细胞培养与处理
细胞系:人类细胞:HeLa(宫颈癌细胞)、A375(黑色素瘤细胞)、A549(肺癌细胞)、SW620(结肠癌细胞)等。
小鼠细胞:B16(黑色素瘤细胞)、Panc02(胰腺癌细胞)。
对照细胞:HEK293T(用于转染实验)。
UVC照射:使用254 nm UVC光源,剂量为50–200 mJ/cm²。
(2)基因操作
基因敲除(KO):
使用CRISPR-Cas9技术构建GSDME-KO细胞系(单克隆筛选)。
基因敲降(KD):
使用shRNA或siRNA靶向GSDME、PARP1、PARP5a/b、DRP1、MFF、cyt.c等基因。
基因过表达:
构建GSDME-Flag/HA、GSDME突变体(如C156S/C180S、D229A/E233A)等质粒,通过脂质体转染或慢病毒感染导入细胞。
(3)细胞死亡检测
焦亡形态观察:显微镜下观察细胞肿胀、膜破裂等焦亡特征。
PI/Hoechst 33342染色:焦亡细胞膜破裂,PI(碘化丙啶)进入细胞核染色,计算PI阳性率。
Annexin V/PI双染:区分凋亡(Annexin V+ PI−)和焦亡(Annexin V+ PI+)。
分子机制研究
(1)蛋白质修饰分析
PARylation检测:使用PAR抗体检测GSDME的PAR修饰。
抑制PARP1(rucaparib/olaparib)或PARP5(K756)验证依赖性。
氧化寡聚化检测:非还原性SDS-PAGE:观察GSDME的高分子量寡聚体(二硫键依赖)。
质谱分析:鉴定Cys156/Cys180形成分子间二硫键。
(2)亚细胞定位
细胞组分分离:分离胞质、细胞膜(PM)、线粒体、细胞核组分,检测GSDME分布。
免疫荧光(IF):使用Flag/Tom20(线粒体标记)共定位分析GSDME的膜靶向。
(3)脂质ROS与线粒体功能
脂质ROS检测:BODIPY C11荧光探针(氧化后荧光由红变绿)。
抑制剂:Fer-1(ferroptosis抑制剂)、DFO(铁螯合剂)。
线粒体ROS(mito-ROS)检测:MitoSOX(超氧化物特异性荧光探针)。
心磷脂(cardiolipin)氧化:NAO(10-壬基吖啶橙)荧光减弱反映心磷脂过氧化。
(4)PARP1/PARP5通路
PARP1激活:UVC诱导DNA损伤(γ-H2AX检测),激活PARP1生成PAR聚合物。
PARP5介导的GSDME PARylation:Co-IP验证PARP5与GSDME的相互作用。
体外PARylation实验:纯化PARP5和GSDME,加入NAD+检测修饰。
结构生物学方法
(1)构象变化检测
DDDDK-Flag暴露实验:在GSDME的C端与N端结合界面插入Flag标签,通过抗Flag抗体免疫沉淀检测构象变化。
(2)脂质结合与膜穿孔
脂质体结合实验:使用牛肝极性脂质提取物制备脂质体,检测GSDME结合能力。
负染电镜:观察GSDME在脂质体上形成的孔洞结构。
动物模型
(1)肿瘤抑制实验
裸鼠异种移植模型:皮下注射HeLa细胞(对照、GSDME-KD、GSDME突变体),用RSL3(GPX4抑制剂)+ carmustine(DNA损伤剂)联合治疗,观察肿瘤生长抑制。
免疫活性小鼠模型(C57BL/6J):皮下注射B16-GSDME过表达细胞,评估焦亡的免疫原性(CD8+ T细胞、NK细胞浸润)。
(2)免疫细胞分析
流式细胞术(FACS):检测肿瘤微环境中CD8+ T细胞、NK细胞、IFN-γ、穿孔素(perforin)等免疫标志物。
数据分析
Western Blot定量:ImageJ软件。
统计学分析:GraphPad Prism 9(ANOVA、Tukey检验)。
质谱数据:ProteomeXchange(PXD051840)。
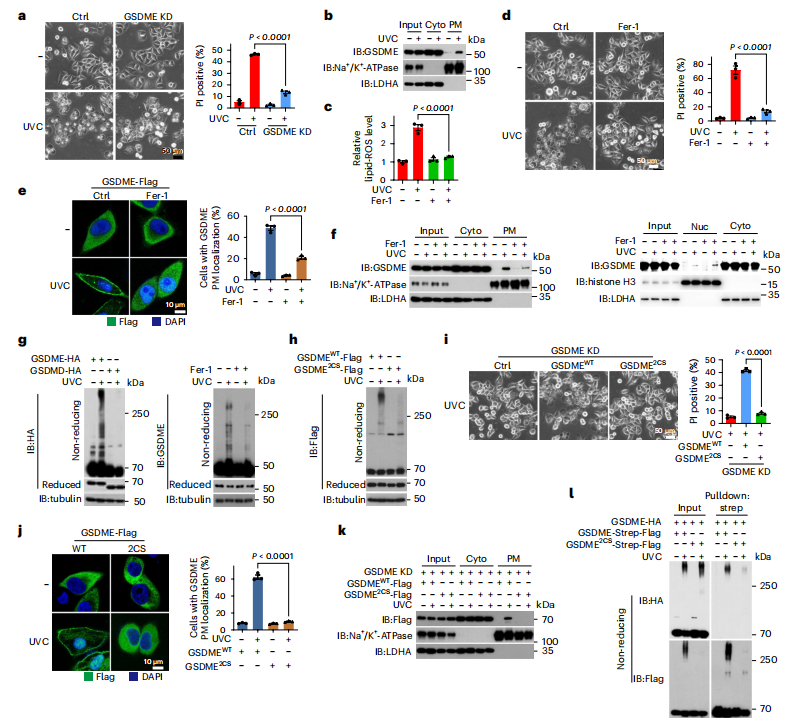
图1:UVC照射下FL-GSDME诱导的焦亡
HeLa细胞在UVC 200 mJ cm−²照射下,有或无不同抑制剂预处理,然后培养1小时检测脂质ROS和GSDME质膜靶向,3小时检测GSDME氧化,4小时显示焦亡形态及PI阳性率(%),除非另有说明。
图(a)细胞中GSDME被敲低并检测焦亡。
图(b)准备细胞质膜部分后进行western印迹。
图(c–g)细胞用Fer-1 (2 μM,2 h)预处理,检测脂质ROS (c)、焦亡(d)、GSDME质膜靶向(e和f,左)、细胞质中GSDME表达水平(Cyto)、质膜或核中GSDME表达水平(Nuc)(f,右)以及GSDME氧化(g,右)。分别转染GSDME-HA或GSDMD-HA进入细胞并检测GSDME氧化(g,左)。
图(h–k)GSDME或GSDME2CS分别转染到细胞中,显示了GSDME氧化(h)、焦亡(i)和GSDME质膜靶向(j,k)。
图(l)转染不同标记的GSDME构建体的细胞接受了UVC照射。随后,使用含1% SDS的裂解液收集细胞,并煮沸5分钟以确保蛋白质完全变性。裂解液中的SDS浓度稀释至0.5%,然后用Strep-Tactin Sepharose珠子沉淀。显示了非还原凝胶中高分子量复合物中的GSDME。使用微管蛋白测定上样蛋白的量。LDHA和Na+/K+-ATP酶用于指示输入、胞浆和质膜中的上样蛋白量。统计数据显示为mean ± s.e.m.(n=3)三次独立实验的结果。统计分析采用双因素方差分析(ANOVA)结合Tukey多重比较检验(a,c–e,j)和单因素方差分析结合Tukey多重比较检验(i)。标出了P值。所有western blot实验至少重复两次,其中一次结果如图所示。IB,免疫印迹;KD,敲低;DAPI,4,6-二氨基-2-苯基吲哚;WT,野生型。
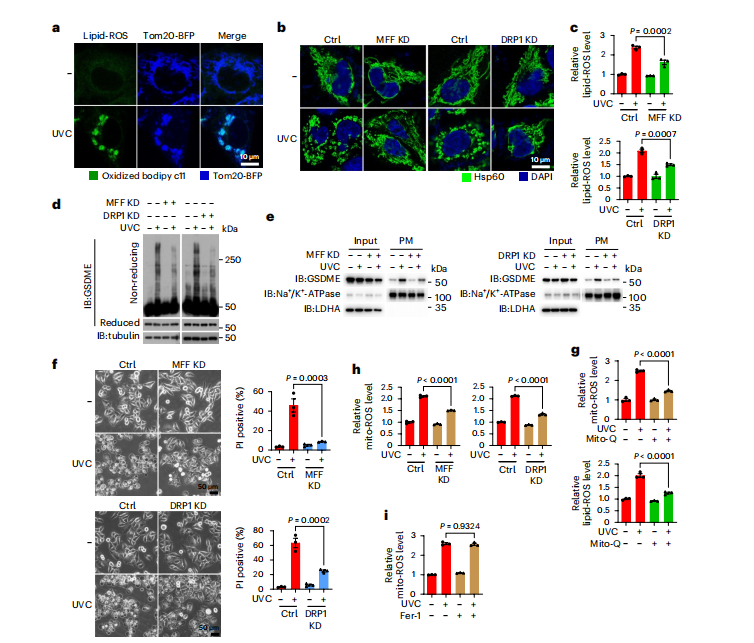
图2:MFF/DRP1在脂质ROS升高和焦亡诱导中的作用
HeLa细胞经UVC 200 mJ cm−²照射,有或无不同抑制剂预处理,然后培养1小时检测线粒体形态、脂质ROS、线粒体ROS和GSDME质膜靶向,3小时显示GSDME氧化,4小时显示焦亡形态及PI阳性率(%),除非另有说明。
图(a)将Tom20-BFP质粒转染入细胞,通过BODIPY C11荧光染色观察脂质ROS。
图(b–f)分别敲低细胞中的MFF或DRP1;显示线粒体形态(b)、脂质ROS水平(c)、GSDME氧化(d)、质膜靶向(e)和焦亡(f)。
图(g)细胞用Mito-Q (2 μM,2 h)预处理;显示线粒体ROS和脂质ROS水平。
图(h)MFF和DRP1分别被敲低,并检测了线粒体ROS的水平。
图(i)细胞用Fer-1 (2 μM,2 h)预处理后,检测了线粒体ROS水平。使用微管蛋白测定加载蛋白的量。LDHA和Na+ /K+ -ATPase分别用于指示输入和质膜中加载蛋白的量。Hsp60用于指示线粒体。统计数据显示为mean ± s.e.m.(n=3),三次独立实验的结果。统计分析采用两因素方差分析结合Tukey多重比较检验(c,f–i)。P值已标出。所有western印迹至少重复两次,此处仅展示其中一次结果。
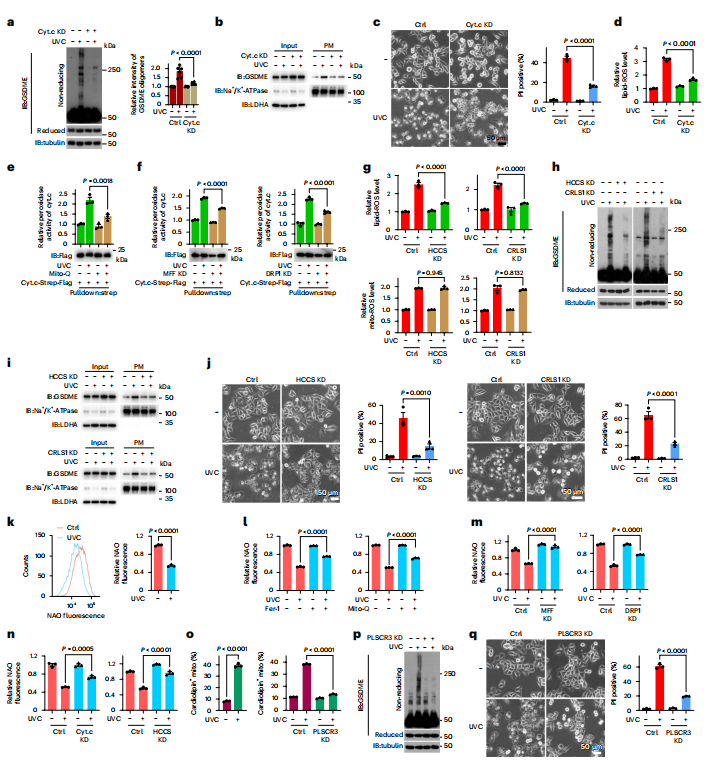
图3:细胞色素c诱导心磷脂氧化以提高脂质活性氧水平
HeLa细胞经UVC照射200 mJ cm−²,有或无不同抑制剂预处理,然后培养1小时检测线粒体活性氧、脂质活性氧、细胞色素c过氧化物酶活性、心磷脂氧化、GSDME质膜靶向及MOM中心磷脂含量,3小时显示GSDME氧化,4小时显示焦亡形态和PI阳性率(%),除非另有说明。
图(a–d)检测细胞色素c敲低细胞中的GSDME氧化(a)和质膜靶向(b),焦亡(c)及脂质活性氧水平(d)。显示GSDME寡聚化的定量结果(a,右)。
图(e)细胞用Mito-Q (2 μM,2 h)预处理,指示细胞色素c过氧化物酶活性。
图(f)检测MFF或DRP1敲低细胞中的细胞色素c过氧化物酶活性。
图(g–j)检测HCCS或CRLS1敲低细胞中的脂质活性氧水平(g)、线粒体活性氧水平(h)、质膜靶向(i)及焦亡(j)。
图(k)通过NAO染色检测了心磷脂的氧化。
图(l-n)在Fer-1 (2 μM,2 h)(左)或Mito-Q (2 μM,2 h)预处理的细胞中,或MFF、DRP1、cyt.c或HCCS敲低的细胞中检测了心磷脂的氧化。
图(o)使用抗心磷脂抗体定量了MOM中的心磷脂含量,对照组(左)或PLSCR3敲低的HeLa细胞(右)。
图(p,q)在PLSCR3敲低的细胞中检测了GSDME氧化(p)和焦亡(q)。微管蛋白用作上样对照。LDHA和Na+/K+-ATP酶分别用于指示输入或质膜中的上样蛋白量。统计数据显示为mean ± s.e.m.(n=6),六个独立实验(右)和(n = 3),三个独立实验(其他)。统计分析采用双因素方差分析结合Tukey多重比较检验(a,c–g,j,l–n,o(右)和q)和非配对双尾t检验(k,o(左))。P值已标出。所有western印迹至少重复两次,其中一次显示。
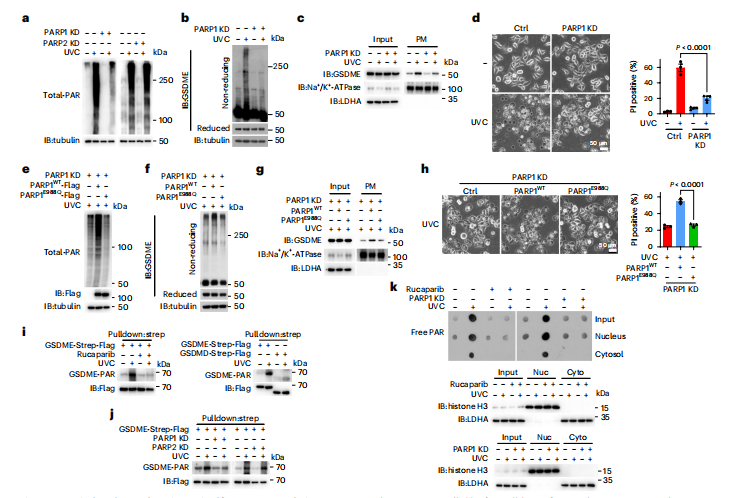
图4:PARP1诱导的PAR释放对于GSDME PAR化是必需的
HeLa细胞用UVC以200 mJ cm−²剂量照射,有或没有不同抑制剂的预处理,然后培养10分钟以显示总PAR化(总-PAR)和GSDME PAR化(GSDME-PAR),1小时检测GSDME质膜靶向,3小时显示GSDME氧化,4小时显示焦亡形态和PI阳性率(%),除非另有说明。
图(a)分别敲低PARP1或PARP2并检测总PAR化。
图(b–d)敲低PARP1;显示GSDME氧化(b)、质膜靶向(c)和焦亡(d)。
图(e–h)在PARP1敲低细胞中,分别引入PARP1WT或PARP1E988Q;显示PAR生成(e)、GSDME氧化(f)、质膜靶向(g)和焦亡(h)。
图(i,j)过表达GSDME-链球菌-Flag的细胞用rucaparib (20 μM,2 h)预处理(i,左)或在GSDME-链球菌-Flag表达细胞中分别敲低PARP1或PARP2。.在用链霉亲和素Sepharose珠子下拉GSDME后,检测到了GSDME的PAR化。GSDMD作为阴性对照(i,右)。
图(k)细胞预先用鲁卡帕利(20 μM,2 h,左)处理或敲低PARP1(右),随后进行UVC照射。培养10分钟后,检测到胞质中的游离PAR(上)。为了排除核污染,在核部分显示了组蛋白H3的表达,而在胞质部分则未显示。使用微管蛋白测定加载蛋白的量。LDHA和Na+/K+-ATP酶分别用于指示输入或质膜中加载蛋白的量。统计数据显示为三次独立实验的mean ± s.e.m.(n = 3)。统计分析采用双因素方差分析结合Tukey多重比较检验(d)和单因素方差分析结合Tukey多重比较检验(h)。P值已标出。所有western印迹至少重复两次,其中一次结果展示。
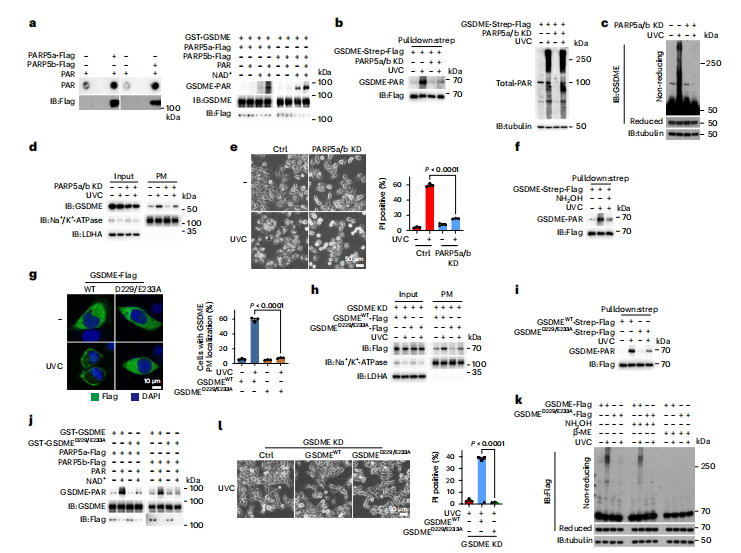
图5:细胞质PARP5催化GSDME PAR化
HeLa细胞经UVC照射200 mJ cm−²后,培养10分钟显示总PAR和GSDME-PAR,1小时检测GSDME质膜靶向,3小时表明GSDME氧化,4小时检测焦亡,除非特别说明。
图(a)用HeLa细胞免疫沉淀的PARP5a或PARP5b蛋白与硝酸纤维素膜孵育1小时,加入PARP1生成的PAR,并用PAR抗体进行免疫印迹(左)。体外GSDME PAR化实验在有或无PAR和NAD+孵育条件下进行(右)。
图(b)在表达GSDME-Strep-Flag的细胞中同时敲低PARP5a和PARP5b。通过Strep-Tactin Sepharose珠子下拉GSDME后,显示GSDME-PAR(左)和总PAR(右)。
图(c-e)在敲低PARP5a和PARP5b的细胞中检测GSDME氧化(c)、质膜靶向(d)和焦亡(e)。f,表达GSDME-Strep-Flag的细胞裂解物与羟胺(0.21 M,30分钟)孵育。通过Strep-Tactin Sepharose珠子下拉GSDME后,检测GSDME PAR化。
图(g、h)GSDMEWT或GSDMED229/E233A被转染到GSDME敲低细胞中。显示了GSDME的质膜定位。
图(i)gsdmewt-Strep–Flag或GSDMED229/E233A–Strep–Flag被拉下,GSDME的PAR修饰被标记。j、进行了GSDMEWT-PAR和GSDMED229/E233A-PAR的体外实验。
图(k)来自表达GSDMEWT或GSDMED229/E233A的细胞的裂解物与羟胺或10%的β-巯基乙醇孵育,检测了GSDME的氧化情况。l、GSDMEWT或GSDMED229/E233A被转染到GSDME敲低细胞中。显示了焦亡现象。微管蛋白作为加载对照。LDHA和Na+ /K+ -ATPase分别用于指示输入或质膜中的加载蛋白量。统计数据显示为mean ± s.e.m.(n=3)三次独立实验的结果。统计分析通过两因素方差分析和Tukey多重比较检验(e、g)以及单因素方差分析和Tukey多重比较检验(l)进行。P值已标明。所有western印迹至少重复两次,其中一次结果展示。
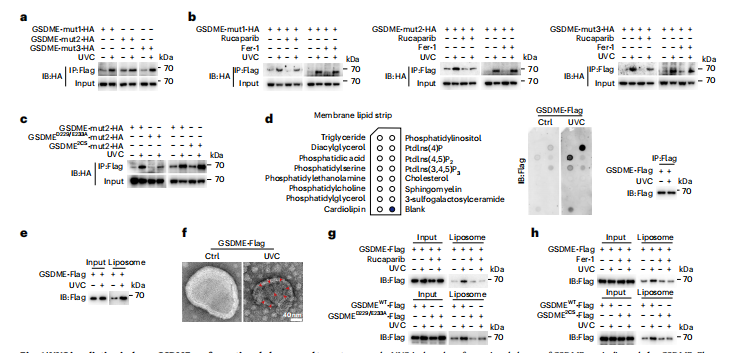
图6:UVC照射诱导GSDME构象变化并靶向PM穿孔
HeLa细胞在200 mJ cm−²的UVC照射下,有或没有不同抑制剂预处理,然后培养15分钟以显示GSDME构象变化,除非另有说明。
图(a,b)不同的GSDME-HA突变体(突变位点标记有Flag(DDDDK)在扩展数据图7a中显示)分别转染到细胞中,有或没有预先处理rucaparib (20 μM,2 h)或Fer-1 (2 μM,2 h),如所示。制备裂解液后,使用抗Flag磁珠进行免疫沉淀。免疫沉淀物中GSDME-HA的增加表明GSDME的构象改变(方法)。
图(c)构建了GSDMED229/E233A(左)或GSDME2CS(右)在GSDME-mut2-HA中,UVC诱导的GSDME构象变化如图所示。
图(d,e)GSDME–Flag被转染到细胞中,随后使用Flag抗体免疫沉淀GSDME并用3×Flag肽洗脱。洗脱样品分别与脂质条(d)或由牛肝来源的极性脂质提取物制备的脂质体(e)孵育,GSDME结合磷脂的能力被指示。
图(f)UVC诱导GSDME打穿脂质体,如代表性负染电子显微镜图像所示。
图(g,h)细胞被转染了GSDMED229/E233A (g)或GSDME2CS (h),或预处理了rucaparib (g)和Fer-1 (h),具体如所示。GSDME与脂质体之间的相互作用被指示。所有western印迹至少重复两次,其中一次显示。
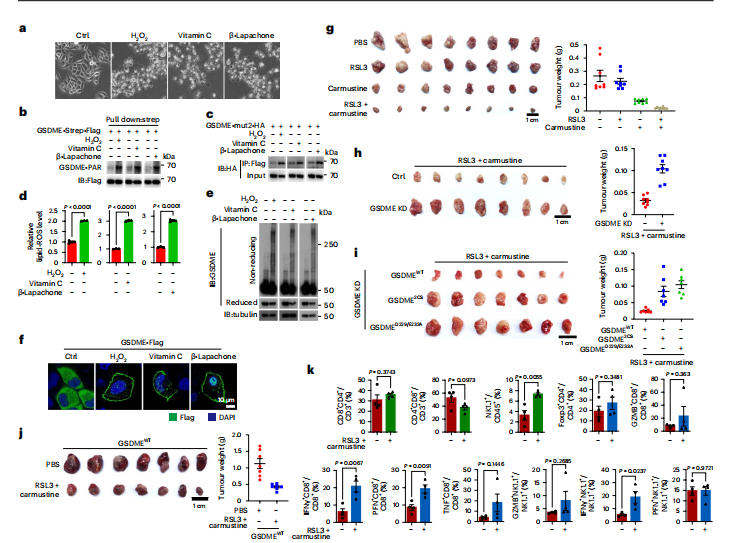
图7:临床药物组合诱导小鼠模型中的焦亡并抑制肿瘤生长
图(a-f)HeLa细胞用过氧化氢(1 mM)、维生素C(1 mM)或β-拉帕乔酮(5 μM)处理5小时以显示焦亡形态(a),1小时以显示GSDME PAR化(GSDME-PAR)(b)、GSDME构象变化(c)和脂质ROS水平(d),3小时检测GSDME质膜靶向(f)和4小时显示GSDME氧化(e)。
图(g)卡莫司汀(10 mg/kg−1)、RSL3(10 mg/kg−1)或卡莫司汀/RSL3联合用药每两天一次腹腔注射给携带HeLa细胞衍生异种移植瘤的小鼠,持续两周。显示裸鼠异种移植瘤图像及肿瘤重量(n = 8)。PBS作为对照。
图(h,i)卡莫司汀和RSL3用于治疗携带对照组、GSDME敲低(h,n = 8)或表达GSDME2CS或GSDMED229/E233A的HeLa细胞衍生异种移植瘤(i,n = 7)的小鼠。显示异种移植瘤及其相应肿瘤重量。
图(j)携带GSDME过表达的小鼠黑色素瘤B16细胞异种移植瘤的C57BL/6J小鼠,每日腹腔注射卡莫司汀(20 mg/kg−1)和RSL3 (10 mg/kg−1),持续1周。异种移植瘤及其相应的肿瘤重量已标明(n = 7)。PBS作为对照。
图(k)在卡莫司汀(10 mg/kg−1)和RSL3(10 mg/kg−1)给药后24小时收集B16细胞衍生的异种移植瘤,并通过流式细胞术分析肿瘤微环境中免疫细胞的比例和活化状态(n = 4)。统计数据显示为三次独立实验的mean ± s.e.m.(d,n = 3)或每组n = 8 (g),n = 8 (h),n = 7 (i),n = 7 (j)和n = 4 (k)小鼠。统计分析采用非配对双尾t检验(d,k)。P值已标出。g至k组实验仅进行一次。所有western印迹至少重复两次,其中一次结果展示。
本研究揭示了全长GSDME(FL-GSDME)在未被蛋白酶切割的情况下,通过PARylation和氧化作用激活并诱导焦亡的新机制,主要结论如下:
FL-GSDME可在不依赖切割的情况下诱导焦亡
传统观点:GSDM家族蛋白(如GSDMD、GSDME)需被caspase等蛋白酶切割,释放N端片段(GSDM-NT)才能执行焦亡。
本研究发现:
高强度UVC辐射(200 mJ/cm²)可诱导FL-GSDME介导的焦亡,且不依赖caspase切割(即使突变GSDME的caspase切割位点D267/D270仍有效)。
关键证据:UVC处理后,未检测到GSDME切割片段,但FL-GSDME仍能寡聚化并靶向细胞膜形成孔洞。
两条关键信号通路协同激活FL-GSDME
(1)PARylation通路:解除自抑制
PARP1激活:UVC诱导DNA损伤 → 激活核内PARP1 → 生成PAR聚合物(poly-ADP-ribose)。
PARP5介导的GSDME修饰:
PAR释放到胞质 → 激活PARP5(PARP5a/b)→ 催化GSDME的PARylation(主要发生在D229/E233位点)。
功能:PARylation引起GSDME构象变化,解除C端对N端的自抑制。
(2)氧化通路:促进寡聚化与膜靶向
线粒体ROS(mito-ROS):UVC诱导线粒体分裂(依赖DRP1/MFF)→ 升高mito-ROS。
细胞色素c(cyt.c)的作用:mito-ROS增强cyt.c的过氧化物酶活性 → 催化心磷脂(cardiolipin)过氧化 → 生成脂质ROS。
脂质ROS通过PLSCR3转运至线粒体外膜,氧化GSDME的Cys156/Cys180,形成分子间二硫键,促进寡聚化。
最终效应:氧化寡聚化的FL-GSDME靶向细胞膜穿孔,引发焦亡。
PARylation与氧化缺一不可
单独PARylation(如仅用DNA损伤剂)或单独氧化(如仅用RSL3)均不能有效诱导焦亡。
协同作用:只有当PARylation解除自抑制 + 氧化促进寡聚化时,FL-GSDME才能完全激活。
生理与治疗意义
(1)抗肿瘤应用
联合治疗策略:
DNA损伤剂(如carmustine) + 脂质ROS诱导剂(如RSL3)可协同激活FL-GSDME,显著抑制肿瘤生长(在HeLa和B16移植瘤模型中验证)。
免疫激活:FL-GSDME介导的焦亡释放促炎因子,增强CD8+ T细胞和NK细胞的肿瘤浸润与活化(IFN-γ、穿孔素表达升高)。
(2)拓展焦亡的调控范式
除蛋白酶切割外,翻译后修饰(PARylation、氧化)和构象变化是GSDM蛋白激活的新机制。
为开发靶向GSDME的癌症疗法(如PARP抑制剂联合氧化应激诱导剂)提供理论依据。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
下一篇:无需BSL-4!尼帕病毒研究重大突破:微型基因组复制子揭秘液-液相分离,抗病毒药物筛选效率翻倍