常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-05-30 09:00:00 细胞资源库平台 访问量:437
英文标题:Direct cytosolic delivery of siRNA via cell membrane fusion using cholesterol-enriched exosomes
中文标题:通过胆固醇富集外泌体的膜融合实现siRNA的直接胞质递送
发表期刊:《Nature Nanotechnology》
影响因子:38.1
作者单位:
中国科学院上海药物研究所
南昌大学江西医学院
浙江大学工程力学系等
作者信息:
Yan Zhuo, Zhen Luo, Zhu Zhu等
RNAi治疗的潜力与挑战
RNAi机制:siRNA可通过降解互补mRNA特异性沉默致病基因,在癌症、遗传病等领域具有广阔应用前景。
递送瓶颈:裸siRNA易被血清核酸酶降解,且难以穿透细胞膜,需依赖递送系统(如脂质纳米颗粒LNPs)。
现有递送系统的局限性
内吞途径依赖:LNPs通过内吞进入细胞,但大部分siRNA被困于内体/溶酶体(仅1-4%释放至胞质)。
溶酶体降解:酸性环境和酶导致siRNA失效,且“质子海绵效应”可能引发细胞毒性。
免疫原性风险:合成载体(如阳离子脂质体)可能激活免疫反应,限制长期应用。
外泌体的天然优势与不足
生物相容性:外泌体是内源性囊泡,具有低免疫原性、长循环时间和天然靶向性。
内吞陷阱:天然外泌体仍主要通过内吞途径进入细胞,无法避免溶酶体降解。
膜融合机制的启发
病毒与突触小泡的范例:包膜病毒(如HIV)和神经突触小泡通过膜融合直接释放内容物至胞质,其膜高胆固醇含量是关键。
胆固醇的作用:胆固醇可增加膜流动性、促进局部曲率变化,从而介导融合孔形成。
科学假设
通过工程化增加外泌体膜胆固醇含量,可能将其内化途径从内吞转向膜融合,实现siRNA的高效胞质递送,同时保留外泌体的生物安全性。
1. 分子动力学模拟(Molecular Dynamics, MD)
模型构建:
采用粗粒化分子动力学(CGMD)模拟,使用GROMACS 2021.3软件和Martini力场。
构建不同胆固醇含量(0%-30%)的外泌体膜模型,主要成分为DOPC、DOPE、DPSM和胆固醇。模拟外泌体与多组分细胞膜的相互作用,分析膜变形、接触面积和融合能量。
关键参数:
计算径向分布函数(RDF)评估脂质迁移和膜融合倾向。分析自由能曲线(PMF),量化胆固醇对DOPC分子释放的促进作用。
2. 外泌体工程化
外泌体提取:
从牛奶中提取天然外泌体(MEs),通过甲基-β-环糊精(MeβCD)去除胆固醇或薄膜水合法增加胆固醇,制备胆固醇含量为5%-30%的MEs。
物理化学表征:
粒径与电位:动态光散射(DLS)测定 hydrodynamic直径和Zeta电位。
形貌与膜厚度:透射电镜(TEM)和冷冻电镜(cryo-TEM)观察杯状结构变化;原子力显微镜(AFM)测定膜弹性(Young模量)。
蛋白组成:Western blot检测标志物(CD63、TSG101、Alix);蛋白质组学分析膜融合相关蛋白(如SNAP、VAMP)。
3. 细胞摄取机制验证
共聚焦显微镜(CLSM):
用DiO(绿色)标记细胞膜,DiI(红色)标记MEs,实时观察30%Chol/MEs与细胞膜的融合过程。
荧光共振能量转移(FRET):
标记MEs膜脂质(NBD-PE/Rho-PE),通过荧光强度变化计算融合效率(57.8%)。
抑制剂实验:
分别用氯丙嗪(clathrin抑制剂)、filipin(caveolin抑制剂)和amiloride(巨胞饮抑制剂)预处理细胞,验证摄取途径依赖性。
4. 基因沉默与抗肿瘤效果评估
体外实验:
siRNA负载:通过电穿孔将siPLK1(靶向Polo样激酶1)载入MEs,测定包封率(EE≈75%)和载药量(LC≈4%)。
基因沉默:RT-qPCR和Western blot检测PLK1 mRNA(84.1%下调)和蛋白表达抑制(60%)。
细胞凋亡:Annexin V-FITC/PI双染结合流式细胞术分析凋亡率(29.2% vs. 对照19.0%)。
体内实验:
皮下瘤模型:HCT116细胞接种BALB/c裸鼠,静脉注射30%Chol/MEs/siPLK1(0.1 mg/kg),每3天一次,21天后肿瘤体积减少7.3倍。
原位瘤模型:HCT116-LUC细胞植入盲肠,口服给药14天,活体成像显示肿瘤转移抑制。
安全性:血清生化(ALT/AST)和炎症因子(TNF-α/IL-6)检测证实无显著毒性。
5. 统计学分析
数据以均值±标准差表示,GraphPad Prism 8.0进行单因素方差分析(ANOVA),*P < 0.05为显著差异。
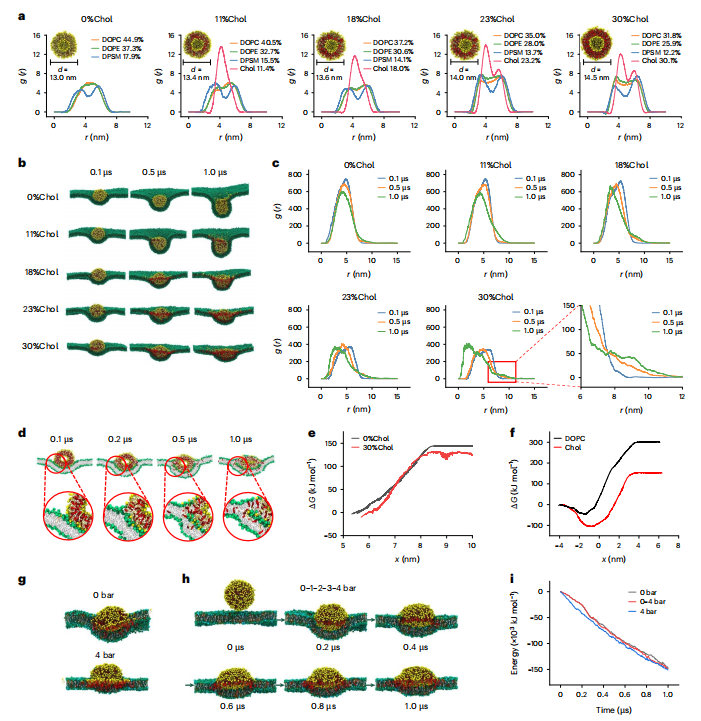
图1:胆固醇浓度对外泌体与细胞膜相互作用影响的CGMD模拟
图(a)由DOPC、DOPE和DPSM组成的外泌体分子结构表示,不同胆固醇含量下外泌体膜厚度随胆固醇浓度增加而增大。
图(b)描述外泌体与细胞膜相互作用的快照,显示基于胆固醇含量浓度的二元性:0%和11%胆固醇的外泌体中的内吞作用,以及较高胆固醇浓度(23%和30%)下的融合。
图(c)0.1μs、0.5 μs和1.0 μs下DOPC的RDF图,显示0%和11%胆固醇外泌体中的结构完整性,以及较高胆固醇下的分散分布,说明MEs向细胞膜融合的趋势。
图(d)30%胆固醇外泌体与细胞膜融合的详细可视化,从初始孔形成(0.2 μs)到融合(1.0 μs)的过程跟踪。
图(e)自由能分析表明,胆固醇含量较高的外显子释放DOPC分子所需的能量比不含胆固醇的外显子少。
图(f)DOPC和胆固醇分子穿过POPC细胞膜的自由能变化,显示胆固醇比DOPC更容易穿过细胞膜。
图(g)快照展示了含有30%胆固醇的外泌体与复杂细胞膜在恒定低张力(0 bar)和恒定高张力(4 bar)下的融合过程。
图(h)轨迹图展示了随着表面张力从0 bar逐渐增加到4 bar,融合过程的变化。这些可视化图像表明,无论细胞膜的表面张力如何,融合倾向都是一致的。复杂细胞膜中的胆固醇以白色表示,所有其他脂质分子以绿色表示。
图(i)外泌体与多组分细胞膜之间的相互作用能,表明较高的张力促进融合。胆固醇以红色杆状显示在外泌体内,白色杆状显示在细胞膜内。DOPC(黄色)、DOPE(杏色)、DPSM(橙色)、POPC(绿色)和POPE(青色)以杆状显示其疏水尾部,而只有DOPC和POPC以珠状显示其亲水头部。
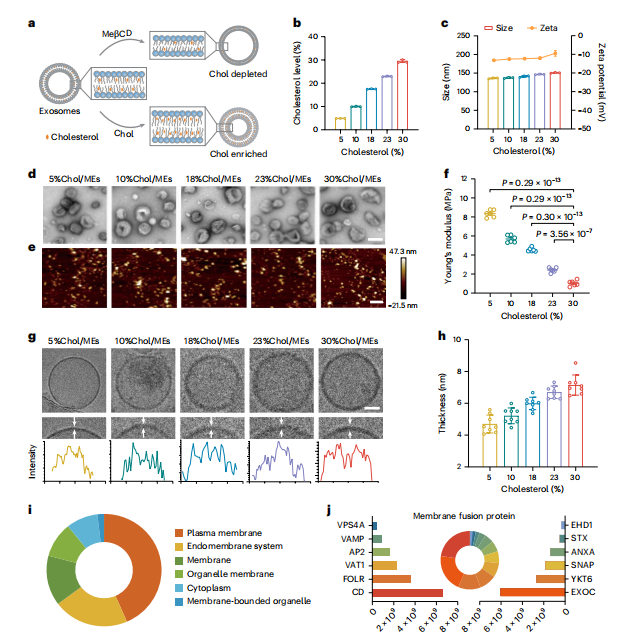
图2:不同胆固醇掺入量的MEs表征
图(a)示意图表示不同胆固醇掺入量的MEs制备过程。通过MeβCD或胆固醇处理MEs,分别降低了或增加了膜中的胆固醇含量。
图(b)通过Amplex Red胆固醇测定法检测的ME膜中的胆固醇含量(n = 3次独立实验)。
图(c)不同MEs的水动力直径和ζ电位(n = 3次独立实验)。
图(d)不同MEs的透射电子显微镜图像。比例尺,100 nm。
图(e)流体条件下不同MEs的原子力显微镜图像。比例尺,400 nm。
图(f)通过原子力显微镜测量的不同MEs的杨氏模量值(n = 6次独立实验)。
图(g)不同ME的冷冻透射电镜图像。比例尺,25纳米。
图(h)不同ME的膜厚度(n = 8个重复)。
图(i)ME的蛋白质组学分析。鉴定出的蛋白质根据其细胞成分分类。
图(j)参与膜融合的ME中蛋白质的内容和类别。所有数值均表示为平均值±标准差。统计显著性通过普通单因素方差分析结合多重比较确定。*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001.
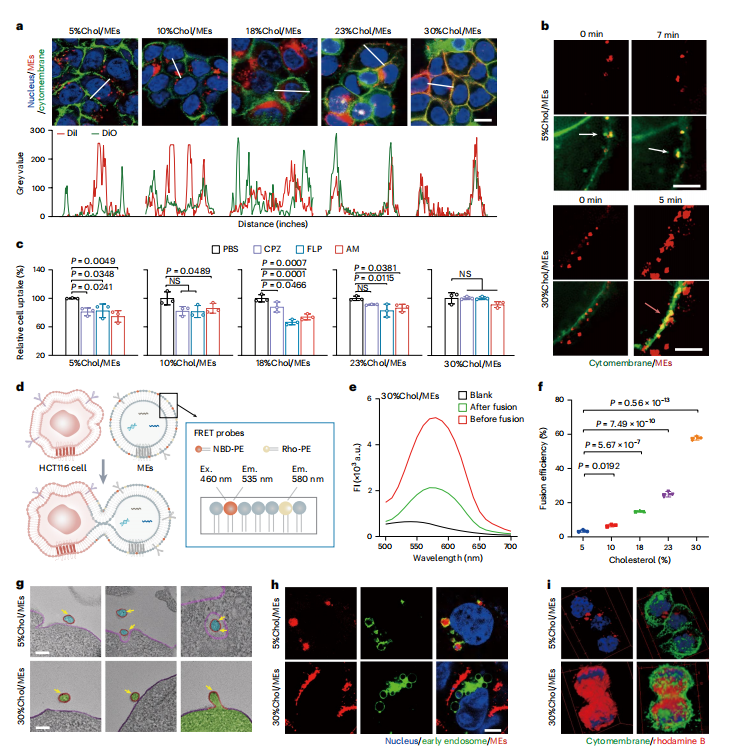
图3:不同胆固醇水平的MEs通过不同的内化途径进入细胞
图(a)CLSM图像显示了DiO标记的细胞膜与DiI标记的MEs在HCT116细胞中的相互作用。细胞核,蓝色;细胞膜,绿色;MEs,红色。比例尺,25 μm。
图(b)高智能和高灵敏度结构照明显微镜(HIS-SIM)捕捉到的工程化MEs进入HCT116细胞的快照。白色箭头表示内吞的MEs。洋红色箭头表示MEs与细胞膜的融合。DiO标记的细胞膜,绿色;DiI标记的MEs,红色。比例尺,5 μm。
图(c)在不同内吞抑制剂存在下,HCT116细胞对工程化MEs的相对摄取量。氯丙嗪(CPZ,网格蛋白介导)、菲利平(FLP,洞蛋白介导)和阿米洛利(巨胞饮介导的内吞作用)(n=3个生物学独立样本)。
图(d)示意图展示了FRET检测法监测HCT116细胞与脂质染料标记的MEs之间的膜融合。
图(e)融合改变了荧光供体NBD和荧光受体罗丹明在激发波长(Ex)为460 nm时的发射波长(Em,范围从535 nm到580 nm)强度。绘制的曲线表示染料标记的MEs与未标记的HCT116细胞之间的融合。
图(f)MEs与HCT116细胞之间的融合效率(n = 3个生物学独立样本)。
图(g)代表性生物透射电镜图像显示了金纳米颗粒标记的MEs-细胞摄取中间体。轮廓线显示了MEs(红色)和细胞膜(洋红色),由腔内灰度分布定义。黄色箭头表示金纳米颗粒。比例尺,200 nm。
图(h)来自转染EGFP标记Rab5Q79L的HCT116细胞的代表性CLSM图像。细胞与DiI标记的MEs孵育2小时。细胞核,蓝色;早期胞内体,绿色;MEs,红色。比例尺,5 μm。
图(i)经罗丹明B负载的MEs处理后HCT116细胞的3D重建共聚焦显微镜图像。细胞核,蓝色;细胞膜,绿色;罗丹明B,红色。所有数值均表示为平均值±标准差。统计显著性通过c和f中的单因素方差分析并进行多重比较确定。*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001,NS,不显著。
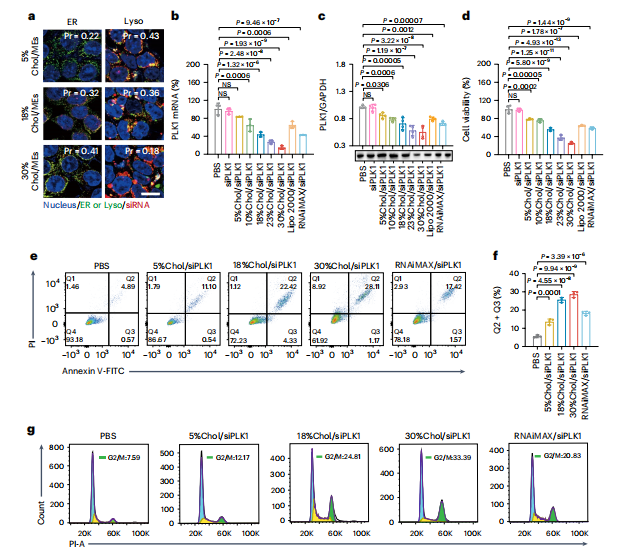
图4:负载SiPLK1的MEs在体外有效抑制了HCT116细胞的生长
图(a)CLSM图像显示了Cy3-siRNA负载的工程化MEs与溶酶体和内质网的共定位。比例尺,15 μm。
图(b–d)通过RT-qPCR检测PLK1 mRNA水平(b),通过western印迹检测PLK1蛋白表达(c)以及使用CCK-8试剂盒分析细胞活力(d) (n = 3个生物学独立样本)。
图(e,f)通过流式细胞术检查(e)和定量分析(f)HCT116细胞凋亡(n = 3个生物学独立样本)。图(g)通过流式细胞术检测HCT116细胞的细胞周期。所有数值均表示为平均值±标准差。统计显著性在b–d和f中使用普通单因素方差分析并进行多重比较确定。*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001,NS,不显著。
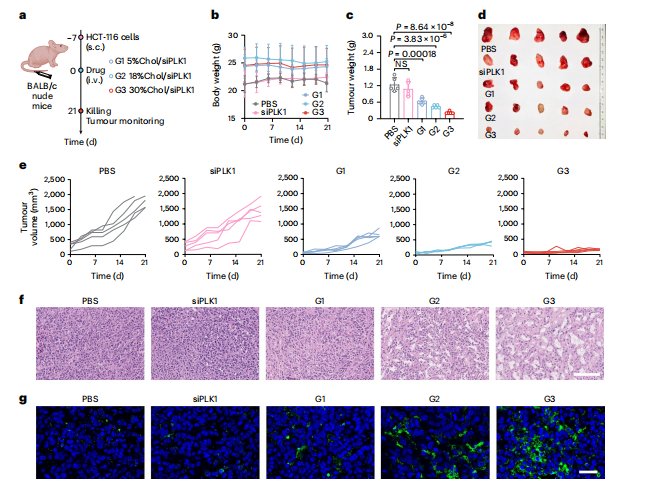
图5:负载siPLK1的MEs有效根除皮下HCT116结直肠肿瘤小鼠
图(a)体内治疗方案及分组。BALB/c裸鼠于−7天时皮下(s.c.)接种HCT116细胞(每只小鼠2×10^6个细胞),并每隔3天通过尾静脉(i.v.)给予工程化MEs(siPLK1浓度为100μg/kg−1),持续21天。九组:PBS;裸鼠siPLK1;siPLK1/电穿孔;含5%胆固醇的MEs、18%胆固醇的MEs和30%胆固醇的MEs;载有siRNA的MEs,包括5%胆固醇/siPLK1(参见G1)、18%胆固醇/siPLK1(参见G2)和30%胆固醇/siPLK1(参见G3)。
图(b)治疗期间记录的HCT116肿瘤小鼠体重(n = 5个生物学独立样本)。
图(c)实验结束时分离肿瘤组织的重量(n = 5个生物学独立样本)。
图(d)实验结束时分离肿瘤组织的光学图像。
图(e)治疗期间记录的单个肿瘤生长曲线(n = 5个生物学独立样本)。
图(f)结肠肿瘤切片的H&E染色。比例尺,100 μm。
图(g)结肠肿瘤切片的TUNEL染色。比例尺,25 μm。所有数值均表示为平均值±标准差。统计显著性通过普通单因素方差分析并进行多重比较确定。*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001,NS,不显著。
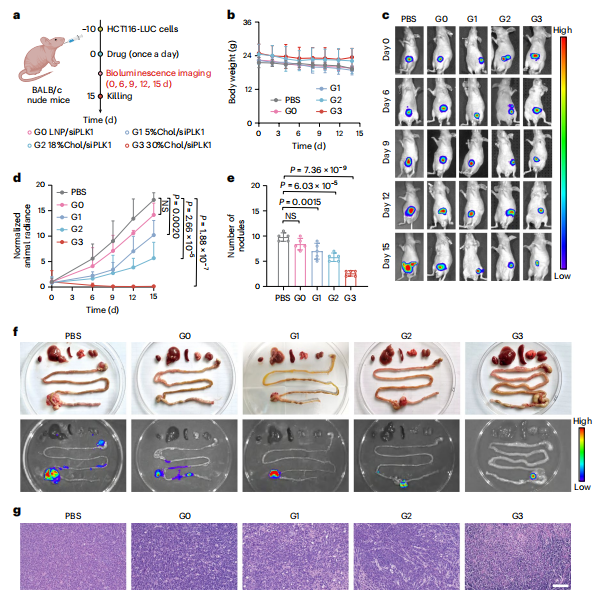
图6:负载siPLK1的MEs有效抑制原位HCT116结直肠肿瘤小鼠
图(a)体内治疗方案及分组。BALB/c裸鼠在−10天时被接种了HCT116-LUC细胞(每只小鼠3×10^6个细胞),并每天通过口服给予工程化MEs(siPLK1浓度为100μg/kg−1),持续14天。五组:PBS;G0,LNP/siPLK1;G1,5%胆固醇/siPLK1;G2,18%胆固醇/siPLK1;G3,30%胆固醇/siPLK1。
图(b)治疗期间记录的肿瘤小鼠体重(n = 5个生物学独立样本)。
图(c)指定时间点的原位结直肠肿瘤代表性体内生物发光成像。
图(d)通过量化生物发光获得的肿瘤生长曲线(n = 5个生物学独立样本)。
图(e)肿瘤结节数量(n = 5个生物学独立样本)。
图(f)不同器官的代表性体外照片(上图)和生物发光成像(下图)。
图(g)结肠肿瘤切片的H&E染色。比例尺,100 μm。所有数值均表示为平均值±标准差。统计显著性通过普通单因素方差分析并进行多重比较来确定,见b、d和e。*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001,NS,不显著。
胆固醇调控外泌体摄取途径的机制突破
首次证实通过调节外泌体膜胆固醇含量(23%-30%)可将其内化途径从传统内吞转变为膜融合,实现siRNA直接胞质递送。分子动力学模拟揭示胆固醇通过降低膜融合能量屏障(ΔG减少125 kJ/mol)、促进脂质交换和稳定融合孔,使递送效率提升5.3倍。
高效低毒的基因沉默效果
体外实验:30%Chol/MEs/siPLK1显著抑制PLK1表达(mRNA下调84.1%,蛋白60%),诱导癌细胞凋亡率(29.2%)优于商业化转染试剂(Lipofectamine 2000)。
体内实验:在结直肠癌模型中,静脉注射使肿瘤体积缩小7.3倍,口服给药有效抑制原位瘤转移,且无肝肾毒性或免疫反应。
递送系统的普适性与临床转化潜力
广谱适用性:机制验证涵盖多种外泌体(牛奶、生姜来源)及癌细胞(HCT116、HepG2等),但对正常细胞仍保持内吞途径,体现选择性。
双递送策略:突破核酸药物口服递送瓶颈,为胃肠道疾病治疗提供新方案。
平台扩展性:该技术可适配其他核酸药物(如mRNA、CRISPR),推动个性化基因治疗发展。
理论-实践闭环验证
从分子模拟预测→体外机制解析→体内疗效验证,完整阐释"胆固醇含量-膜融合效率-基因沉默效果"的量化关系,为外泌体工程化提供设计标准。
核心贡献:
创建了一种通过天然膜成分(胆固醇)调控外泌体生物学行为的新范式,解决了RNAi治疗中溶酶体逃逸和递送效率低的关键难题,兼具科学创新性与临床转化价值。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:发光追踪+细胞陷阱!科学家破解阿尔茨海默病「毒性蛋白」传播之谜
下一篇:FLuc标记技术揭秘:脂质纳米颗粒如何优化环状RNA疫苗,激活强力T细胞免疫?