常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-05-28 09:10:10 细胞资源库平台 访问量:272
乙肝病毒(HBV)感染是全球主要公共卫生问题之一,有超过2.5亿人慢性感染HBV。而其中有超三分之一的人口集中在我国,人数接近1亿人。NTCP工具细胞,特别是外源表达NTCP的肝癌细胞系如HepG2-NTCP和Huh7-NTCP,因其易操作、短周期、重现性佳的特点,在乙肝病毒(HBV)研究中扮演着至关重要的角色。这些细胞模型能够有效模拟HBV的感染过程,为研究HBV的生命周期、宿主限制因子、病毒复制以及药物筛选提供了一个强大而便捷的体外平台。它们不仅有助于揭示HBV感染的分子机制,如DDX3作为宿主限制因子阻碍cccDNA转录,GPC5作为附着因子在感染入胞过程中的作用,还能通过直接与NTCP相互作用或下调NTCP表达来筛选和验证抗病毒药物的活性,例如环孢菌素A及其衍生物、雷帕霉素及其衍生物等。此外,这些工具细胞还促进了对HBV宿主特异性分子的发现,为发展支持HBV感染的小动物模型提供了可能,这对于乙肝相关研究和药物开发具有重大意义。
英文标题:HBV-induced N6-Methyladenosine Modification of PARP1 Enhances AFB1-Related DNA Damage and Synergistically Contributes to Hepatocellular Carcinoma
中文标题:HBV诱导PARP1的N6-甲基腺苷修饰增强AFB1相关DNA损伤并协同促进肝细胞癌发生
发表期刊:《Ecotoxicology and Environmental Safety》
影响因子:6.2
作者单位:
1.Department of Hepatobiliary Surgery, The First Affiliated Hospital of Guangxi Medical University, Nanning, Guangxi 530021, PR China
2.Guangxi Medical University, Nanning 530021, PR China
3.Guangxi Key Laboratory of Enhanced Recovery after Surgery for Gastrointestinal Cancer (Guangxi Medical University), Nanning 530021, PR China
作者信息:
Xin Zhou, Tianman Li, Haixiang Xie
乙型肝炎病毒(HBV)和黄曲霉毒素B1(AFB1)是中国南方及东南亚地区肝细胞癌(HCC)高发的主要危险因素。两者协同致癌的分子机制尚不明确。本研究聚焦HBV与AFB1协同诱导DNA损伤的机制,发现HBV通过m6A甲基化修饰调控PARP1的表达,抑制DNA损伤修复能力,从而增强AFB1的基因毒性,最终协同促进HCC发生。
本研究通过构建外源性CYP3A4(细胞色素P450 3A4)和NTCP(牛磺胆酸钠共转运多肽)共表达的肝细胞模型(包括HL-7702、MIHA和Huh7细胞),模拟人体内AFB1代谢和HBV感染的双重环境。通过慢病毒感染技术实现基因稳定表达,验证CYP3A4对AFB1的代谢能力(通过检测AFB1-DNA加合物)及NTCP对HBV感染的易感性(通过HBsAg、HBV DNA和cccDNA检测)。利用彗星实验(Comet assay)和γ-H2AX免疫荧光标记评估DNA损伤,通过ROS、MDA和8-OHdG检测氧化应激水平。在动物模型中,采用HBV转基因小鼠联合AFB1灌胃(0.375 mg/kg,每2天一次,持续3周),观察肝脏病理损伤(HE染色、苏丹红染色)及DNA损伤标志物(γ-H2AX)。分子机制方面,通过RNA免疫沉淀(RIP)和甲基化RNA免疫沉淀(MeRIP)验证YTHDF2对PARP1 mRNA的m6A修饰调控,结合siRNA干扰和过表达实验明确PARP1在DNA修复中的功能。

图1:CYP3A4过表达赋予肝细胞AFB1代谢能力
本图验证了CYP3A4在AFB1代谢中的核心作用。通过慢病毒转染在HL-7702、MIHA和Huh7细胞中稳定表达CYP3A4,结果显示:① CYP3A4过表达细胞(HL-7702CYP3A4)在AFB1处理后形成特异性AFB1-DNA加合物(通过免疫荧光检测),而对照组(HL-7702NC)无此现象;② CCK-8实验显示,CYP3A4表达细胞的存活率随AFB1浓度升高显著下降(IC50 = 4.725 μM),而对照组细胞对AFB1不敏感(IC50 >10,000 μM);③ PI染色流式分析表明,AFB1诱导的细胞死亡比例在CYP3A4表达组中呈剂量依赖性增加(5 μM AFB1时死亡率为35%)。三维培养模型进一步证实,AFB1仅抑制CYP3A4表达细胞的类器官生长。这些数据表明,CYP3A4是AFB1毒性代谢的必要条件。

图2:NTCP过表达促进HBV感染
本研究通过构建NTCP过表达细胞模型,验证其对HBV的易感性。结果显示:① NTCP表达细胞(HL-7702NTCP、Huh7NTCP)感染HepG2.2.15细胞上清后,ELISA检测到HBsAg分泌(浓度达1.2 ng/mL),而对照组无HBsAg表达;② 实时荧光定量PCR显示,感染72小时后,NTCP表达细胞上清中HBV DNA拷贝数达105 IU/mL;③ cccDNA检测证实,感染两周后NTCP表达细胞内存在稳定复制的HBV cccDNA(拷贝数为每细胞102)。此外,CCK-8实验表明HBV感染对细胞活力无显著影响,排除病毒直接毒性干扰。该模型成功模拟了HBV自然感染过程,为后续协同效应研究奠定基础。

图3:AFB1诱导氧化应激及DNA损伤
本图系统评估了AFB1对肝细胞的氧化损伤和基因毒性。结果显示:① 在CYP3A4表达细胞中,AFB1(5 μM)处理48小时后,ROS水平升高2.5倍(DCF荧光强度从200增至500),MDA含量增加3倍(从1.0 nM/mg蛋白增至3.2 nM/mg),8-OHdG(氧化性DNA损伤标志)水平升高4倍(ELISA检测OD值从0.3增至1.2);② 彗星实验显示,AFB1处理组彗星尾长显著延长(从5 μm增至25 μm),且γ-H2AX荧光强度增加3倍(通过免疫荧光定量)。值得注意的是,NTCP单独表达对AFB1毒性无影响,表明CYP3A4是AFB1代谢激活的唯一限速酶。
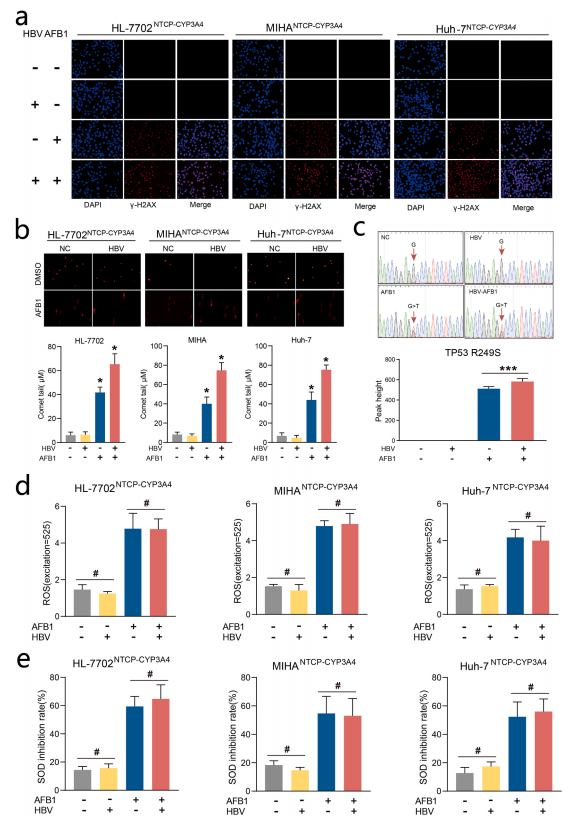
图4:HBV增强AFB1诱导的DNA损伤
本图揭示了HBV与AFB1的协同基因毒性。① γ-H2AX免疫荧光显示,HBV感染组(无AFB1)的γ-H2AX信号与对照组无差异,而HBV+AFB1组的γ-H2AX强度比单一AFB1组高2倍(荧光强度从300增至600);② 彗星实验表明,HBV+AFB1组的彗星尾长(30 μm)显著长于AFB1单独处理组(20 μm);③ Sanger测序显示,HBV+AFB1组TP53 R249S突变率为28%,显著高于AFB1单独组的12%。有趣的是,HBV感染未加剧AFB1诱导的ROS或MDA水平,表明其协同效应独立于氧化应激通路,而依赖DNA修复抑制。
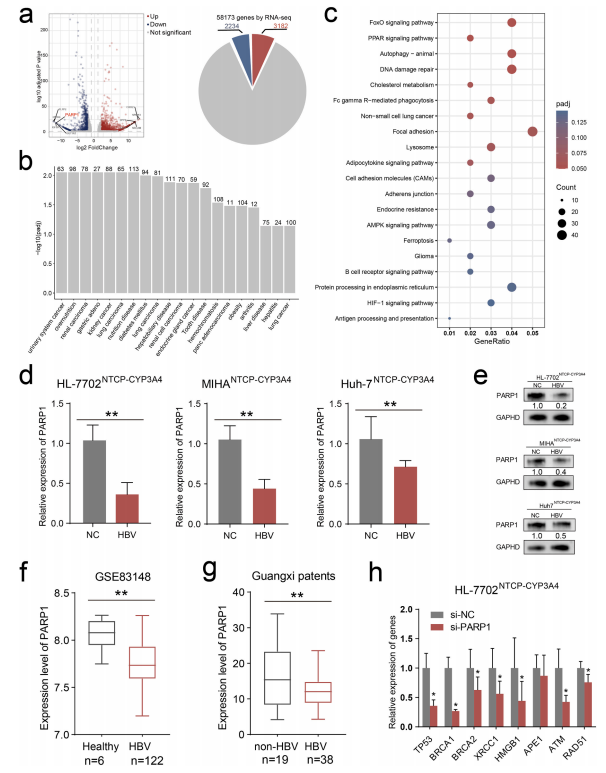
图5:HBV抑制PARP1表达
通过转录组测序和实验验证,本图阐明了HBV对PARP1的调控作用。① RNA-seq显示,HBV感染后PARP1 mRNA表达下调50%(log2FC = -1.2);② qPCR和Western blot证实,HBV感染组PARP1 mRNA和蛋白水平分别降低60%和55%;③ 临床样本分析显示,HBV阳性肝癌患者的癌旁组织中PARP1表达显著低于非HBV患者(IHC评分从8.0降至3.5)。进一步功能实验表明,PARP1敲除导致TP53、BRCA1等修复基因表达下调,提示PARP1是DNA损伤应答的核心调控因子。

图6:PARP1抑制加剧HBV/AFB1诱导的DNA损伤
本图通过遗传和药理学手段验证PARP1的功能。① siRNA敲低PARP1后,AFB1单独组的γ-H2AX强度从200增至400,而HBV+AFB1组从600增至900;② PARP1抑制剂(PARP1-IN-11,3 μM)处理24小时,彗星尾长从25 μm增至40 μm;③ 过表达PARP1可部分逆转HBV+AFB1的DNA损伤(γ-H2AX强度从600降至400)。这些数据表明,PARP1缺失是HBV/AFB1协同毒性的关键机制。
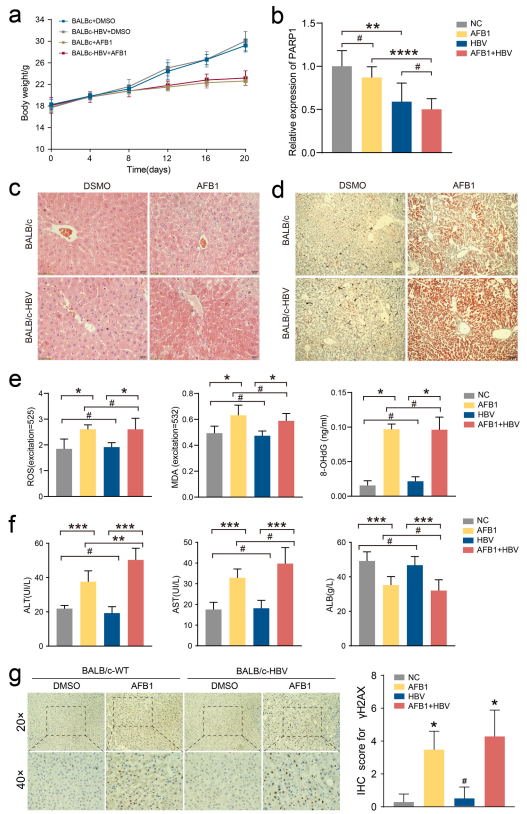
图7:动物模型中HBV/AFB1协同效应验证
HBV转基因小鼠实验证实:① AFB1灌胃导致HBV小鼠体重增长停滞(最终体重比对照组低20%),肝脏出现广泛坏死和脂质沉积(苏丹红染色阳性区域占比从5%增至30%);② HBV+AFB1组肝脏γ-H2AX阳性细胞数比AFB1单独组高2倍(每视野50 vs. 25个);③ 血清ALT/AST水平在HBV+AFB1组分别升高至120 U/L和150 U/L(AFB1单独组为80 U/L和100 U/L)。组织学与生化指标一致表明,HBV显著加剧AFB1的肝损伤效应。

图8:HBV通过YTHDF2介导PARP1的m6A修饰降解
本图解析了HBV调控PARP1的表观遗传机制。① HBV感染使YTHDF2 mRNA和蛋白水平分别升高2倍和1.8倍;② MeRIP实验显示,HBV组PARP1 mRNA的m6A修饰水平比对照组高3倍(IP/Input比值从0.1增至0.3);③ RIP实验证实,Flag-YTHDF2可特异性富集PARP1 mRNA(比IgG对照组高5倍);④ 敲低YTHDF2后,PARP1蛋白水平恢复至对照组的80%,而过表达YTHDF2使其降低60%。此外,METTL3(m6A写入酶)敲低可上调PARP1,而FTO(去甲基化酶)敲低则进一步抑制PARP1。这些数据揭示了YTHDF2-m6A-PARP1轴在HBV/AFB1协同致癌中的核心地位。
本研究发现HBV感染通过上调YTHDF2(一种m6A阅读蛋白),促进PARP1 mRNA的N6-甲基腺苷(m6A)修饰,加速其降解,从而抑制肝细胞对AFB1诱导的DNA损伤修复能力。在HBV和AFB1协同暴露下,肝细胞内γ-H2AX(双链断裂标志)水平显著升高,彗星尾长增加,且TP53 R249S突变率显著高于单一暴露组。动物实验进一步证实,HBV/AFB1双暴露导致更严重的肝细胞坏死、脂质沉积及DNA损伤。机制上,YTHDF2直接结合PARP1 mRNA并增强其m6A修饰,而抑制YTHDF2或过表达PARP1可部分逆转HBV对DNA修复的抑制作用。该研究揭示了m6A修饰在HBV与AFB1协同致癌中的关键作用,为靶向PARP1或m6A通路的肝癌治疗提供了理论依据。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
下一篇:发光追踪+细胞陷阱!科学家破解阿尔茨海默病「毒性蛋白」传播之谜