常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-05-27 09:03:11 细胞资源库平台 访问量:185
同源异体小鼠肿瘤模型是免疫肿瘤学(I/O)研究中不可或缺的临床前模型,但它们对免疫检查点抑制剂(ICIs)的反应有限,这可能是由于它们的固有低免疫原性。为了解决这一问题,研究人员通过将鸡卵清蛋白(OVA)这一高度免疫原性的蛋白质表达到同源异体肿瘤细胞中,开发了新的免疫原性同源异体模型。这些模型,如DC2.4-OVA和B16-OVA,显示出比它们的亲本细胞系更慢的肿瘤生长速度,这可能是由于免疫介导的排斥反应。更重要的是,这些OVA表达的模型对ICIs,特别是抗PD-1治疗,表现出更高的敏感性,这表明它们在增强T细胞介导的免疫反应方面具有潜力。此外,通过过继T细胞转移实验,研究人员验证了这些模型中存在肿瘤特异性记忆T细胞。这些结果表明,OVA工具细胞不仅增强了对ICIs的反应,而且为临床前免疫治疗评估提供了新的、具有更高免疫原性的同源异体模型,这对于I/O研究具有重要的意义。
英文标题:The Effect of Vector Silencing during Picornavirus Vaccination against Experimental Melanoma and Glioma
中文标题:载体沉默在小核糖核酸病毒疫苗接种治疗实验性黑色素瘤与胶质瘤中的作用
发表期刊:《PLOS ONE》
影响因子:2.9
作者单位:
1.Department of Immunology, Mayo Clinic, Rochester, MN, United States of America
2.Mayo Graduate School, Mayo Clinic, Rochester, MN, United States of America
3.Neurobiology of Disease Graduate Program, Mayo Clinic, Rochester, MN, United States of America
4.Department of Neurology, Mayo Clinic, Rochester, MN, United States of America
作者信息:
Courtney S. Malo, Danielle N. Renner, April M. Huseby Kelcher, Fang Jin, Michael J. Hansen, Kevin D. Pavelko, Aaron J. Johnson
病毒载体疫苗通过表达肿瘤特异性抗原来激活CD8 T细胞免疫反应,但病毒载体自身的免疫原性可能引发针对病毒抗原的CD8 T细胞反应,二者是否竞争或协同尚不明确。本研究以小核糖核酸病毒(TMEV)为载体,工程化表达模型抗原OVA257-264,探究通过肽段沉默(Vector Silencing)抑制病毒载体优势表位VP2121-130特异性CD8 T细胞反应后,对肿瘤抗原特异性免疫应答的影响。实验采用外周黑色素瘤(B16-OVA)和中枢神经系统胶质瘤(GL261-quad cassette)两种模型,评估沉默策略对疫苗疗效的调控作用。
本研究通过构建表达模型抗原OVA257-264的小核糖核酸病毒载体(TMEV-OVA),结合肽段沉默策略(静脉注射VP2121-130肽段抑制病毒载体优势表位特异性CD8 T细胞反应),评估其对肿瘤免疫治疗的调控作用。实验采用两种动物模型:皮下接种表达OVA257-264的B16-OVA黑色素瘤小鼠(疫苗于肿瘤植入后第6天腹腔接种)和颅内接种GL261-quad cassette胶质瘤小鼠(疫苗于肿瘤植入后第14天颅内接种)。通过流式细胞术分析脾脏及脑浸润淋巴细胞中VP2121-130和OVA257-264特异性CD8 T细胞频率,结合细胞内IFNγ染色验证功能活性;肿瘤进展通过卡尺测量(黑色素瘤)和生物发光成像(胶质瘤)量化。对照组使用无关肽段(E749-57)以排除非特异性效应,统计方法包括t检验和Kaplan-Meier生存分析。
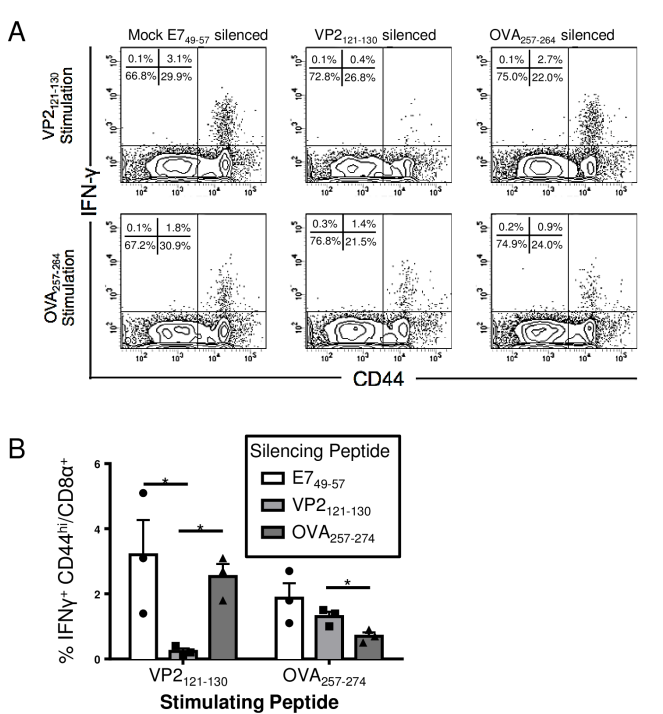
图1:外周感染中CD8 T细胞表位沉默的验证
通过流式细胞术验证肽段沉默对CD8 T细胞反应的抑制作用。小鼠静脉注射VP2121-130或对照肽段后,腹腔接种TMEV-OVA病毒。7天后分离脾细胞,用VP2121-130或OVA257-264肽段刺激,检测IFNγ分泌。结果显示,VP2121-130沉默组中VP2121-130特异性CD8 T细胞比例显著降低(0.1% vs. 68.8%),但OVA257-264反应未受影响。证明外周感染中病毒载体与肿瘤抗原的CD8 T细胞反应无竞争。
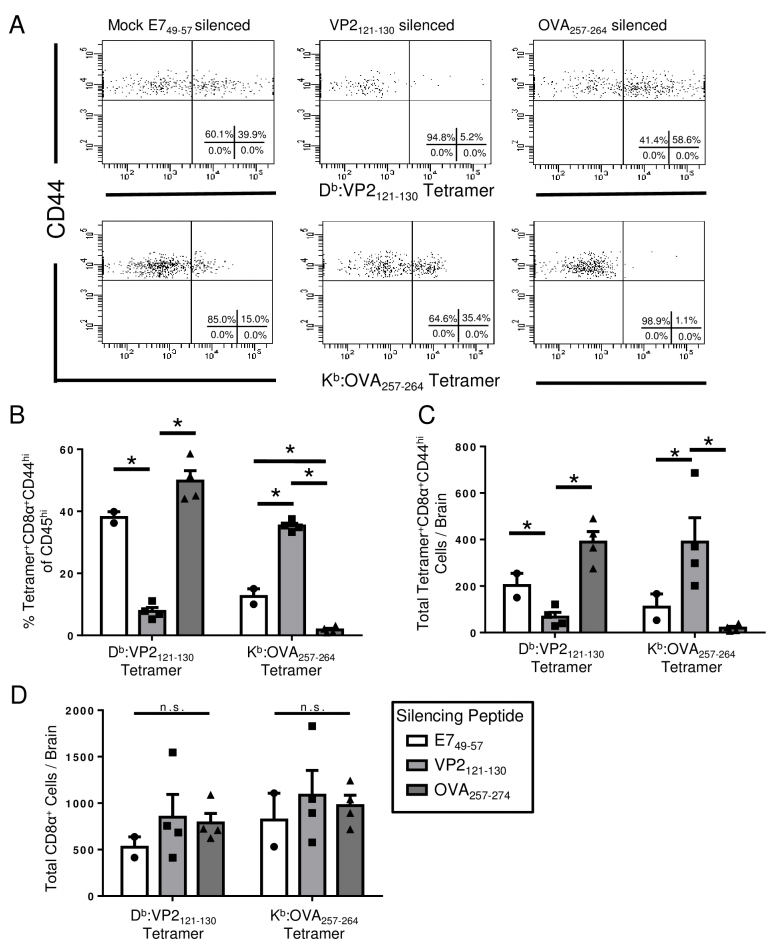
图2:中枢感染中CD8 T细胞反应的竞争效应
颅内接种TMEV-OVA后,分析脑浸润淋巴细胞。VP2121-130沉默组中VP2121-130特异性CD8 T细胞比例降低(0.9% vs. 1.7%),但OVA257-264反应显著升高(71.2% vs. 73.3%),表明中枢感染中存在表位竞争。沉默病毒载体反应可释放资源(如APC或细胞因子),增强靶向抗原应答。
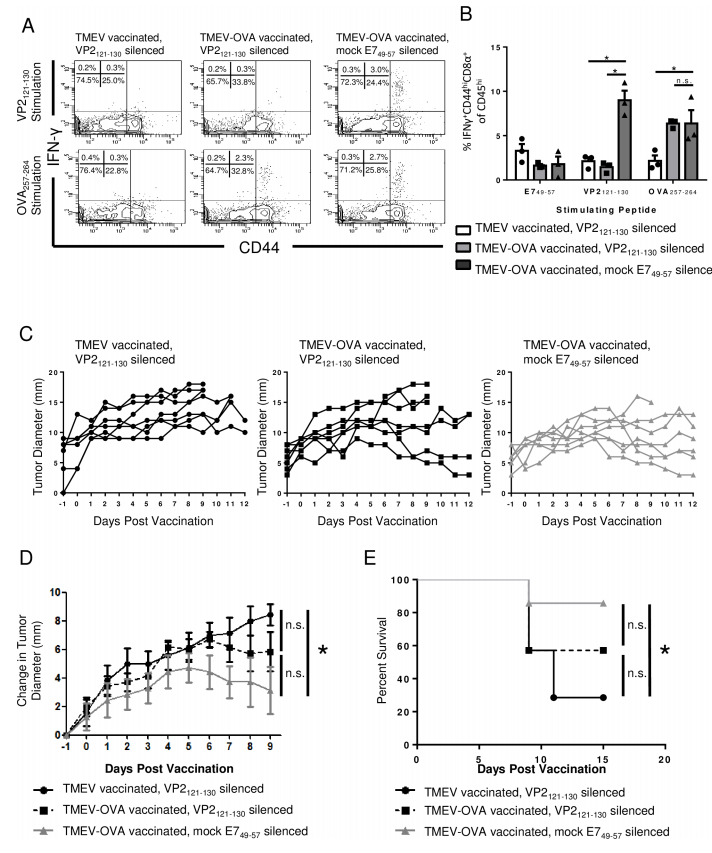
图3:黑色素瘤模型中载体沉默对疫苗疗效的影响
B16-OVA荷瘤小鼠接受TMEV-OVA疫苗联合沉默处理。流式显示VP2121-130沉默组中病毒载体特异性CD8 T细胞减少,但OVA257-264反应未增强。肿瘤直径和生存曲线显示,无论是否沉默,TMEV-OVA均抑制肿瘤生长,沉默无额外获益。提示外周肿瘤中病毒载体反应不干扰疫苗效果。
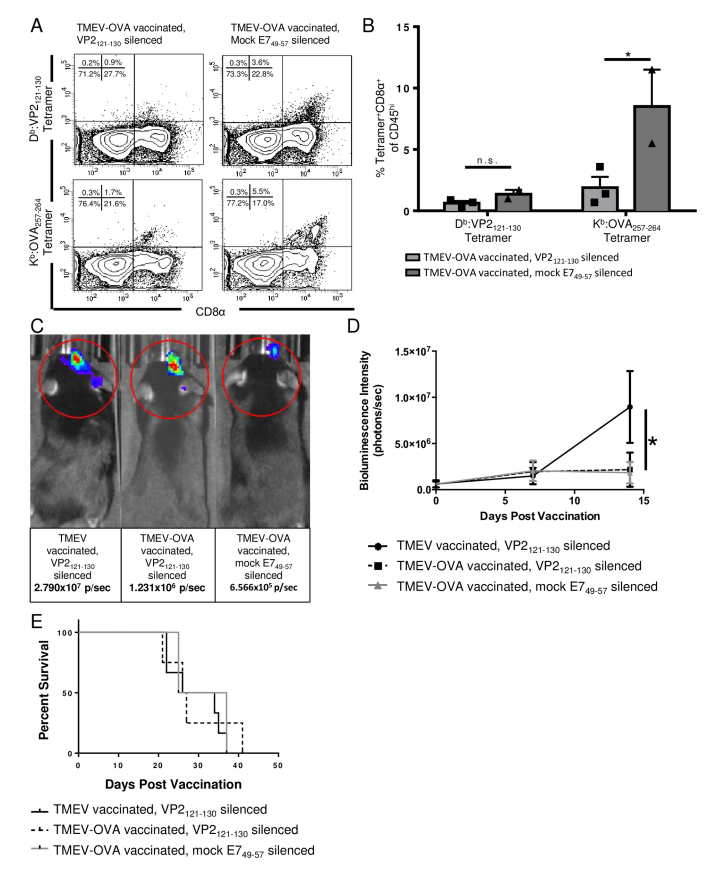
图4:胶质瘤模型中载体沉默的免疫与疗效分析
GL261-quad cassette荷瘤小鼠接受TMEV-OVA疫苗后,脑浸润淋巴细胞分析显示,VP2121-130沉默组中OVA257-264特异性CD8 T细胞频率显著降低(0.3% vs. 1.7%),但肿瘤负荷和生存率与对照组无差异。BLI成像显示TMEV-OVA疫苗本身有效,沉默未进一步改善疗效。表明胶质瘤微环境中病毒载体反应可能通过未知机制增强靶向免疫,沉默反而有害。
研究表明,病毒载体特异性CD8 T细胞对疫苗疗效的影响因肿瘤类型而异。在B16-OVA黑色素瘤模型中,沉默VP2121-130反应虽抑制病毒载体特异性CD8 T细胞,但未增强OVA257-264靶向免疫,且肿瘤控制与生存率与未沉默组无差异,提示外周肿瘤中病毒载体反应不干扰疫苗效果。相反,在GL261胶质瘤模型中,沉默VP2121-130反应导致OVA257-264特异性CD8 T细胞频率显著降低,但肿瘤负荷与生存率未进一步改善,表明中枢神经系统中病毒载体反应可能通过协同机制(如增强抗原提呈或局部炎症)间接支持靶向免疫。总体而言,病毒载体特异性CD8 T细胞的作用具有微环境依赖性,沉默策略需根据肿瘤类型谨慎应用。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:双模态成像锁定干细胞最佳注射途径,瘤周注射效果碾压传统方案
下一篇:乙肝病毒联手黄曲霉毒素!科学家破解肝癌高发之谜:PARP1甲基化是关键