常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-05-24 09:00:00 细胞资源库平台 访问量:291
英文标题:Localized Microrobotic Delivery of Enzyme-Responsive Hydrogel-Immobilized Therapeutics to Suppress Triple-Negative Breast Cancer
中文标题:酶响应性水凝胶固定化药物的微机器人局部递送抑制三阴性乳腺癌
发表期刊:《Small》
影响因子:13.7
作者单位:
上海交通大学医学院机器人研究所(M. Tian, B. Han, G.-Z. Yang)
帝国理工学院哈姆林中心(M. Keshavarz)
作者信息:
Mingzhen Tian, Meysam Keshavarz, Ali Anil Demircali, Bing Han, Guang-Zhong Yang
背景:三阴性乳腺癌(TNBC)因其侵袭性强、缺乏雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2),治疗选择有限且预后较差,成为临床治疗难题。
治疗局限性:当前三阴性乳腺癌主要依赖新辅助化疗,但存在全身毒性大、药物分布不均和耐药性等问题。局部给药系统虽能减少副作用,但传统方法在载药能力、靶向性和微环境响应性方面存在不足。
技术启发:微机器人技术为药物递送提供了新思路,但其载药能力和刺激响应性不足限制了应用。
新发现:研究团队开发了一种名为“ChemoBot”的微机器人系统,通过磁导航将载药水凝胶精准递送至肿瘤部位。
机制:ChemoBot的核心为明胶甲基丙烯酰(GelMA)水凝胶,负载化疗药物多柔比星(Dox)和磁性纳米颗粒(MNPs),通过肿瘤微环境中过表达的基质金属蛋白酶(MMP2/MMP9)触发水凝胶降解,实现药物可控释放。
意义:该技术为TNBC的局部治疗提供了创新策略,显著减少系统毒性并增强疗效。
微机器人设计与制备:
外壳结构:采用双光子聚合(2PP)技术3D打印多孔聚乙二醇二丙烯酸酯(PEGDA)外壳,提供机械支撑和保护。。
核心水凝胶:填充明胶甲基丙烯酰(GelMA)水凝胶,负载磁性纳米颗粒(MNPs)和化疗药物阿霉素(Dox)
磁性纳米颗粒表征:
透射电镜(TEM)和动态光散射(DLS)验证MNPs的尺寸和分散性。
振动样品磁强计(VSM)分析其磁响应特性。
药物释放实验:
在PBS和模拟肿瘤微环境(含MMP2/MMP9)中测定Dox的累积释放曲线。
体内外实验验证:
体外实验:通过MTT法测定Dox对4T1细胞的半数抑制浓度(IC50)。
体内实验:在BALB/c小鼠TNBC模型中评估ChemoBot的抑瘤效果和安全性。
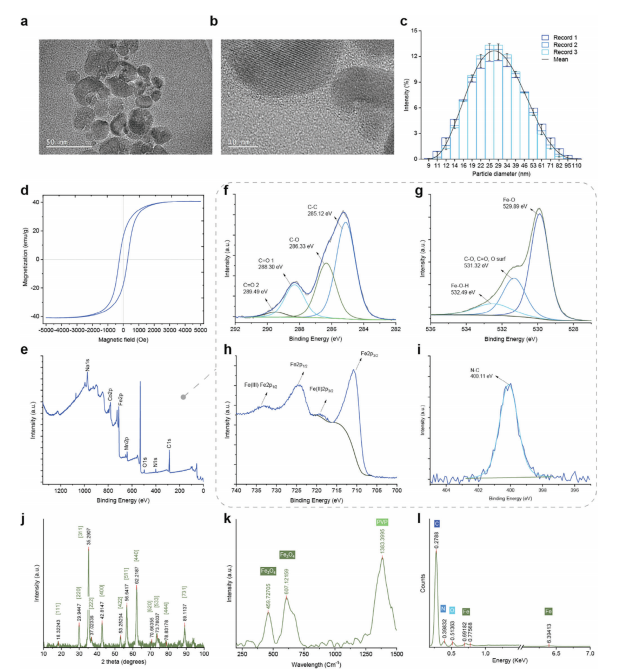
图1:PVP包覆四氧化三铁纳米颗粒的综合表征
图(a,b)为透射电子显微镜(TEM)图像显示PVP包覆的四氧化三铁纳米颗粒,突出了其独特的核壳结构,晶态四氧化三铁核心与非晶态PVP壳层之间有明显的分界。
图(c)为颗粒尺寸分布直方图,由动态光散射(DLS)分析得出,显示平均颗粒尺寸为27纳米,分布范围从9到100纳米(n = 3;均值±标准差)。
图(d)通过振动样品磁强计(VSM)获得的磁滞回线展示了纳米颗粒的磁性特性,包括最大饱和磁化强度(Ms)为40 emu/g和矫顽力(Hc)为280 Oe,表明其顺磁行为及适用于需要快速磁响应的应用。
图(e–i)磁性纳米颗粒的X射线光电子能谱(XPS)光谱及Fe、C、N和O的去卷积光谱,提供了四氧化三铁核心成分和PVP包覆成功的证据,特征C═O、C–O和C–C键的存在表明这一点。
图(j)粉末X射线衍射(PXRD)图谱证实了四氧化三铁的结晶相,具有与磁铁矿结构相对应的明显峰,证实了其身份和纯度。
图(k)拉曼光谱进一步支持了纳米颗粒的结构完整性和组成,峰对应于PVP涂层中的Fe-O伸缩振动和C-N伸缩振动。
图(l)能量色散X射线(EDX)元素分析揭示了主要成分是碳,同时还有氮、氧和铁,这证实了PVP涂层的存在以及四氧化三铁核心的组成。这些表征阐明了纳米颗粒的结构、化学和磁性特性,表明它们在生物医学应用中具有潜力,包括作为靶向治疗用微机器人组件。
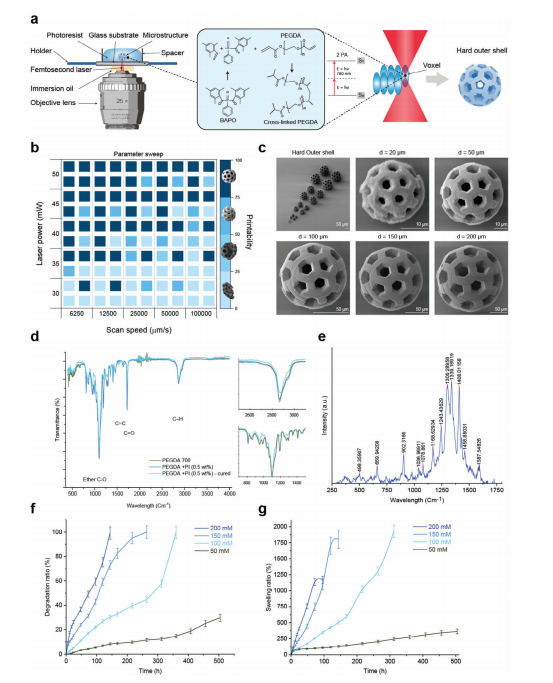
图2:使用双光子聚合技术对化学机器人硬外壳进行三维微打印
图(a)化学机器人设计的示意图,其特点是具有用于药物封装和释放的孔隙的硬壳空心结构,通过双光子聚合(2PP)制造。右侧展示了在形成切片3D构建体过程中双光子吸收和光交联的过程。
图(b)优化打印参数的参数扫描图,包括激光速度(μm−1秒)和功率(毫瓦),以实现所需的分辨率,作为光引发剂(PI)浓度的函数。右侧插图显示了SEM图像,将光刻胶的可打印性分为四个分辨率类别:0-25%(差),25-50%(低),50-75%(可接受),75-100%(最佳),分别对应PI浓度为0.125%,0.25%,1%,和0.5%。较高的激光功率和较慢的扫描速度被发现可以提高所有PI浓度下的打印性能,其中0.5%的PI提供了高分辨率特征的最佳平衡,同时不牺牲结构稳定性。此热图中的每个立方体分别对应于右上角和左上的0.5%和1%的PI浓度,以及右下角和左下的0.125%和0.25%的PI浓度。
图(c)扫描电子显微镜(SEM)图像显示了不同尺寸的制备好的硬外壳ChemoBot,放大图像展示了表面分辨率。比例尺以微米(μm)为单位。
图(d)PEGDA 700在BAPO光固化前后的傅里叶变换红外(FTIR)光谱,表明有效聚合。插图显示了与醚键C–O和C–H对应的特征振动峰的减少,证实了交联聚合物网络的形成。
图(e)固化光刻胶的拉曼光谱,确认了0.5% PI浓度下丙烯酸酯官能团的化学结构和有效聚合。图(f-g)在浓度为50至200×10−3 m的氯化钠溶液中,对含有0.5% PI的光交联PEGDA 700进行降解和膨胀研究,证明了ChemoBot对生理环境的响应行为。
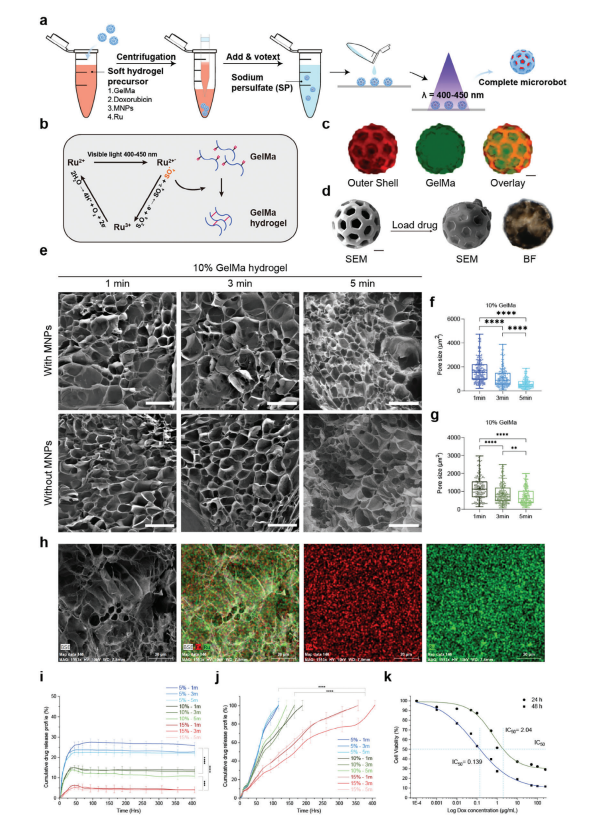
图3:固定治疗药物的软核水凝胶中的持续刺激响应药物释放。
图(a)化疗机器人整体载荷过程。
图(b)采用钌(Ru)过硫酸钠(SPS)基光引发剂对明胶甲基丙烯酰(GelMA)进行光交联的示意图。
图(c)化疗机器人硬外壳用伊红染色(红色)和装载FITC染色水凝胶后(绿色)的荧光显微镜图像,以及叠加图像以验证载荷加载协议。比例尺,20 μm。
图(d)装载后的化疗机器人扫描电子显微镜图像。含有Dox和MNPs的GelMA。比例尺,20 μm。图(e)透射电子显微镜图像显示了Ru交联GelMA水凝胶在可见光(400–450 nm)照射1、3和5 min后有无MNPs的形态(比例尺,200 μm)。
图(f,g)10%w/v GelMA水凝胶在1、3和5 min固化后的孔径分布,无论是否加入MNPs。数据表明,随着固化时间的增加,平均孔径减小(n = 3)。
图(h) EDX元素映射,突出显示Ru和Fe的均匀分布,证明了MNPs在交联GelMA基质中的均匀掺入。比例尺,20 μm。
图(i)在磷酸盐缓冲液(PBS)中400小时内Dox的累积释放曲线,展示了15%、10%和5%药物固定化GelMA的初始高释放率,分别在前48小时内达到6%、15%和23.5%(n=6)。
图(j)在肿瘤微环境刺激下,模拟酶活性的累积多柔比星释放曲线,显示5%、10%和15%载药GelMA的持续释放时间分别为117小时、165小时和357小时(n = 6)。
图(k)半数抑制浓度(半抑制浓度)值表明,在24小时和48小时后,抑制4T1细胞生长50%所需的药物剂量,为载药水凝胶的治疗效果提供了见解。
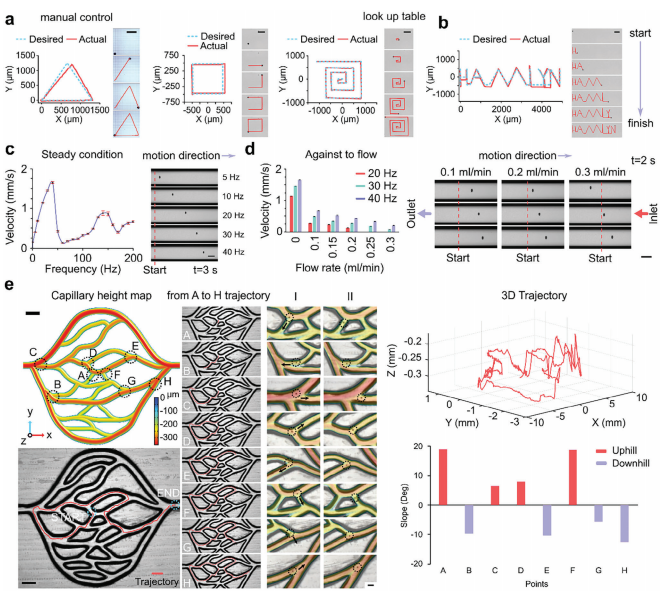
图4:化学机器人磁驱动与控制
图(a)轨迹和延时图像(右侧)展示了化学机器人沿预设的三角形、矩形和螺旋路径(蓝色虚线表示)进行控制和磁推进导航的过程,显示了化学机器人精确跟随预定轨迹(红色显示)。比例尺,500 μm。
图(b)轨迹和延时图像(右侧)描绘了化学机器人沿预设轨迹“HAMLYN”(蓝色虚线表示)进行路径规划控制导航的过程,展示了化学机器人在追踪预定路径方面的准确性(红色显示)。比例尺,500 μm。
图(c)在静态流体条件下,分析平面表面上的化学机器人速度显示了速度与施加频率之间的线性关系(最高至40 Hz),化学机器人在40 Hz时平均速度为1653±24μm−1 s,在30 Hz时下降到1456±12.8μm−1 s。右侧展示了化学机器人在微管通道中不同施加频率下3秒后的快照图像,起始位置相同(由红色虚线垂直线标出)。
图(d)在流体流动条件下评估ChemoBot的频率依赖推进速度,以评估其上游导航能力。在流速为0.1 mL min−1时,记录到的最大速度为687±10μm−1 s,频率为40 Hz。将流速增加到0.2 mL min−1时,ChemoBot的上游移动速度降低至433±9.7μm−1 s,频率仍为40 Hz。误差条表示标准偏差。右侧展示了ChemoBot在不同流速0.1、0.2和0.3 mL min−1以及应用频率20、30和40 Hz下,通过微流体通道的延时图像,从上至下显示。
图(e)一个具有分支通道的微毛细管微流体系统。比例尺,1 mm。延时图像和轨迹分析展示了ChemoBot在不同深度的微毛细血管模型中的控制和导航能力,证明了ChemoBot能够以滚动运动的方式上下移动。比例尺,500 μm。右侧显示了3D轨迹,强调了指定点的上下坡度。
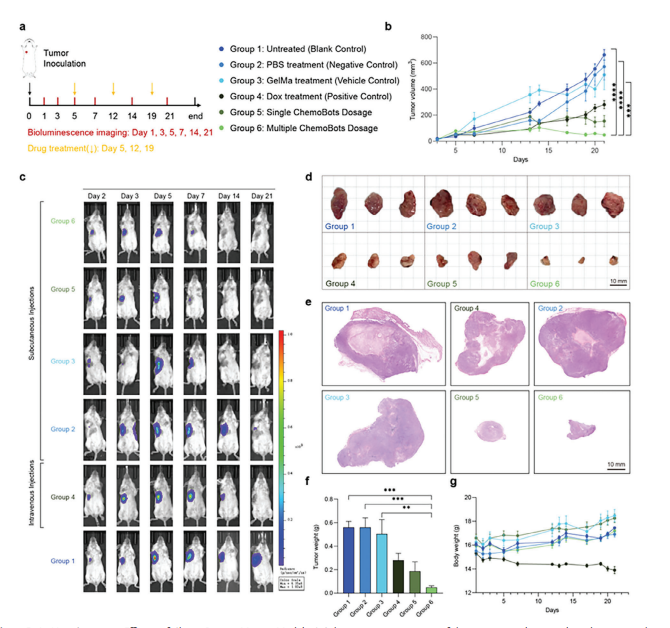
图5:ChemoBots在小鼠模型中的体内抗肿瘤效果
图(a)用于评估ChemoBots在携带4T1-Luc肿瘤的BALB/c小鼠中治疗效果的实验方案示意图。该图概述了以下组别的治疗时间表和生物发光成像间隔:未处理(空白对照)、PBS处理(阴性对照)、多柔比星处理(阳性对照)、GelMa处理(载体对照)、单次ChemoBots给药和多次ChemoBots给药。第0天,将4T1-Luc细胞(5×10^5)皮下接种到BALB/c小鼠的乳腺脂肪垫中。当肿瘤体积达到30 mm³时(每组n=5),开始治疗。多柔比星每周给药一次,在第5、12和19天以10 mg kg−1的剂量给药;单次ChemoBots给药在第5天,多次ChemoBots给药在第5、9和19天。生物发光成像用于监测第1、3、5、7、14和21天的小鼠。
图(b)每组(n = 5)的肿瘤生长曲线,使用游标卡尺在21天内特定日期测量肿瘤体积。肿瘤体积(mm³)计算公式为(π/6)×长度×宽度²。数据以均值±标准差表示(n = 5;单因素方差分析;***,p < 0.001;****,p < 0.0001)。
图(c)小鼠携带4T1-Luc肿瘤后接受单次或多次ChemoBot治疗、全身化疗及相应溶剂或对照的体内生物发光图像。这些图像展示了通过荧光素酶活性测量的肿瘤负荷减少情况,使用一致的光子通量尺度(n = 5)。
图(d)治疗后的肿瘤图像,直观比较了多次ChemoBot疗法与系统化疗所达到的尺寸减小效果。值得注意的是,一次给药的ChemoBot导致的肿瘤大小减少与连续三周每周一次系统化疗观察到的效果相当(n = 3)。比例尺:10毫米。
图(e)对接受全身化疗、单次或多次ChemoBot、PBS或GelMa治疗的小鼠切除肿瘤进行苏木精和伊红(H&E)染色的组织病理学检查,分别作为阴性对照、溶剂对照或阳性对照。比例尺:10毫米。
图(f)在21天实验结束时测量各组平均肿瘤重量,以确定肿瘤减少率。数据以均值±标准差表示(n = 5;统计分析采用单因素方差分析;**,p < 0.01;***,p < 0.001)。
图(g)在整个研究期间监测每个治疗组的体重,强调了与全身化疗相比的治疗耐受性,后者观察到持续的体重下降,并在指定时间点进行了详细测量。数据以均值±标准差表示(n = 5)。
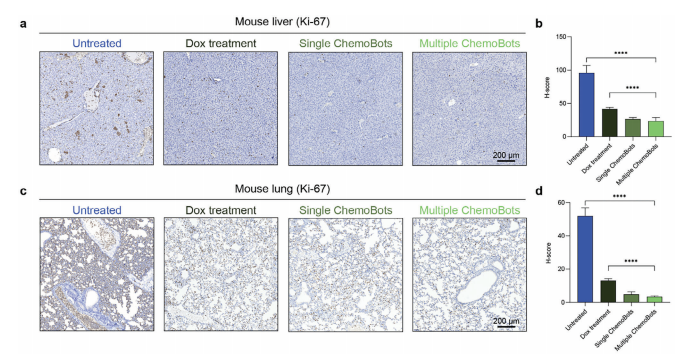
图6:展示了ChemoBots的转移抑制特性
图(a,c)分别对肝和肺转移灶中的Ki67进行免疫组化(IHC)分析,Ki67是细胞增殖的标志物。这些分析涵盖了六个治疗组:未处理(空白对照)、PBS处理(阴性对照)、多柔比星处理(阳性对照)、GelMa处理(载体对照)、单次ChemoBot给药以及多次ChemoBot给药。量化了Ki-67阳性细胞的百分比,并计算了各治疗组中Ki67表达的H评分,分别见图(b)肝组织和图(d)肺组织。数据以均值±标准差表示(n = 5;统计分析采用单因素方差分析,****,p<0.0001)。
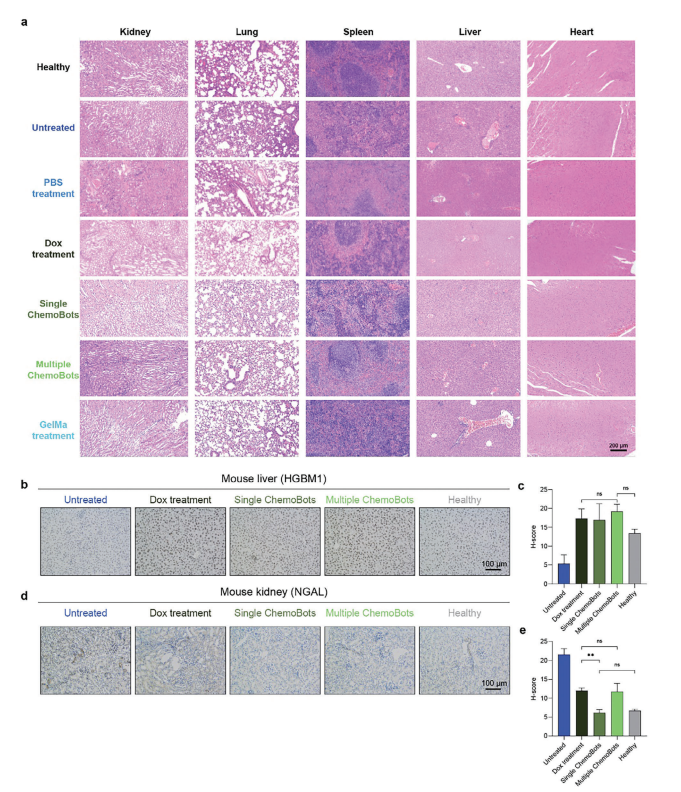
图7:ChemoBot的生物安全性
图(a)通过H&E染色进行组织学检查,评估治疗后主要器官——心脏、肝脏、脾脏、肺和肾脏的状态,参考了之前提到的六个组以及健康小鼠。比例尺代表200 μm。
图(b,d) IHC图像显示了HMGB1,即肝损伤标志物,和NGAL,即肾损伤标志物的染色情况,以评估ChemoBot治疗对肝脏和肾脏的副作用与其他治疗方案相比。未接种肿瘤且未注射药物的健康组小鼠作为参考。
图(c,e)肝脏和肾脏组织对应的H评分,表示阳性细胞的比例。(n = 3;统计分析采用单因素方差分析,**,p < 0.01)。
主要发现:
ChemoBot通过磁导航和酶响应性水凝胶实现了TNBC的局部高效治疗。
单次治疗即可达到优于系统化疗的效果,且安全性更高。
机制解析:
GelMA水凝胶在MMP2/MMP9作用下降解,实现药物可控释放。
磁性导航确保药物精准递送,减少脱靶毒性。
转化价值:
为TNBC及其他实体瘤的局部治疗提供了新工具,具有广阔的临床应用前景
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:近红外荧光探针NIRBADs实现实时动态追踪,告别传统血清指标局限!
下一篇:双模态成像锁定干细胞最佳注射途径,瘤周注射效果碾压传统方案