常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-05-23 09:00:00 细胞资源库平台 访问量:148
在生物医学研究和药物开发领域,生物发光成像技术因其高信噪比而被广泛应用于细胞测定和动物成像研究。然而,传统的荧光素酶种类有限,限制了同时成像多个分子和细胞事件的能力。为了突破这一限制,科学家们开发了一种新型的ATP非依赖性荧光素酶——NanoLuc(NL),它源自深海虾Oplophorus
gracilirostris,并经过工程改造以增强蛋白质稳定性。NanoLuc作为一种小型(19
kDa)、高亮度的荧光素酶,其亮度是传统萤火虫或海肾荧光素酶的100倍,并且使用furimazine作为底物产生明亮的辉光型发光。
NanoLuc的意义在于其为双报告基因生物发光分子成像提供了新的可能。它不仅可以在活体小鼠的表层和深层组织中成像,而且其生物发光随时间的变化可以用来定量肿瘤生长,甚至在少量血清中也能检测到分泌的NL。此外,NanoLuc与萤火虫荧光素酶的结合使用,为在完整细胞和活体小鼠中定量TGF-β信号传导的两个关键步骤提供了一种新型双荧光素酶成像策略,从而在正常生理、疾病和药物开发中扩展了信号转导的成像能力。NanoLuc的作用不仅体现在其高灵敏度和高稳定性上,它还具有更小的尺寸,这使得在标记细胞和蛋白质时对样本的侵入性更小,有助于保持细胞或组织的天然状态。NanoLuc的快速反应、低背景发光和多样灵活等特点,使其在生物学和医学研究中具有广泛的应用前景。因此,NanoLuc作为一种新的报告基因,不仅增强了我们对生物过程的理解和疾病机理的研究,而且在开发潜在治疗方法和疗法方面发挥了重要作用。
英文标题:A novel noninvasive test based on near-infrared fluorescent cholephilic probes for hepatobiliary secretory function assessment
中文标题:基于近红外荧光亲胆探针的新型无创检测方法用于评估肝胆分泌功能
发表期刊:《Biomedicine & Pharmacotherapy》
影响因子:6.9
作者单位:
1.Experimental Hepatology and Drug Targeting (HEVEPHARM), University of Salamanca, IBSAL, Salamanca, Spain
2.Center for the Study of Liver and Gastrointestinal Diseases (CIBEREHD), Carlos III National Institute of Health, Madrid, Spain
3.Liver Disease Laboratory, Center for Cooperative Research in Biosciences (CIC bioGUNE), Basque Research and Technology Alliance (BRTA), Derio, Spain
作者信息:
Beatriz Sanchez de Blas, Alvaro G. Temprano, Candela Cives-Losada
传统的血清生物标志物(如转氨酶、胆红素)无法准确反映肝功能损伤程度,尤其在胆汁淤积等病理状态下。近红外(NIR)荧光技术因具有深层组织穿透能力,成为无创监测的潜在工具,但现有探针(如吲哚菁绿)缺乏肝胆特异性。本研究设计了一类新型近红外荧光胆酸衍生物(NIRBADs),通过结合胆酸结构与NIR荧光基团,旨在开发一种无创、实时评估肝胆分泌功能的方法。NIRBADs通过模拟天然胆酸的转运途径,可被肝细胞特异性摄取并分泌至胆汁,其荧光信号可通过体外检测实现功能评估。研究验证了其在多种胆汁淤积动物模型中的应用潜力,为临床转化提供了理论基础。
1.细胞实验:在表达人源转运蛋白(NTCP、OATP1B1/B3)的CHO-K1细胞中评估NIRBADs的摄取能力。
2.动物模型:
大鼠:急性肝细胞性胆汁淤积(毒蕈碱诱导)、胆管结扎(BDL)模型。
小鼠:Mdr2缺陷型自发性硬化性胆管炎模型。
3.体内荧光监测:通过腹腔镜或体外NIR成像实时追踪NIRBADs的肝胆动态。
4.代谢分析:HPLC-MS/MS检测胆汁中NIRBADs及其代谢产物。
5.分子模拟:通过分子对接和动力学模拟分析NIRBAD-1与OATP1B3的相互作用。
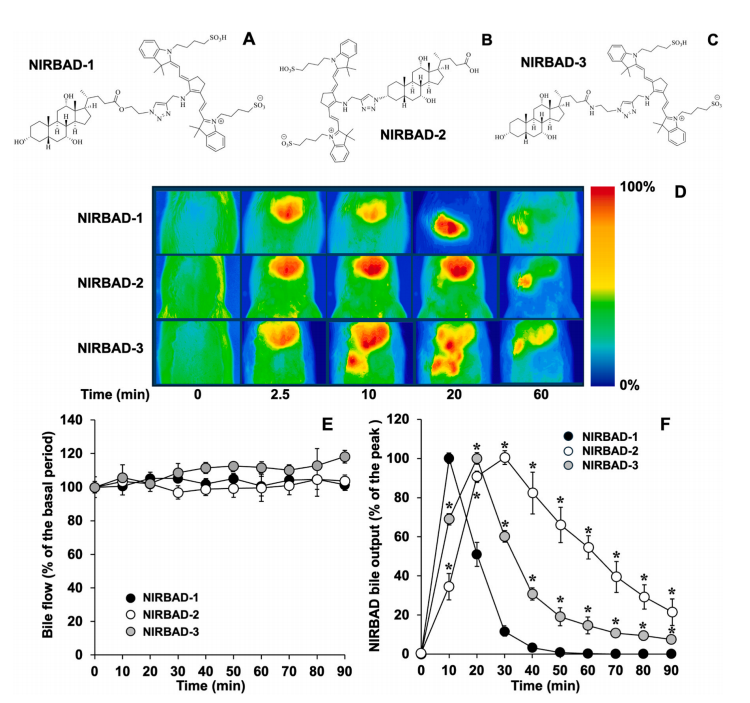
图1:NIRBADs 的化学结构及肝胆荧光动力学与胆汁分泌功能评估
本图展示了三种新型近红外荧光胆汁酸衍生物(NIRBAD-1、NIRBAD-2、NIRBAD-3)的化学结构(图A-C)。这些化合物通过将胆酸(CA)与近红外荧光基团(如炔氰胺718)通过酯键、酰胺键或三唑键连接合成。静脉注射后,通过无创近红外荧光成像(激发波长710 nm,发射滤光片785–900 nm)在大鼠腹部检测到荧光信号,显示NIRBADs首先在肝脏富集,随后转移至肠道(图D)。通过胆管插管实验(图E-F)发现,NIRBADs对胆汁流量无显著影响(p > 0.05),但其胆汁荧光输出动力学差异显著:NIRBAD-1在60分钟内完全排泄,而NIRBAD-2在90分钟后仍有残留(图F)。血清生化指标(补充表1)证实其无急性毒性。这些结果表明,NIRBADs具备作为无创肝胆功能探针的潜力,其排泄速度与分子结构(如酯键易水解)密切相关。
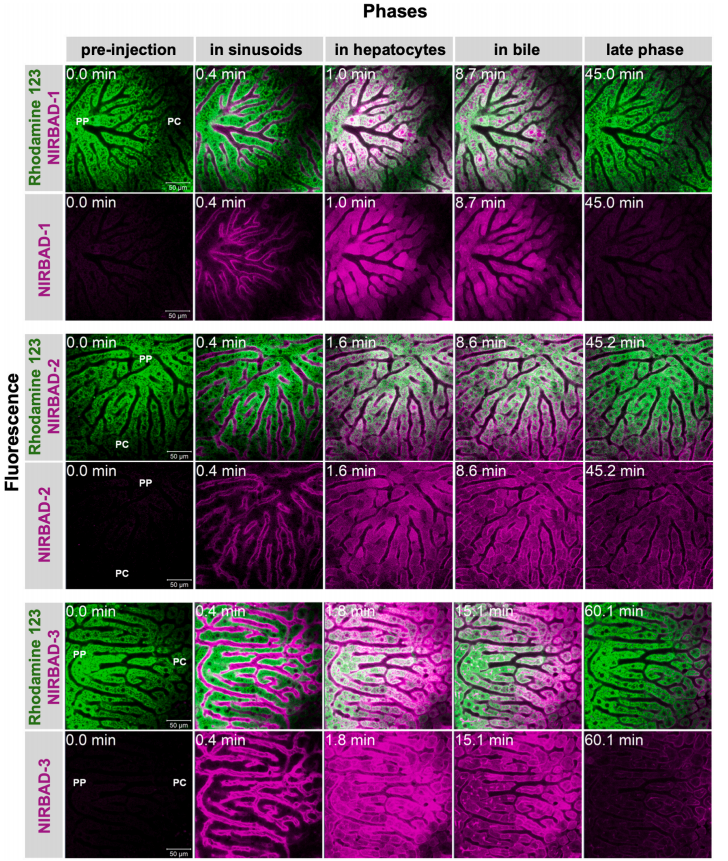
图2:NIRBADs 在小鼠肝实质动态转运的活体显微观察
通过活体共聚焦显微镜(LSM880,激发波长633 nm,发射波长678 nm)实时追踪NIRBADs在小鼠肝内的分布。罗丹明123(绿色荧光)标记线粒体,显示肝小叶分区(门静脉周围PP与中央静脉周围PC)。静脉注射后,NIRBAD-1迅速被肝细胞摄取(1分钟内),并在8.7分钟内分泌至胆小管,45分钟后完全清除(图A)。NIRBAD-2在肝细胞内滞留时间更长,部分通过基底膜外排,中央静脉区荧光持续富集(图B)。NIRBAD-3的排泄速度介于两者之间,45分钟后仍残留于中央静脉区(图C)。这些差异反映了不同NIRBADs与肝细胞转运体(如OATP1B3、NTCP)及外排泵(如BSEP)的亲和力差异,提示其结构修饰对肝胆转运效率的调控作用。
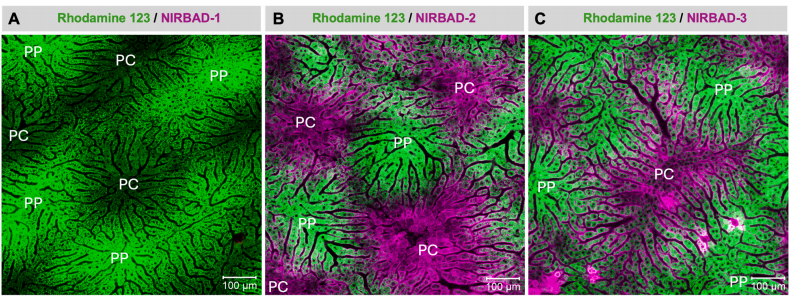
图3:NIRBADs 静脉注射45分钟后肝内荧光残留的空间分布
注射45分钟后,NIRBAD-1的荧光信号完全消失(图A),表明其高效代谢与排泄。NIRBAD-2在中央静脉区(PC)仍显著富集(图B),可能因该区域OATP1B3高表达促进摄取,而外排泵活性较低导致滞留。NIRBAD-3的荧光残留集中于PC区(图C),但强度低于NIRBAD-2,提示其部分通过胆管排泄。这种空间分布差异与肝小叶代谢梯度(如转运体表达差异)相关,进一步验证了NIRBADs作为肝胆功能分区评估工具的可行性。
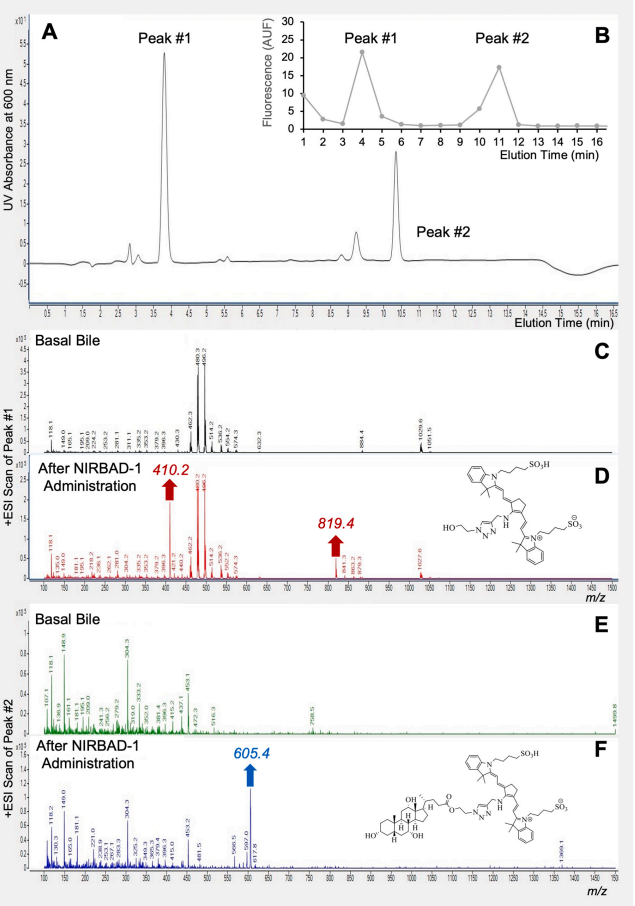
图4:NIRBAD-1 代谢产物的HPLC-MS/MS分析与结构鉴定
通过高效液相色谱(HPLC,Zorbax Eclipse XDB-C18柱)结合质谱(ESI正离子模式)分析大鼠胆汁中的NIRBAD-1代谢产物。色谱分离显示两个主要荧光峰(图A-B):峰#1(m/z 411)为荧光基团与胆酸侧链水解产物(图D),峰#2(m/z 606)为未代谢的NIRBAD-1原型(图F)。质谱碎片分析(MRM模式)确认了代谢路径:酯键水解是主要代谢途径,而部分原型分子通过胆管直接排泄。该结果揭示了NIRBAD-1的肝内代谢动力学,为其快速清除提供了分子机制解释。
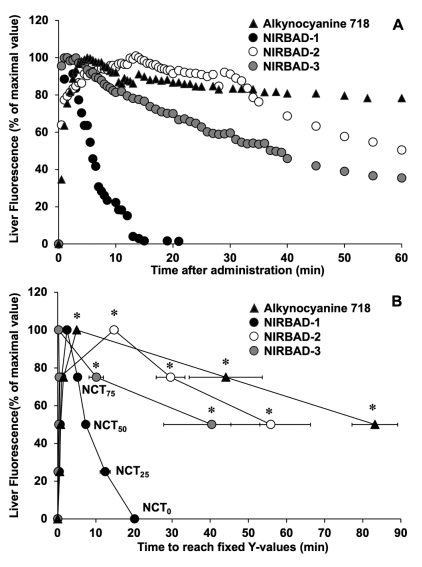
图5:NIRBADs 肝清除时间(NCT)的实时监测与定量分析
通过高灵敏度CCD相机(Luminescent Image Analyzer LAS-4000)实时记录大鼠肝脏荧光强度变化(图A)。NIRBAD-1的荧光峰值在2.4分钟内达到,清除至50%(NCT₅₀)仅需约20分钟,显著快于NIRBAD-2(NCT₅₀≈60分钟)及非靶向荧光基团炔氰胺718(图B)。NCT参数(NCT₇₅、NCT₅₀、NCT₂₅)的量化分析表明,NIRBAD-1的快速清除与其酯键易水解特性相关,而NIRBAD-2的缓慢排泄可能因酰胺键稳定性较高。这一结果为选择NIRBAD-1作为肝胆功能评估的核心探针提供了数据支持。
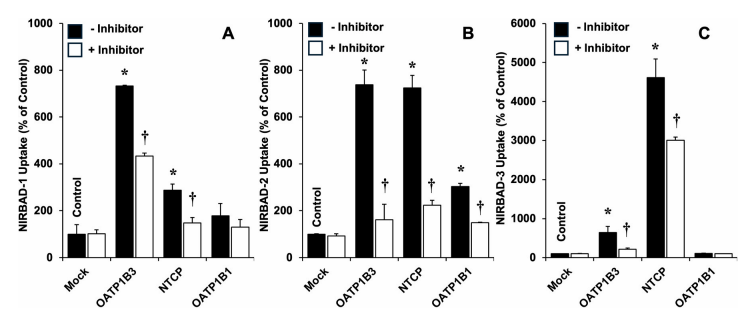
图6:NIRBADs 经胆汁酸转运体(NTCP/OATP1B3)摄取的体外机制研究
通过CHO-K1细胞模型(转染NTCP、OATP1B1或OATP1B3)评估NIRBADs的转运机制。流式细胞术显示,NIRBAD-1和NIRBAD-3主要通过OATP1B3(抑制率>70%,p < 0.05)和NTCP(抑制率>50%)摄取,而NIRBAD-2对OATP1B1的亲和力最低(图A-C)。竞争实验(100 μM TCA或利福平)证实转运特异性。例如,NIRBAD-1的OATP1B3依赖性摄取与其分子中保留的胆酸疏水核心相关,而侧链修饰(如三唑键)可能降低OATP1B1结合效率。这些结果明确了NIRBADs的转运靶点,为其肝胆选择性提供了分子基础。
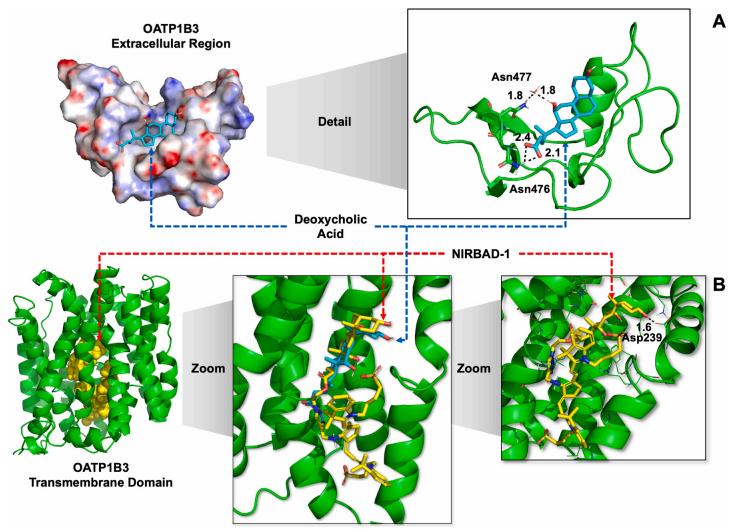
图7:OATP1B3与DCA/NIRBAD-1的分子对接及结合模式预测
通过同源建模(Prime-2.1)和分子对接(GOLD 5.6.3)模拟OATP1B3与底物的相互作用。脱氧胆酸(DCA)通过羟基与胞外区Asn477和Asn476形成氢键(图A),而NIRBAD-1的3α-OH与跨膜区Asp239形成氢键(图B)。分子动力学模拟(Amber18)显示,NIRBAD-1的荧光基团延伸至跨膜通道,而DCA的侧链暴露于胞外。OATP1B3的底物结合口袋(Tyr481、Phe501等疏水残基)与NIRBAD-1的胆酸骨架高度匹配,解释了其高效转运特性。这一发现为优化探针结构以增强转运效率提供了理论依据。
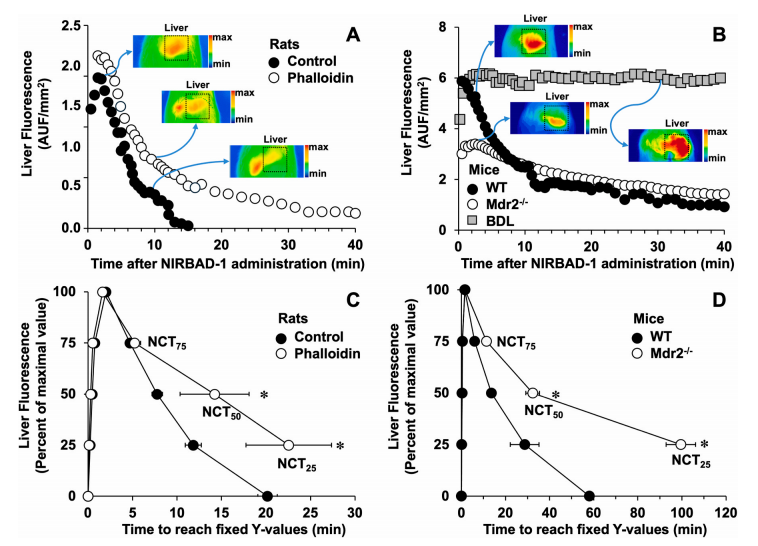
图8:NIRBAD-1 清除时间(NCT)在胆汁分泌障碍模型中的验证
在三种病理模型中验证NCT的临床应用潜力:
1.肝细胞型胆汁淤积(phalloidin处理大鼠):NCT₅₀从对照组的20分钟延长至45分钟(p < 0.05),反映胆汁流量减少50%(图C)。
2.胆管结扎(BDL小鼠):NIRBAD-1在肝脏持续滞留,90分钟内无显著清除(图B),证实胆道完全梗阻。
3.硬化性胆管炎(Mdr2⁻/⁻小鼠):NCT₅₀较野生型延长2倍(p < 0.05),与胆管纤维化导致的分泌功能障碍一致(图D)。
研究证实,NIRBADs通过肝细胞转运蛋白(NTCP、OATP1B3)高效摄取,其中NIRBAD-1具有最快的肝胆清除速率(NCT50=20分钟),且代谢稳定性良好。在胆汁淤积模型中,NIRBAD-1的荧光清除时间显著延长:毒蕈碱处理大鼠的NCT50增加至32分钟,BDL小鼠荧光持续滞留,Mdr2缺陷小鼠清除延迟。分子模拟显示,NIRBAD-1的胆酸骨架与OATP1B3结合模式类似天然胆酸,侧链修饰不影响转运效率。此外,NIRBADs无急性毒性,且与血清标志物变化一致,验证了其作为无创肝功能评估工具的有效性。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:肝损伤和肾衰竭患者注意!利奈唑胺剂量必须调整?最新研究揭示关键机制
下一篇:局部微型机器人递送酶响应的水凝胶固定治疗药物以抑制三阴性乳腺癌