常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-05-22 09:02:16 细胞资源库平台 访问量:295
乙肝病毒(HBV)感染是全球主要公共卫生问题之一,有超过2.5亿人慢性感染HBV。而其中有超三分之一的人口集中在我国,人数接近1亿人。NTCP工具细胞,特别是外源表达NTCP的肝癌细胞系如HepG2-NTCP和Huh7-NTCP,因其易操作、短周期、重现性佳的特点,在乙肝病毒(HBV)研究中扮演着至关重要的角色。这些细胞模型能够有效模拟HBV的感染过程,为研究HBV的生命周期、宿主限制因子、病毒复制以及药物筛选提供了一个强大而便捷的体外平台。它们不仅有助于揭示HBV感染的分子机制,如DDX3作为宿主限制因子阻碍cccDNA转录,GPC5作为附着因子在感染入胞过程中的作用,还能通过直接与NTCP相互作用或下调NTCP表达来筛选和验证抗病毒药物的活性,例如环孢菌素A及其衍生物、雷帕霉素及其衍生物等。此外,这些工具细胞还促进了对HBV宿主特异性分子的发现,为发展支持HBV感染的小动物模型提供了可能,这对于乙肝相关研究和药物开发具有重大意义。
英文标题:Impact of hepatic impairment and renal failure on the pharmacokinetics of linezolid and its metabolites: contribution of hepatic metabolism and renal excretion
中文标题:肝肾功能不全对利奈唑胺及其代谢物药代动力学的影响:肝代谢与肾排泄的贡献
发表期刊:《Antimicrobial Agents and Chemotherapy》
影响因子:4.1
作者单位:
Postgraduate Training Base at Shanghai Pudong New Area Gongli Hospital, Ningxia Medical University, Shanghai, China
Department of Pharmacy, Shanghai Pudong New Area Gongli Hospital, Shanghai, China
Department of Pathology, Shanghai Pudong New Area Gongli Hospital, Shanghai, China
作者信息:
Jinyao Liu, Yingying Pang, Wenyan Li
肝病和肾病是复杂的全球性健康问题,患者因免疫功能受损易发生感染,需频繁使用抗生素。利奈唑胺是一种广谱抗生素,对多重耐药菌有效,但其在肝肾功能不全患者中的药代动力学特征及机制尚不明确。既往研究认为轻中度肝病或任何程度的肾功能不全无需调整剂量,但近期发现肝肾功能损伤可能导致利奈唑胺暴露量增加及血小板减少等不良反应。目前缺乏对利奈唑胺代谢产物(PNU-142586和PNU-142300)的系统研究,且肝肾功能不全对药物代谢酶和转运体的影响尚未阐明。本研究旨在通过四氯化碳(CCl₄)诱导的肝损伤模型和5/6肾切除(5/6 Nx)肾衰竭模型,结合体外肝细胞代谢和转运体实验,明确肝肾功能不全对利奈唑胺及其代谢物药代动力学的影响及机制,为临床剂量调整提供依据。
1. 动物模型:
肝损伤模型:雄性SD大鼠腹腔注射CCl₄(2.5 mL/kg,50%大豆油溶液)。
肾衰竭模型:通过5/6肾切除术建立。
生化指标(ALT、AST、BUN、CREA等)和病理学(H&E染色)验证模型。
2. 药代动力学实验:
利奈唑胺口服(63 mg/kg)或静脉注射(25 mg/kg),采集血浆和尿液样本,HPLC检测药物及代谢物浓度。
3. 组织分布实验:
给药后采集脑、心、肺、肝、肾、小肠等组织,测定药物分布。
4. 体外肝细胞代谢:
分离正常、肝损伤、肾衰竭大鼠原代肝细胞,孵育利奈唑胺,检测代谢产物生成。
5. 转运体研究:
使用转染OATP1B1、OAT1等转运体的HEK293细胞及膜囊泡,评估利奈唑胺的主动转运。
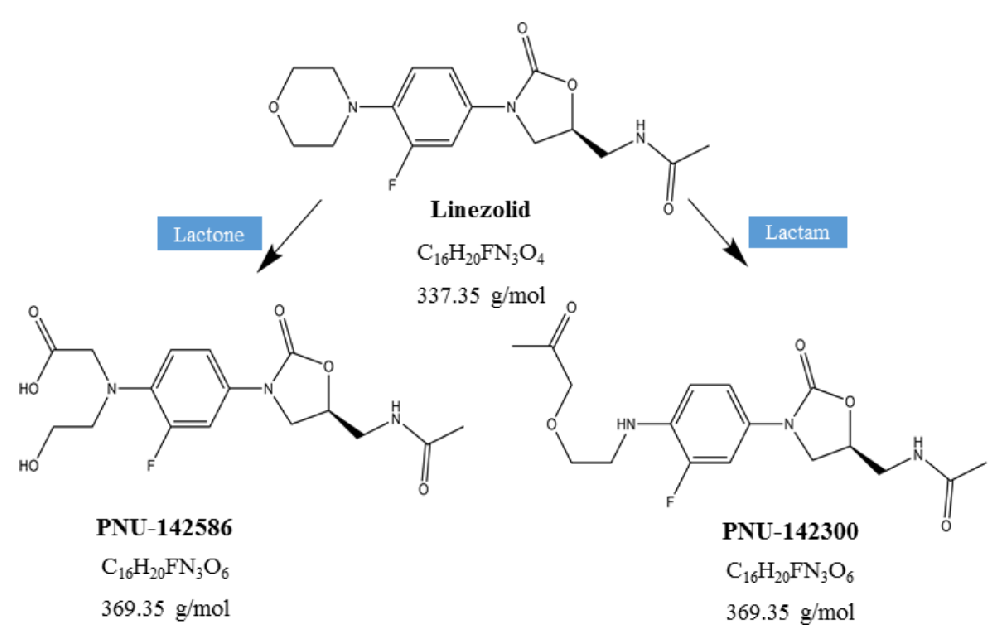
图1:利奈唑胺代谢途径解析与物种差异
利奈唑胺通过非酶氧化反应裂解吗啉环,形成两种无活性的羧酸代谢物。图中明确区分了不同物种的代谢特征:人类以PNU-142586的生成为主,而大鼠则优先生成PNU-142300,提示代谢速率存在种属差异。这一差异为后续大鼠模型中代谢动力学研究提供了理论依据,解释了为何大鼠模型中PNU-142300的暴露量变化更为显著。此外,代谢产物的无活性特性表明其毒性风险可能源于蓄积而非直接作用。
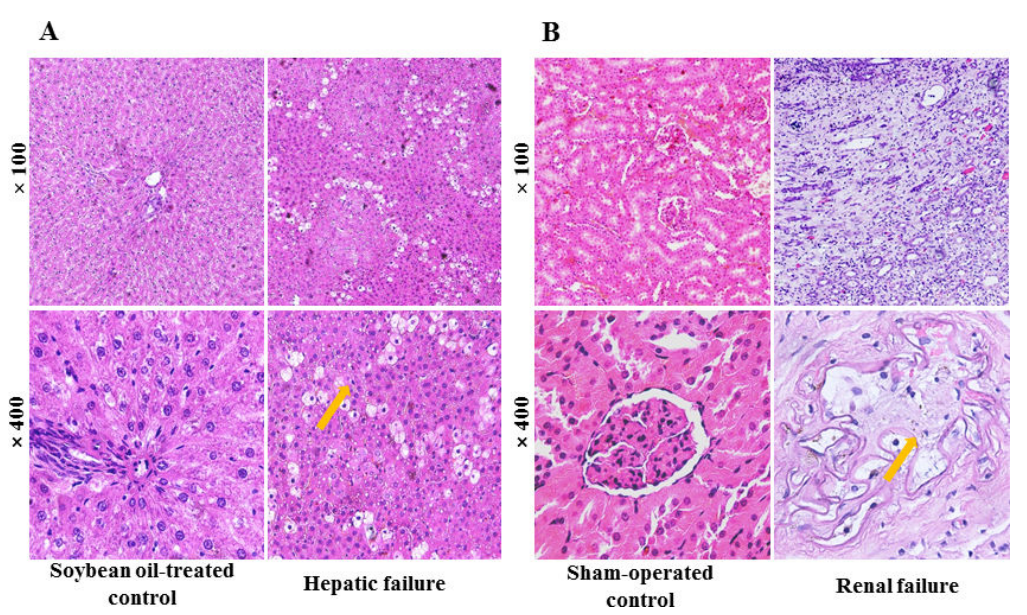
图2:肝肾功能不全模型的病理学验证
通过H&E染色及生化指标检测验证了CCl₄诱导的肝损伤和5/6肾切除肾衰竭模型的有效性。肝损伤组表现为肝细胞坏死、纤维化及炎性细胞浸润,ALT和AST水平较对照组升高6.9倍和10.7倍;肾衰竭组则显示肾小球萎缩、肾小管扩张及间质纤维化,BUN和CREA水平分别升高4.2倍和5.4倍。病理学与生化结果的强一致性证实模型成功模拟了肝肾功能不全的病理状态,为后续药代动力学研究奠定生物学基础。
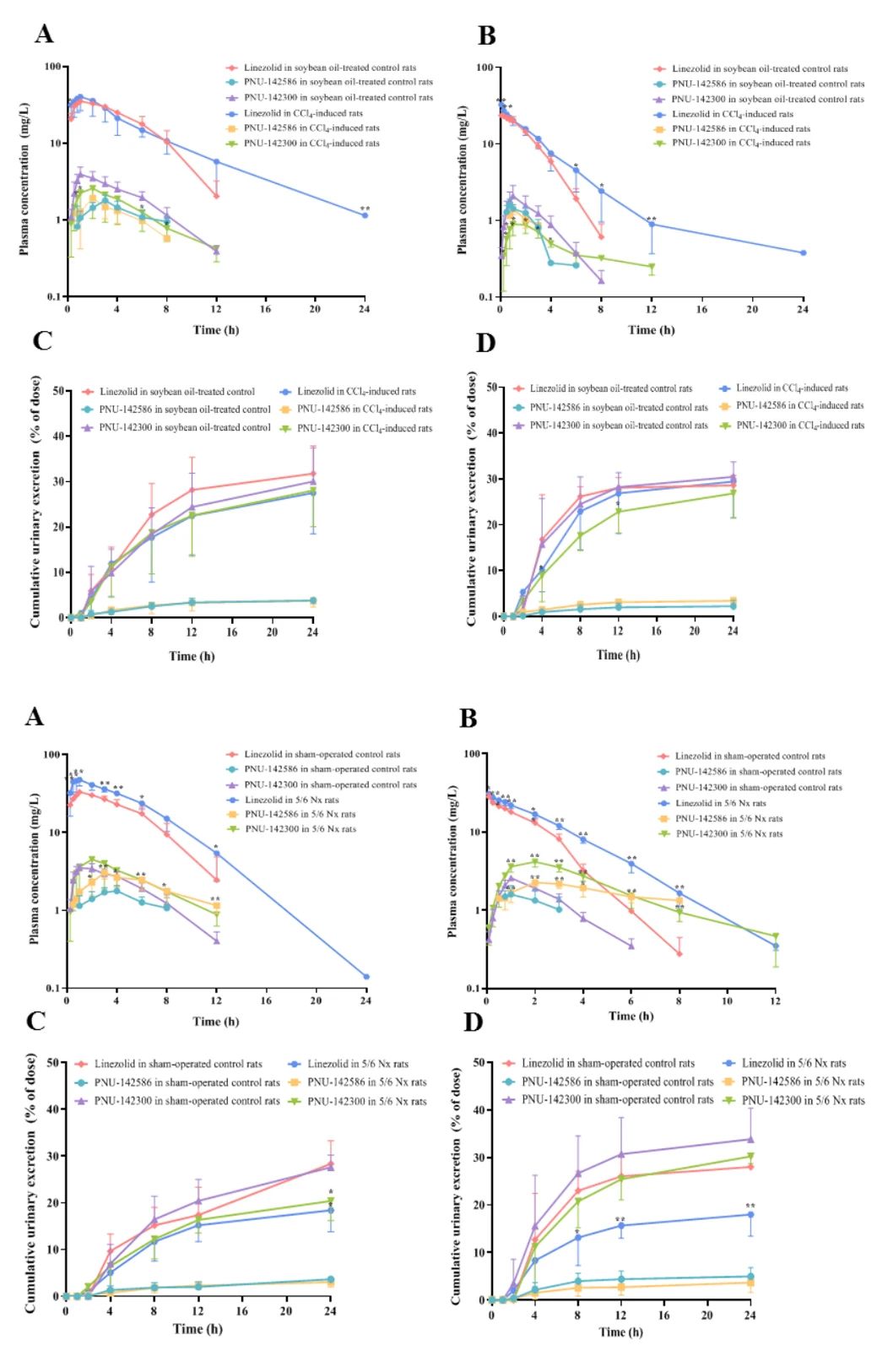
图3:肝肾功能不全对血药动力学的显著影响
口服和静脉给药后,肝损伤组利奈唑胺的AUC分别增加1.22倍和1.39倍,t₁/₂延长近2倍;肾衰竭组的AUC增幅更显著(1.52-1.54倍),且代谢物PNU-142300的AUC升高1.44-2.80倍。肝损伤主要抑制代谢酶活性,导致母药清除率下降;而肾衰竭同时减少代谢和肾排泄,加剧母药及代谢物蓄积。值得注意的是,肾功能不全显著降低PNU-142586和PNU-142300的尿排泄率(33%-57%),提示肾小球滤过是其主要排泄途径。
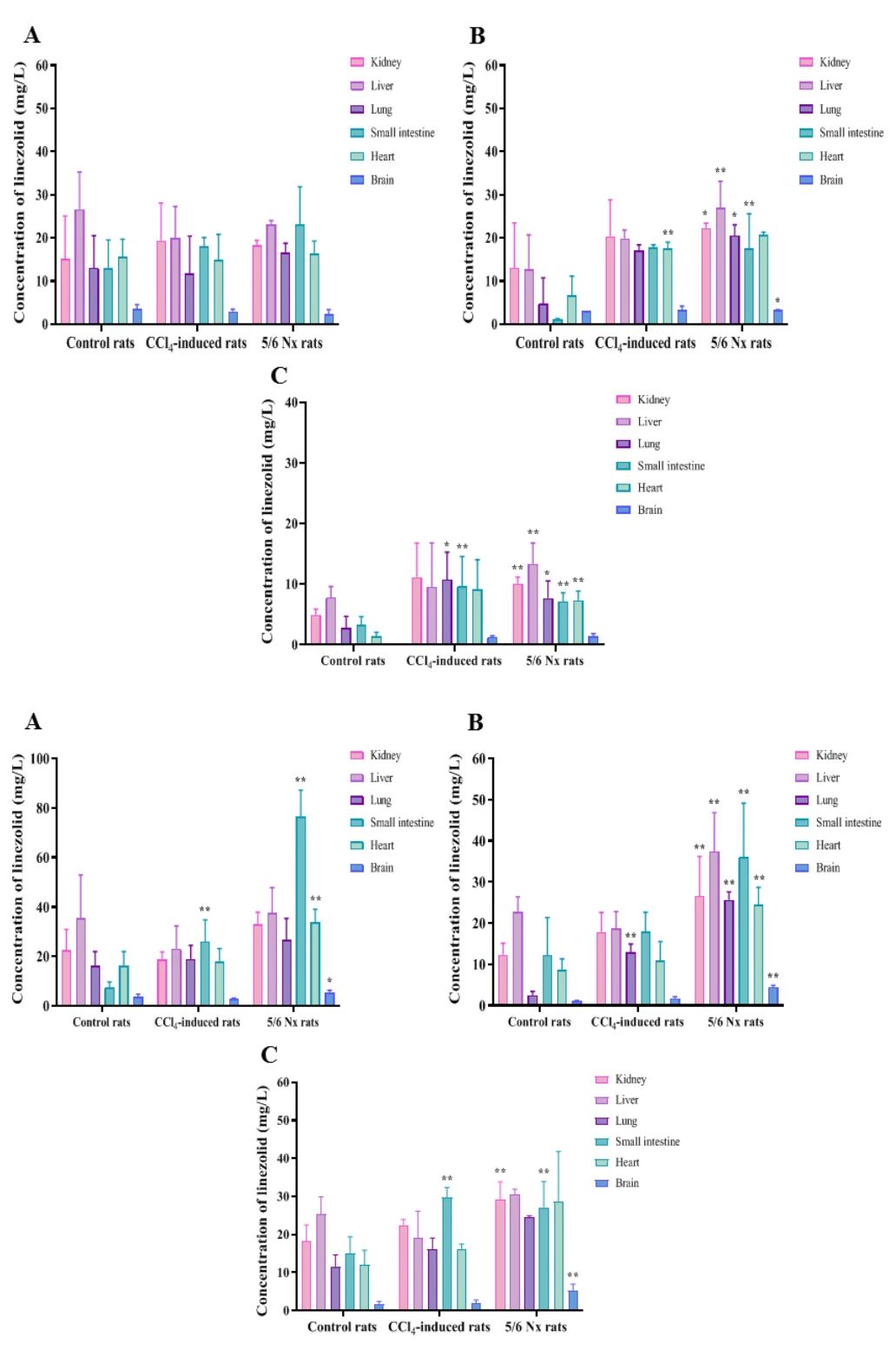
图4:组织分布特征与蓄积风险评估
利奈唑胺在肝、肾中浓度最高(组织/血浆比>1),脑部最低(比值为0.03-0.18)。肝肾功能不全未导致组织蓄积,给药4小时后各组织浓度与对照组无持续差异。但肾衰竭组中PNU-142300的肾浓度显著升高(3.8倍),可能与肾排泄减少有关。代谢物在肝、脑等组织未检出,提示其分布受限于代谢生成速率及组织渗透性,蓄积风险较低。
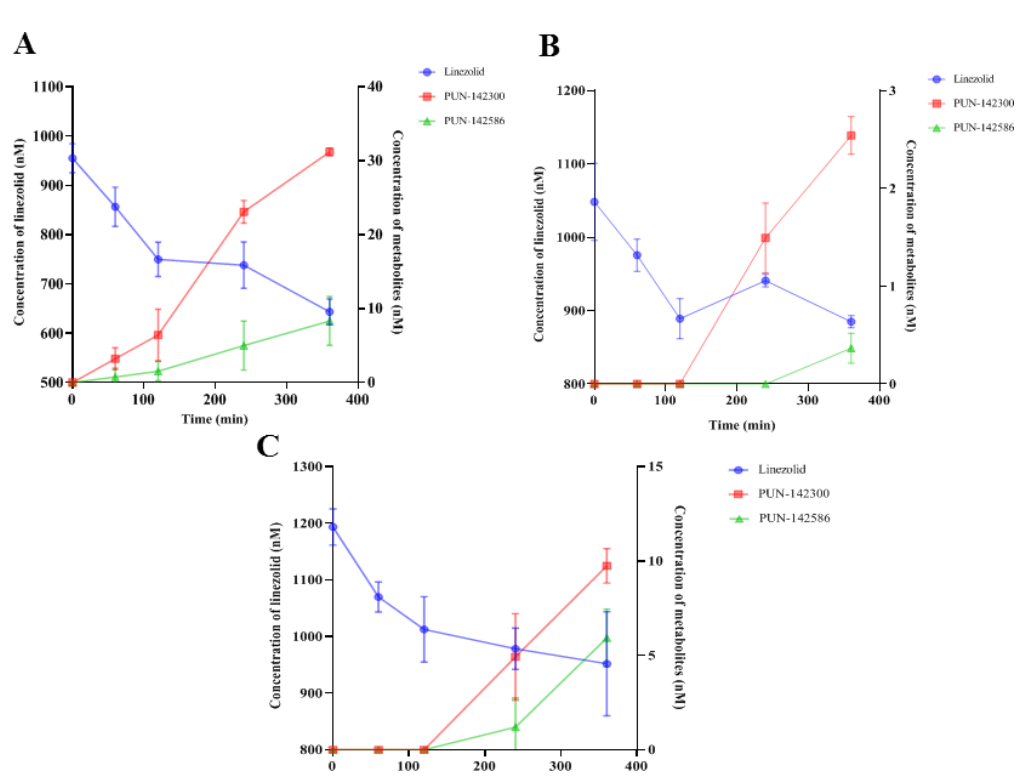
图5:肝细胞代谢功能受损的直接证据
体外实验显示,肝损伤和肾衰竭大鼠的原代肝细胞代谢能力分别下降61.3%和44.1%。正常肝细胞中利奈唑胺的t₁/₂为697分钟,而肝损伤和肾衰竭组延长至1798分钟和1247分钟,代谢产物生成量减少91.9%和68.8%。此结果直接证明肝代谢功能下降是血药浓度升高的核心机制,且肾衰竭通过全身性炎症或尿毒症毒素间接抑制肝酶活性,加剧母药蓄积。
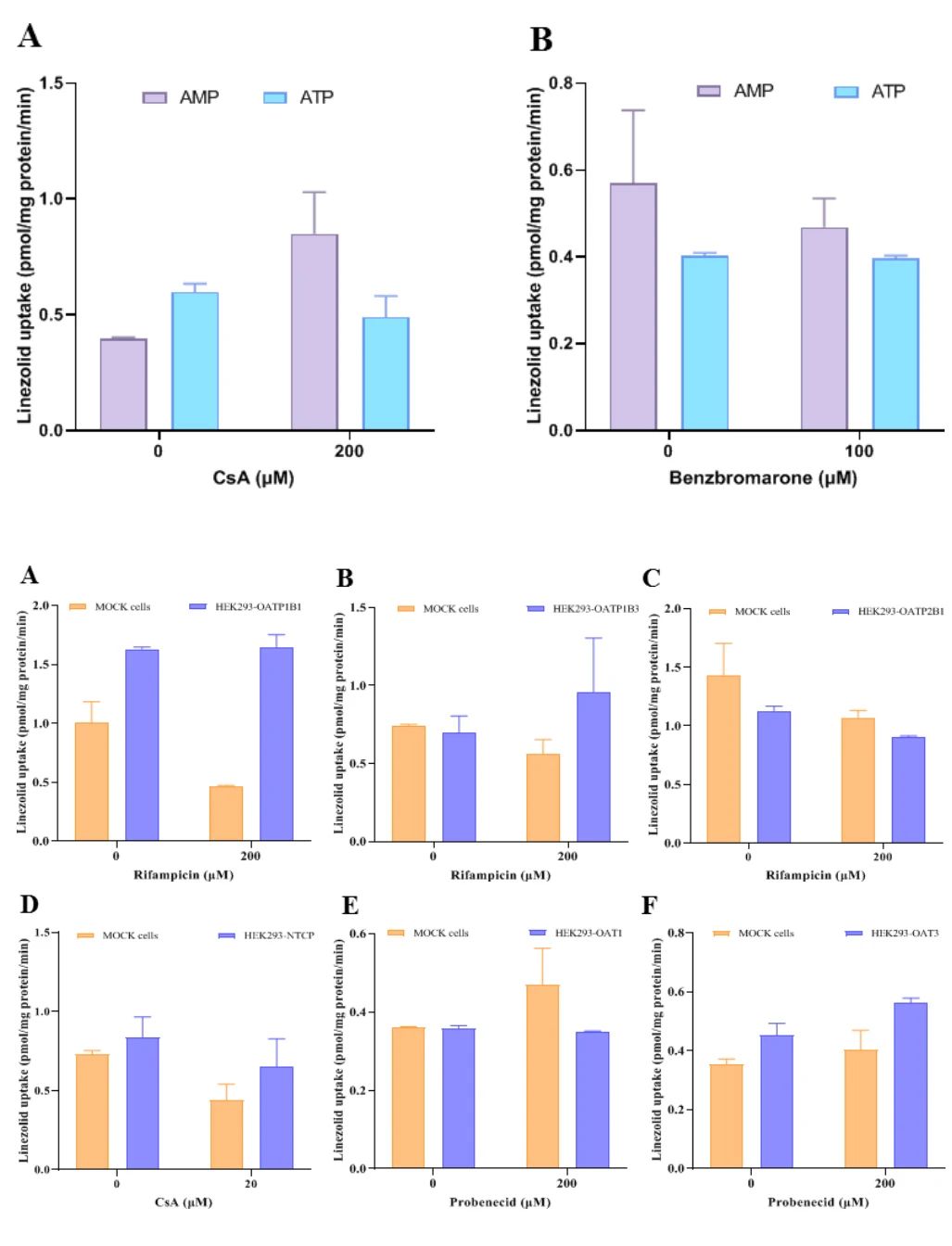
图6:转运体非依赖性排泄机制
利奈唑胺对OATP1B1、OAT1/3等摄取转运体及MDR1、MRP2外排泵均无显著亲和力(转运比<2)。在HEK293过表达细胞和膜囊泡模型中,利奈唑胺的跨膜转运与空白对照组无差异,且抑制剂(如环孢素A)未改变其分布。这表明其吸收和排泄主要依赖被动扩散及肾小球滤过,而非主动转运,解释了肝肾功能不全时转运体相关调控机制的缺失。
肝损伤主要通过降低肝代谢酶活性减少利奈唑胺清除,导致其血药浓度(AUC)增加1.22-1.39倍,半衰期(t₁/₂)延长1.9-2.0倍;肾衰竭则因代谢和肾小球滤过率下降,使利奈唑胺及其代谢物(PNU-142586和PNU-142300)的AUC分别增加1.52-1.54倍和1.44-2.82倍。组织分布显示,利奈唑胺在肝肾中浓度较高,但肝肾功能不全未导致组织蓄积。体外实验证实肝损伤和肾衰竭大鼠肝细胞的代谢能力分别降低61.3%和44.1%,且利奈唑胺并非OATP、OAT等转运体底物。结论认为,肝肾功能不全患者需调整利奈唑胺剂量以避免毒性。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:改造T细胞变身“记忆战士”:新型病毒载体让免疫疗法长效狙击肿瘤!
下一篇:近红外荧光探针NIRBADs实现实时动态追踪,告别传统血清指标局限!