常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-04-25 09:00:00 细胞资源库平台 访问量:203
在生物医学研究和药物开发领域,生物发光成像技术因其高信噪比而被广泛应用于细胞测定和动物成像研究。然而,传统的荧光素酶种类有限,限制了同时成像多个分子和细胞事件的能力。为了突破这一限制,科学家们开发了一种新型的ATP非依赖性荧光素酶——NanoLuc(NL),它源自深海虾Oplophorus gracilirostris,并经过工程改造以增强蛋白质稳定性。NanoLuc作为一种小型(19 kDa)、高亮度的荧光素酶,其亮度是传统萤火虫或海肾荧光素酶的100倍,并且使用furimazine作为底物产生明亮的辉光型发光。
NanoLuc的意义在于其为双报告基因生物发光分子成像提供了新的可能。它不仅可以在活体小鼠的表层和深层组织中成像,而且其生物发光随时间的变化可以用来定量肿瘤生长,甚至在少量血清中也能检测到分泌的NL。此外,NanoLuc与萤火虫荧光素酶的结合使用,为在完整细胞和活体小鼠中定量TGF-β信号传导的两个关键步骤提供了一种新型双荧光素酶成像策略,从而在正常生理、疾病和药物开发中扩展了信号转导的成像能力。NanoLuc的作用不仅体现在其高灵敏度和高稳定性上,它还具有更小的尺寸,这使得在标记细胞和蛋白质时对样本的侵入性更小,有助于保持细胞或组织的天然状态。NanoLuc的快速反应、低背景发光和多样灵活等特点,使其在生物学和医学研究中具有广泛的应用前景。因此,NanoLuc作为一种新的报告基因,不仅增强了我们对生物过程的理解和疾病机理的研究,而且在开发潜在治疗方法和疗法方面发挥了重要作用。
英文标题:NanoLuc Complementation Reporter Optimized for Accurate Measurement of Protein Interactions in Cells
中文标题:用于精确测量细胞内蛋白质相互作用的NanoLuc互补报告系统的优化
发表期刊:《ACS Chemical Biology》
影响因子:3.5
作者单位:
1.Promega Corporation, Madison, Wisconsin 53711, United States
2.Promega Biosciences Incorporated, San Luis Obispo, California 93401, United States
作者信息:Andrew S. Dixon, Marie K. Schwinn, Mary P. Hall
蛋白质相互作用是细胞生理动态的核心,但传统的分裂报告系统(如荧光蛋白或β-半乳糖苷酶)存在结构完整性差、亲和力干扰、动态响应不足等问题。本研究基于深海虾来源的NanoLuc荧光素酶,开发了新型互补报告系统NanoBiT。其设计目标是:通过小尺寸和高亮度降低空间位阻,优化片段稳定性与低内在亲和力,从而准确反映细胞内蛋白质相互作用的动态特性。
本研究通过以下步骤开发并验证NanoBiT系统:首先,利用环状置换和TEV蛋白酶切割筛选NanoLuc(Nluc)的拆分位点,确定156-157残基为最佳分割点,产生18 kDa大片段(11S)和1.3 kDa小肽(114)。随后,通过随机突变和定向筛选优化11S的稳定性(如热稳定性提高至54°C),并设计低亲和力肽114(KD=190 μM)以最小化对靶蛋白相互作用的影响。通过β-内酰胺酶抑制模型(SME1与BLIP结合)验证NanoBiT的准确性,测量KD、kon和koff等参数。在细胞实验中,构建FRB/FKBP、β-arrestin-2/GPCR及BRAF/CRAF等融合蛋白,利用雷帕霉素、GPCR激动剂或激酶抑制剂诱导互作,通过实时发光监测动态过程,并在不同温度(21–37°C)下评估响应速度和信号稳定性。
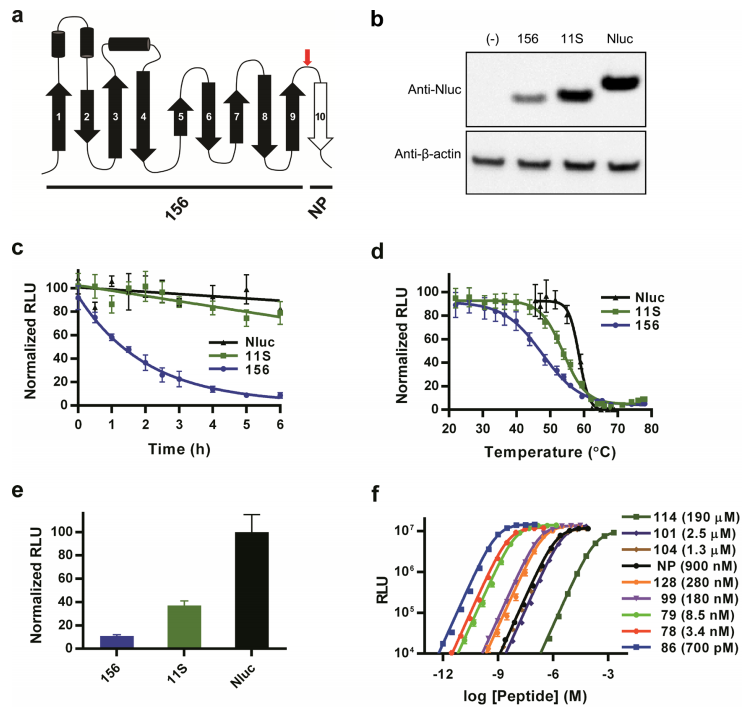
图1:NanoBiT的工程设计与性能优化
通过环状置换和蛋白酶筛选确定NanoLuc的拆分位点(残基156-157),发现原始大片段(156)稳定性差(Tm=48°C,半衰期<2小时)。经两轮随机突变筛选获得优化的大片段11S(Tm=54°C,半衰期>6小时),其表达量和发光强度较原始片段提升300倍。小肽114通过保守替换文库筛选获得,与11S的亲和力降低至190 μM(原始NP为6 μM),且发光光谱与完整NanoLuc一致(λmax=460 nm),确保检测特异性。
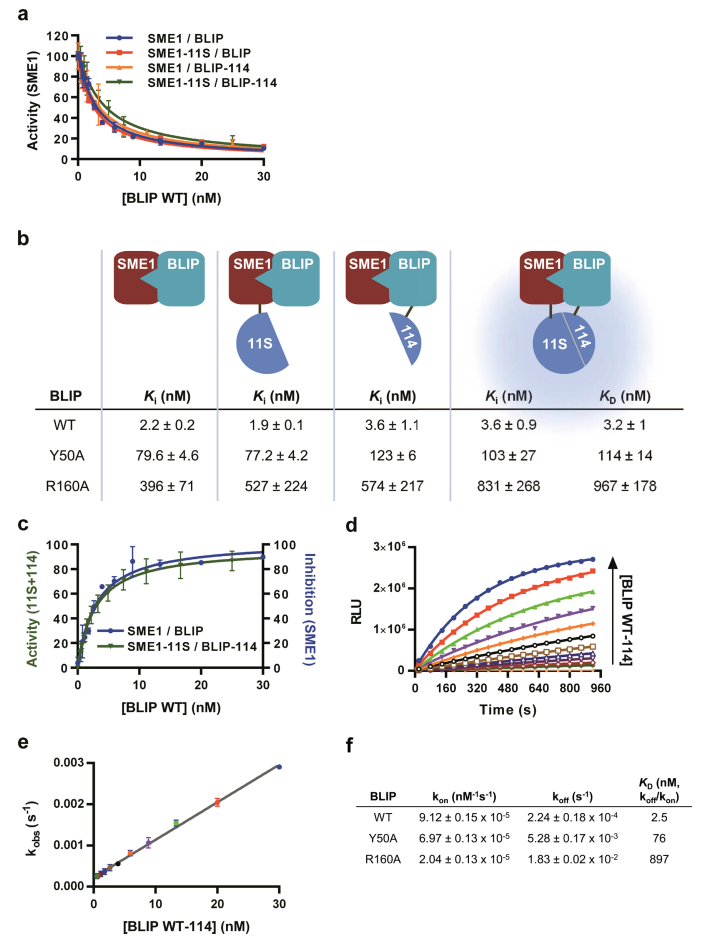
图2:NanoBiT在β-内酰胺酶抑制模型中的定量验证
利用SME1(β-内酰胺酶)与BLIP(抑制剂)的互作模型,验证NanoBiT的准确性。BLIP突变体(WT、Y50A、R160A)的NanoBiT发光信号与β-内酰胺酶活性抑制结果高度一致(KD误差<2倍),且实时动力学分析显示kon和koff与理论值匹配(如BLIP R160A的kon=5.5×10^4 M⁻¹s⁻¹,koff=0.18 s⁻¹)。结果表明NanoBiT可精确反映靶蛋白的亲和力与动力学参数。
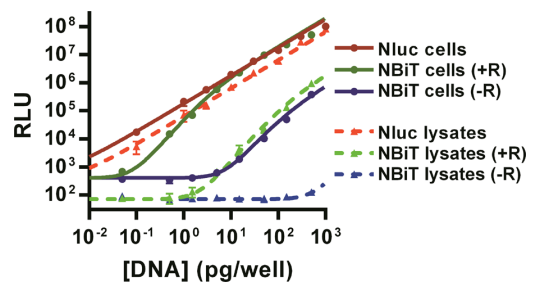
图3:NanoBiT在细胞内的线性响应与动态范围
通过FRB/FKBP模型验证NanoBiT在活细胞中的线性响应。低表达量时,发光信号符合二级动力学模型(依赖FRB/FKBP浓度),而高表达时转为线性(类似完整NanoLuc)。雷帕霉素诱导的信号/背景比达1,200:1(Z’=0.98),且细胞裂解液中的背景信号降低10倍,证实其在低浓度下的高灵敏检测能力。
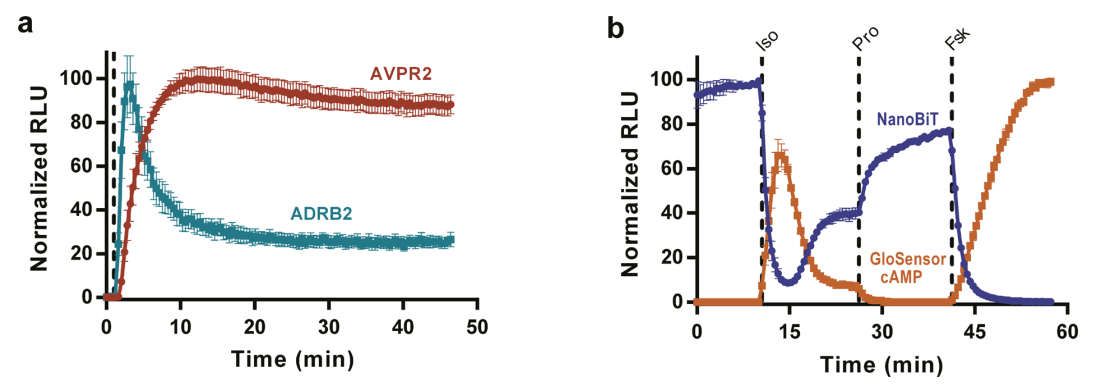
图4:β-arrestin-2与GPCR的瞬时互作动态
ADRB2(β2-肾上腺素受体)与AVPR2(加压素受体)分别融合NanoBiT,显示β-arrestin-2的互作动力学差异:ADRB2信号在激动剂(异丙肾上腺素)刺激后迅速上升并快速衰减(t1/2≈5分钟),而AVPR2信号持续稳定(t1/2>30分钟),符合两类受体的内吞和再循环特性。活细胞成像进一步证实信号的空间分布与内体转运相关。
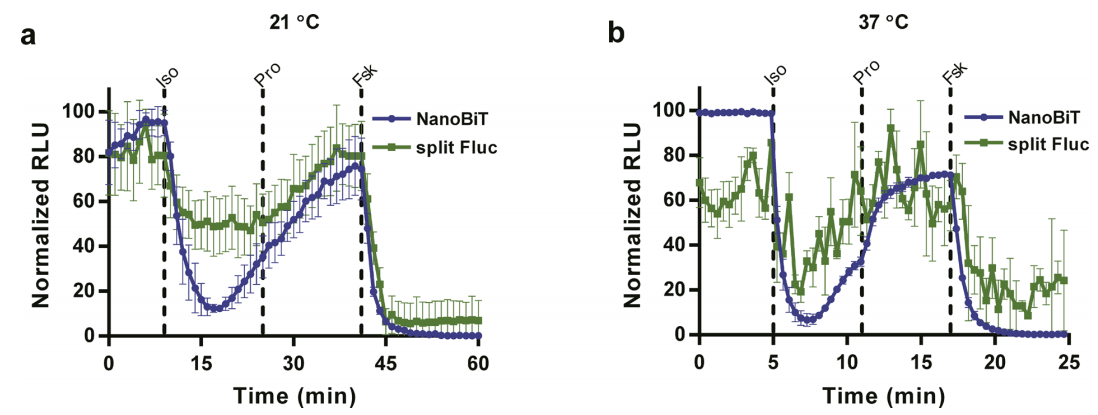
图5:温度对蛋白激酶A(PKA)互作动力学的影响
在37°C下,PKA催化亚基(PRKACA)与调节亚基(PRKAR2A)的NanoBiT信号响应速度较21°C快3倍(kon=0.12 s⁻¹ vs. 0.04 s⁻¹),且与cAMP生物传感器的动态变化同步。对比传统分裂荧光素酶(Fluc)在高温下的信号衰减,NanoBiT在37°C仍保持稳定,凸显其生理温度适用性。
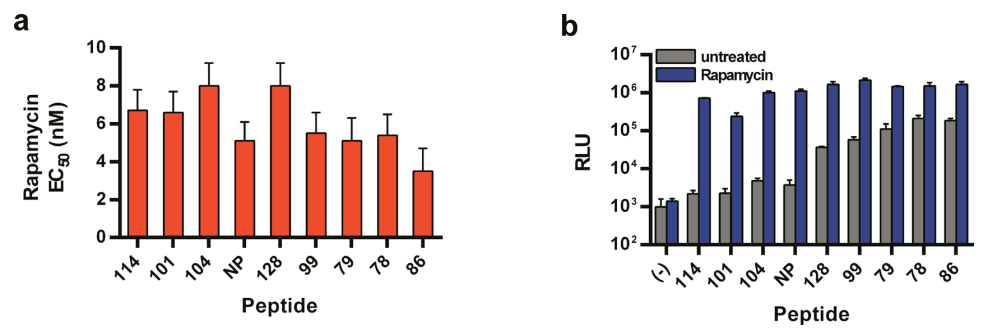
图6:NanoBiT在药物诱导互作中的灵敏度与特异性
FRB/FKBP模型中,不同亲和力肽(114、NP)的雷帕霉素EC50值一致(~1 nM),但高亲和力肽(NP)背景信号显著升高(S/B=10 vs. 1,200),表明低亲和力114可最大化检测窗口。进一步证明NanoBiT的灵敏度与靶蛋白互作特性无关,仅依赖报告系统本身设计。
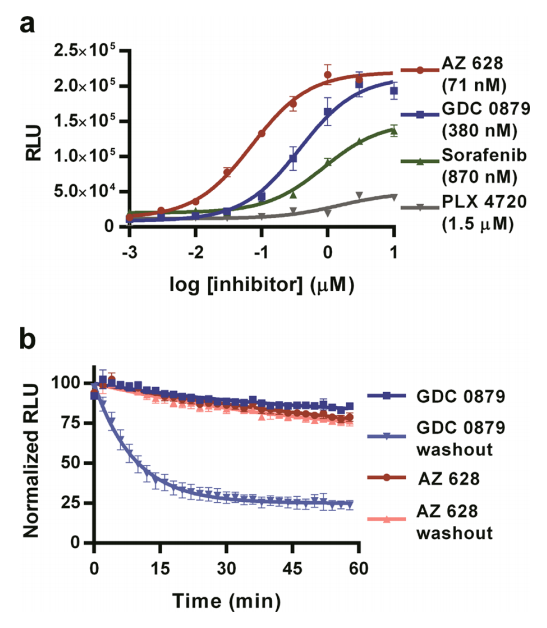
图7:BRAF/CRAF互作的药物动力学分析
BRAF激酶抑制剂(GDC 0879、AZ 628)诱导的BRAF/CRAF二聚化通过NanoBiT实时监测:可逆抑制剂GDC 0879(EC50=32 nM)在撤药后信号迅速下降(t1/2≈15分钟),而不可逆抑制剂AZ 628(EC50=41 nM)信号维持稳定,与Western blot结果(MEK/ERK磷酸化水平)一致,证实NanoBiT在药物作用机制研究中的实用性。
NanoBiT通过优化大片段(11S)的稳定性和小肽(114)的低亲和力,成功实现了对细胞内蛋白质相互作用的高精度动态监测。其关键优势包括:
1. 灵敏度高(检测限达μM级KD),
2. 对靶蛋白亲和力和动力学干扰小(KD<10 μM时无显著影响),
3. 适用于生理温度(37°C)和快速动态过程(如cAMP信号传导)。在药物筛选中,NanoBiT可区分可逆与不可逆抑制剂(如BRAF/CRAF互作),并实时反映雷帕霉素诱导的FRB/FKBP互作动态。该系统克服了传统分裂报告系统(如荧光蛋白、β-半乳糖苷酶)的结构不稳定性和高背景干扰,为研究蛋白质网络动态及药物开发提供了可靠工具。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:乙肝治疗新突破!多价mRNA疫苗成功打破免疫耐受,迈向功能性治愈
下一篇:胶质瘤模型新突破:荧光素酶标记小鼠破解免疫排斥难题,AI技术精准量化肿瘤生长