常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-04-15 09:19:37 细胞资源库平台 访问量:340
荧光素酶报告基因系统是一种基于荧光素酶催化底物氧化反应产生生物发光的检测技术,广泛应用于细胞生物学研究。其中,萤火虫荧光素酶(firefly
luciferase,
Fluc)因其高灵敏度、宽线性检测范围(约7~8个数量级)以及较短的半衰期(在哺乳动物细胞中约为3小时,在植物细胞中约为3.5小时)而成为最常用的报告基因。其发光信号强度在酶浓度为10⁻¹⁶
mol/L至10⁻⁸ mol/L的范围内与酶活性呈线性关系,并且在理想条件下可检测到低至10⁻²⁰
mol/L的荧光素酶活性。此外,荧光素酶报告基因系统具有非放射性、检测快速、灵敏度高(比氯霉素乙酰转移酶CAT高100倍)等优点,特别适用于高通量筛选和活细胞检测。通过将荧光素酶报告基因载体转染至宿主细胞后,可利用荧光素酶检测系统灵敏且便捷地监测基因表达水平,已成为细胞生物学研究中的重要工具。
英文标题:PET imaging of AAV9 and AAVBR1 trafficking in normal mice
中文标题:正常小鼠中AAV9与AAVBR1的PET成像追踪
发表期刊:《Scientific Reports》
影响因子:3.8
作者单位:
Division of Nuclear Medicine, Department of Radiology, Mayo Clinic, Rochester, MN 55905, USA
Mayo Clinic Comprehensive Cancer Center, Rochester, MN 55905, USA
Department of Pharmacology, Mayo Clinic, Rochester, MN 55905, USA
作者信息:
Aditya Bansal, Shalini Sharma, Manasa Kethamreddy
腺相关病毒(AAV)是基因治疗的重要载体,但其在体内的靶向性、分布和清除机制仍需深入研究。传统方法如荧光原位杂交(FISH)依赖组织活检,难以实现纵向监测。非侵入性成像技术如PET可提供动态追踪能力,但目前放射性标记方法存在局限性(如半衰期短或图像分辨率低)。本研究开发了一种新型放射性标记方法,利用锆-89(⁸⁹Zr)标记两种AAV血清型(AAV9和脑靶向变体AAVBR1),通过PET成像评估其在正常小鼠体内的分布、运输和清除特性,旨在为基因治疗的精准应用提供工具。
放射性标记:使用⁸⁹Zr与螯合剂DFO-Bn-NCS(DBN)合成放射性前体[⁸⁹Zr]Zr-DBN,并通过异硫氰酸基团与AAV衣壳蛋白的氨基共价结合。
体外验证:通过SDS-PAGE和放射自显影验证标记效率,定量病毒颗粒数与放射性活度的关系。
动物模型:BALB/c小鼠尾静脉注射标记后的AAV9和AAVBR1。
PET成像:在注射后多个时间点(5分钟至18天)进行动态和静态扫描,分析器官标准化摄取值(SUV)。
体外验证:第18天处死小鼠,取器官进行放射性分布和荧光素酶表达检测,验证PET数据与基因转导相关性。
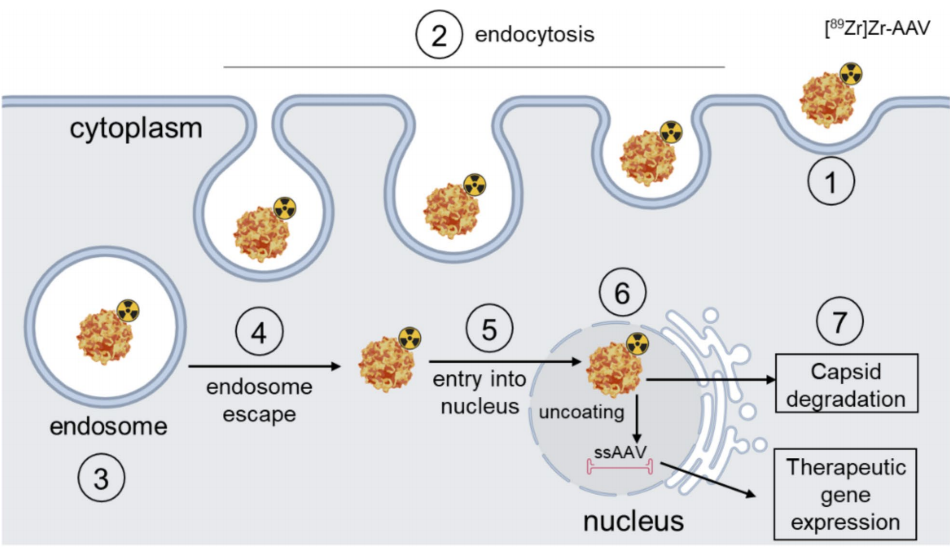
图1:AAV衣壳介导的细胞内运输过程
展示AAV通过细胞表面受体结合、内吞进入细胞,并运输至细胞核的过程。
衣壳蛋白(VP1/VP2/VP3)在核内解离,释放单链DNA基因组,形成游离型附加体。
强调衣壳结构对组织趋向性的调控作用,为后续血清型差异提供机制基础。
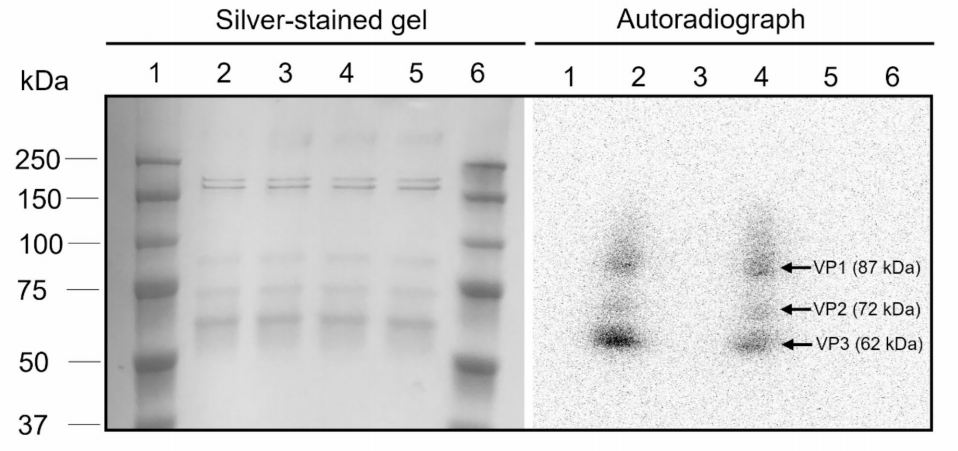
图2:AAV衣壳蛋白的放射性标记验证
SDS-PAGE显示AAV9和AAVBR1的衣壳蛋白条带(VP1: 87 kDa, VP2: 72 kDa, VP3: 62 kDa)。
放射自显影证实⁸⁹Zr-DBN成功标记衣壳蛋白,放射性分布比例为VP1:VP2:VP3≈3:2:4(AAV9)和3.5:2.9:3.6(AAVBR1),表明VP1/VP2的赖氨酸残基更易被标记。
银染与放射信号重叠,排除非特异性结合。
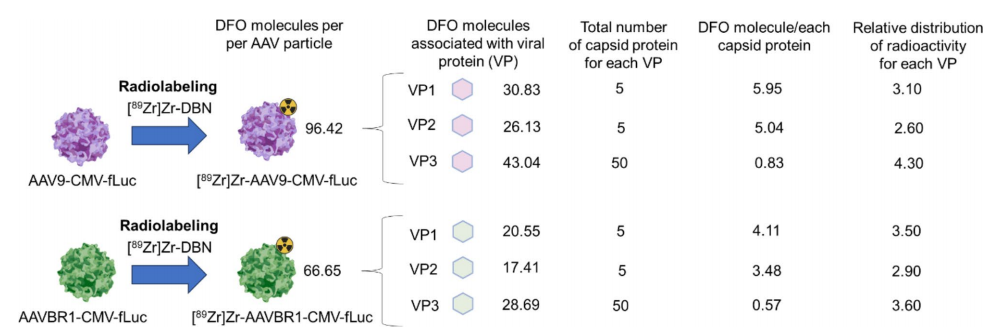
图3:⁸⁹Zr-DBN标记AAV衣壳蛋白的定量分析
柱状图量化VP1/VP2/VP3的放射性占比,显示AAV9中VP1(31%)、VP2(26%)、VP3(43%),AAVBR1中VP1(35%)、VP2(29%)、VP3(36%)。
计算每个病毒颗粒平均标记约96个DFO分子(AAV9)和66个(AAVBR1),验证标记效率与病毒功能保留的平衡。
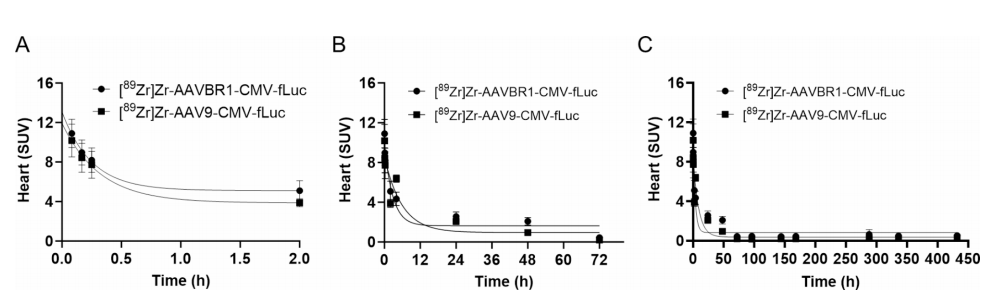
图4:AAV在血液中的双相清除动力学
显示⁸⁹Zr-AAV的血液SUV值在注射后30分钟内快速下降(快速清除相),随后缓慢清除至24小时(慢速清除相)。
AAV9和AAVBR1清除速率无显著差异,但AAVBR1在后期(>24小时)血液残留略高,可能与器官滞留相关。
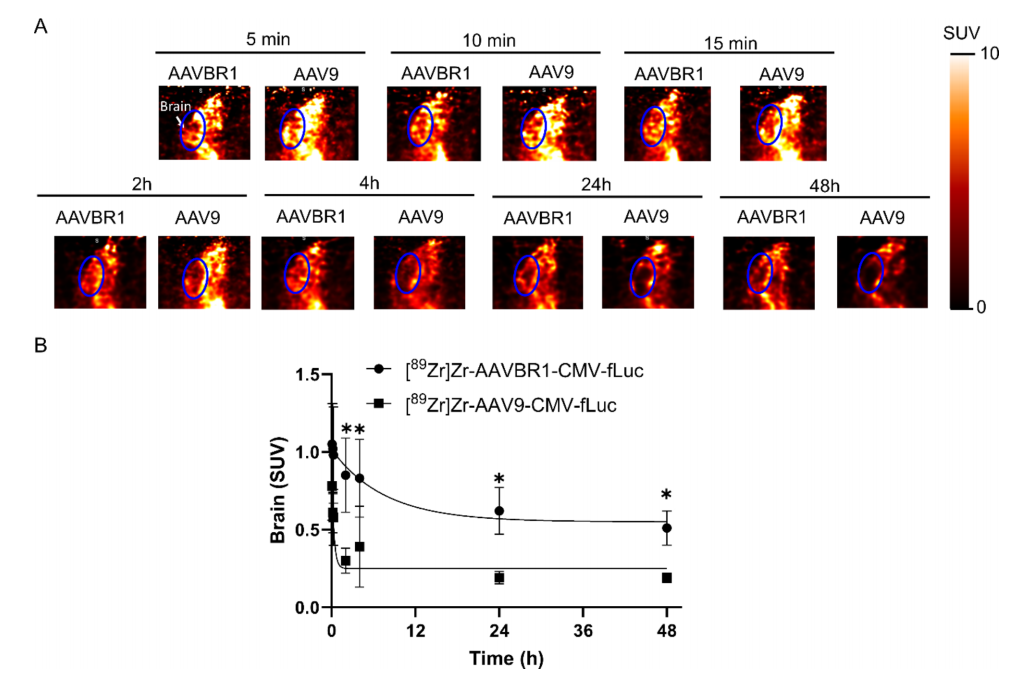
图5:AAVBR1的脑靶向性显著优于AAV9
PET图像叠加X射线骨架,显示AAVBR1在脑部(箭头)的放射性富集。
时间-活性曲线表明,AAVBR1在10分钟时脑SUV已达1.02,而AAV9仅0.61(p<0.05),差异持续至48小时。
体外验证(第18天)显示AAVBR1脑部放射性残留为AAV9的1.7倍。
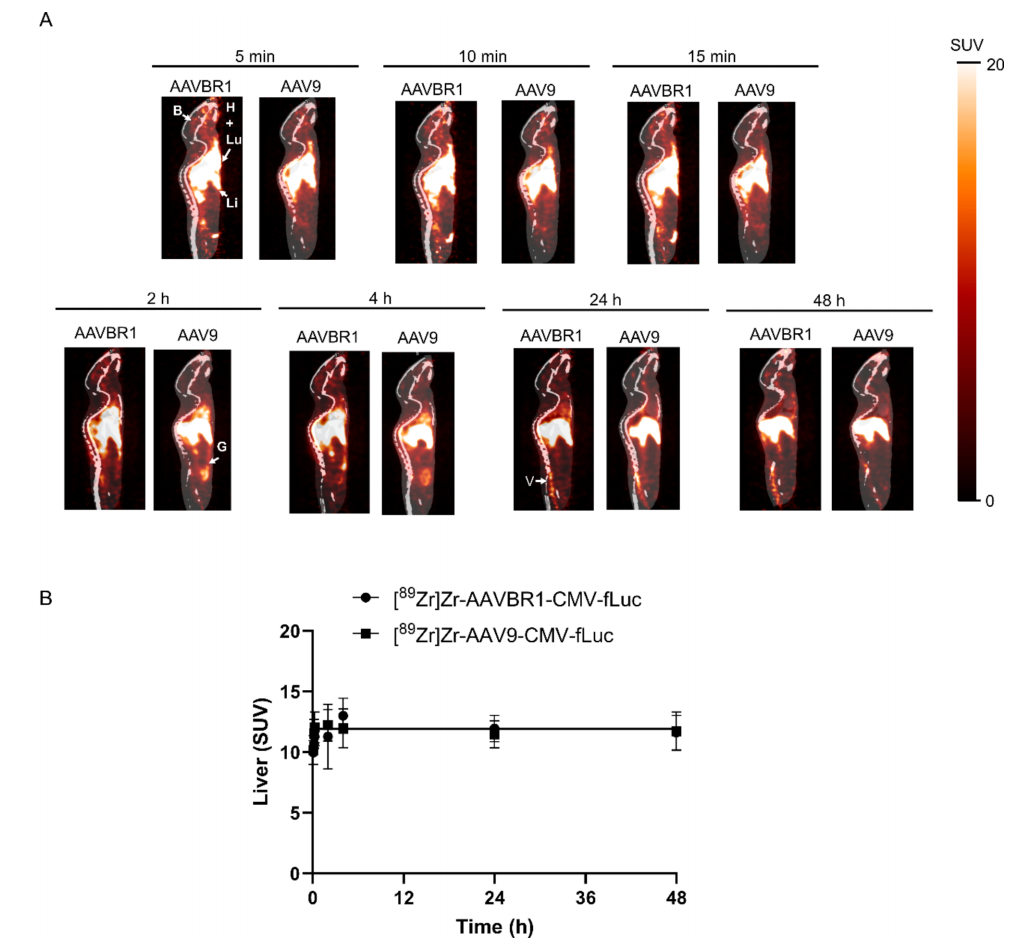
图6:AAV9与AAVBR1的器官分布异质性
AAV9在注射后2小时肠道SUV显著高于AAVBR1(3.14 vs. 1.64),可能与肝肠循环相关。
AAVBR1在肌肉的早期摄取更高(0.55 vs. 0.34),但荧光素酶表达显示AAV9的肌肉转导效率更优,提示摄取与功能不完全一致。
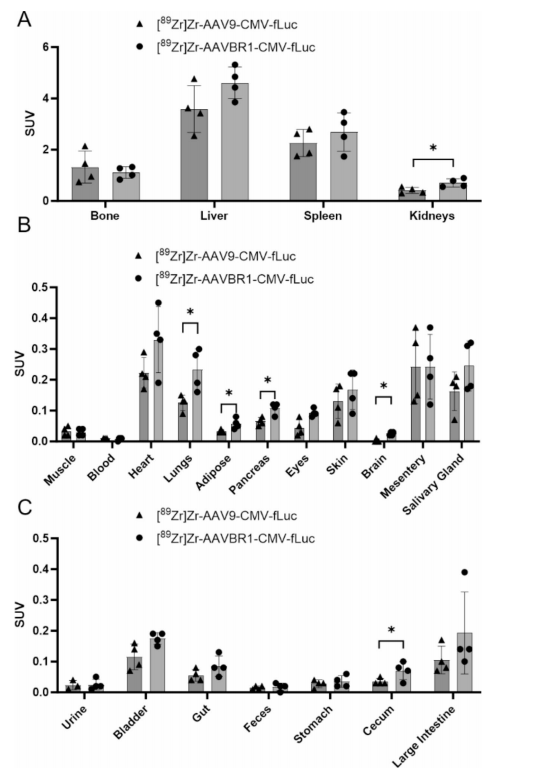
图7:第18天器官放射性分布验证
柱状图显示肝脏、脾脏和肾脏是主要滞留器官,AAVBR1在脑、肺和肾脏的SUV显著高于AAV9。
性别差异分析:雄性小鼠中AAVBR1在胰腺和皮肤的摄取更高,雌性小鼠中肾脏摄取更高(p<0.05)。
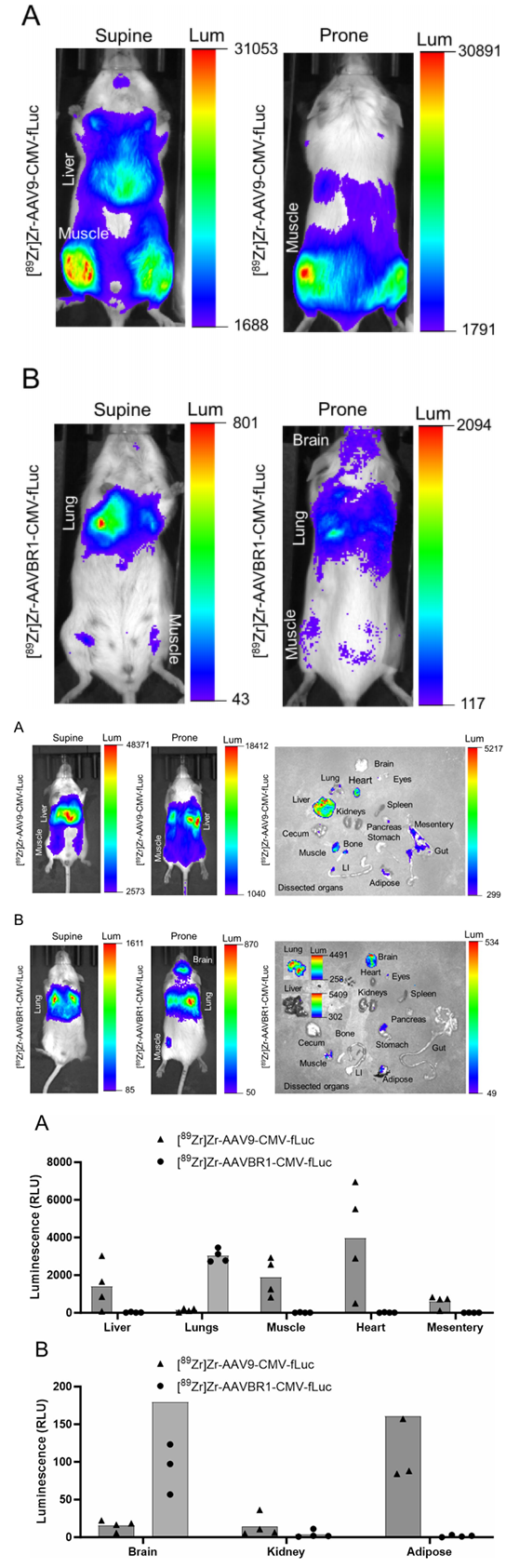
图8:AAV介导的荧光素酶器官特异性表达
活体荧光成像显示AAVBR1在脑和肺的荧光信号强于AAV9,而AAV9在肝脏和肌肉信号更高。
离体器官荧光定量验证PET数据,证明放射性标记未影响病毒转导功能,且器官分布与基因表达一致。
标记方法有效性:[⁸⁹Zr]Zr-DBN成功标记AAV,标记效率(>95%)高于既往¹²⁴I和⁶⁴Cu方法,且不影响病毒结构。
血清型差异:脑靶向AAVBR1在注射后10分钟即显示显著高于AAV9的脑部摄取(SUV 1.02 vs. 0.61),差异持续至18天。
纵向追踪能力:⁸⁹Zr的半衰期(78.4小时)支持长达18天的连续成像,揭示AAV的器官特异性分布(如肝脏、肺、骨骼)和动态清除规律。
功能验证:荧光素酶表达与PET数据一致,表明放射性标记不影响病毒转导能力。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:关于原发性开角型青光眼和系统性红斑狼疮之间免疫病理机制和关键生物标志物的新见解