常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-04-16 09:00:00 细胞资源库平台 访问量:370
同源异体小鼠肿瘤模型是免疫肿瘤学(I/O)研究中不可或缺的临床前模型,但它们对免疫检查点抑制剂(ICIs)的反应有限,这可能是由于它们的固有低免疫原性。为了解决这一问题,研究人员通过将鸡卵清蛋白(OVA)这一高度免疫原性的蛋白质表达到同源异体肿瘤细胞中,开发了新的免疫原性同源异体模型。这些模型,如DC2.4-OVA和B16-OVA,显示出比它们的亲本细胞系更慢的肿瘤生长速度,这可能是由于免疫介导的排斥反应。更重要的是,这些OVA表达的模型对ICIs,特别是抗PD-1治疗,表现出更高的敏感性,这表明它们在增强T细胞介导的免疫反应方面具有潜力。此外,通过过继T细胞转移实验,研究人员验证了这些模型中存在肿瘤特异性记忆T细胞。这些结果表明,OVA工具细胞不仅增强了对ICIs的反应,而且为临床前免疫治疗评估提供了新的、具有更高免疫原性的同源异体模型,这对于I/O研究具有重要的意义。
英文标题:Engineering Polymeric Prodrug Nanoplatform for Vaccination Immunotherapy of Cancer
中文标题:工程化聚合物前药纳米平台用于癌症的疫苗接种免疫治疗
发表期刊:《Nano Letters》
影响因子:9.6
作者单位:
1.State Key Laboratory of Drug Research & Center of Pharmaceutics, Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China;
2.China State Institute of Pharmaceutical Industry, Shanghai 201203, China;
3.Shandong Institute of Cancer Prevention and Treatment, Jinan 250117, China.
作者信息:
Lei Zhou, Bo Hou, Dangge Wang, Fang Sun
基于新抗原(neoantigen)的癌症疫苗通过激活细胞毒性T淋巴细胞(CTLs)发挥抗肿瘤作用,但其疗效受限于树突状细胞(DCs)的功能抑制。本文提出通过酸响应性聚合物纳米疫苗激活干扰素基因刺激因子(STING)通路,增强DCs的抗原呈递能力,从而提升免疫治疗效果。
本研究通过RAFT聚合合成酸响应性嵌段共聚物PEG-b-PDPA,利用酯酶可裂解的4-乙酰氧基苄酯键将STING激动剂DMXAA共价偶联至聚合物主链,制备DMXAA-聚合物偶联物(PEG-b-PDPA-DMXAA)。随后,将其与阳离子聚合物OEI-C14共组装形成胶束纳米颗粒(PDPM),并通过甘露糖(Man)修饰实现树突状细胞(DCs)靶向(Man-PDPM)。采用纳米沉淀法将肿瘤新抗原(OVA或4T1新抗原M32)负载于纳米颗粒中,形成纳米疫苗。通过体外实验评估纳米疫苗的细胞摄取、抗原呈递效率及STING通路激活效应(流式细胞术、Western blot、RT-PCR),并在B16-OVA黑色素瘤和4T1乳腺癌小鼠模型中验证其体内靶向性(荧光成像)、抗肿瘤效果及免疫记忆效应,同时联合抗PD-L1抗体(αPD-L1)探索协同治疗潜力。
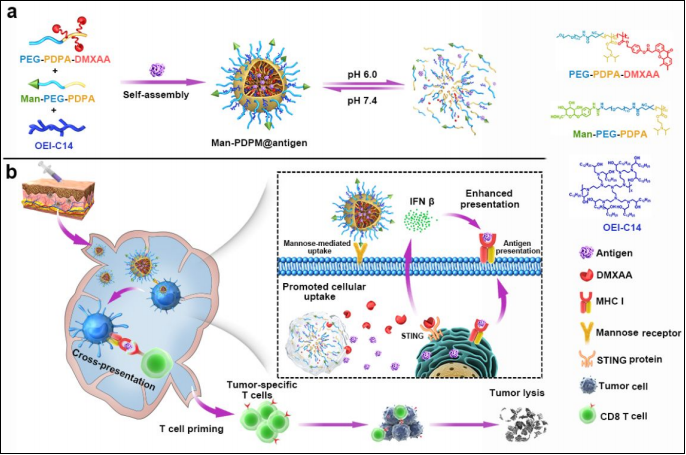
图1:纳米疫苗设计与作用机制示意图
1a:纳米疫苗由酸响应性聚合物(PEG-b-PDPA)、STING激动剂(DMXAA)和新抗原(OVA/M32)组成。
1b:纳米疫苗靶向淋巴结DCs,释放抗原并激活STING通路,促进IFN-β分泌和CTLs活化。
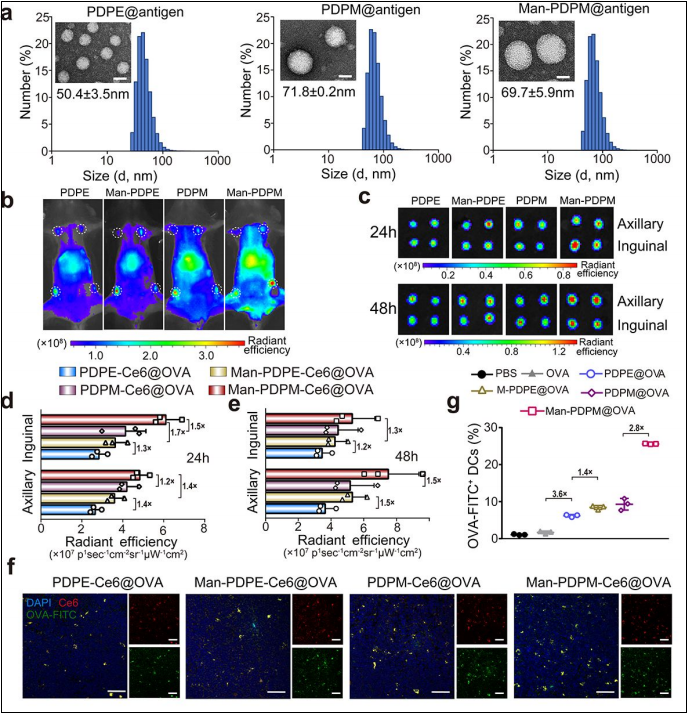
图2:纳米疫苗的理化性质与淋巴结靶向性
2a:TEM显示纳米颗粒呈球形,粒径约50-70 nm;
2b-c:荧光成像显示纳米疫苗在淋巴结(LNs)高效富集;
2d-f:Man修饰显著增强DCs和巨噬细胞的摄取。
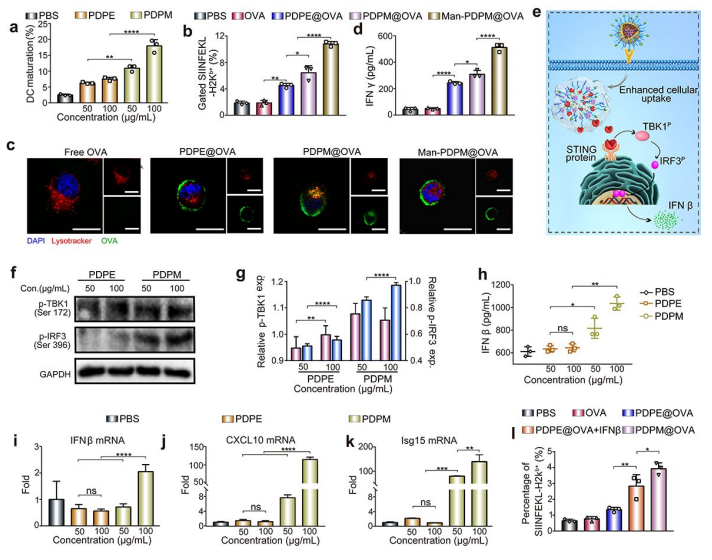
图3:纳米疫苗激活DCs的STING通路与抗原呈递
3a:PDPM纳米颗粒剂量依赖性促进DCs成熟(CD80/CD86表达);
3b-c:Man-PDPM@OVA显著提升抗原-MHC-I复合物表达;
3d:激活的DCs诱导OT-1 CD8+T细胞分泌IFN-γ;
3e-k:DMXAA激活STING-TBK1-IRF3通路,上调IFN-β、CXCL10等基因表达。
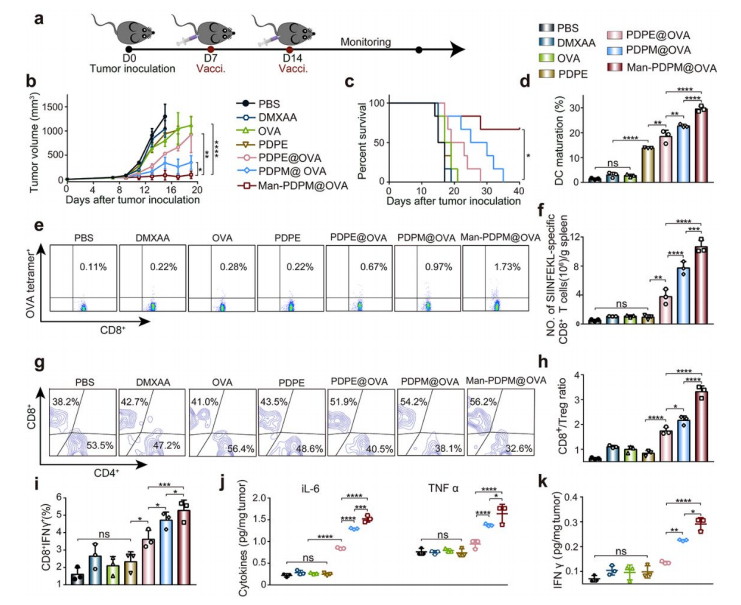
图4:纳米疫苗在B16-OVA模型中的抗肿瘤效果
4b-c:Man-PDPM@OVA显著抑制肿瘤生长,延长生存期(80%抑制率);
4e-f:脾脏中抗原特异性CD8+T细胞比例增加(1.8倍);
4h-i:肿瘤内CD8+T细胞比例升高,Tregs比例下降,IFN-γ分泌增强。
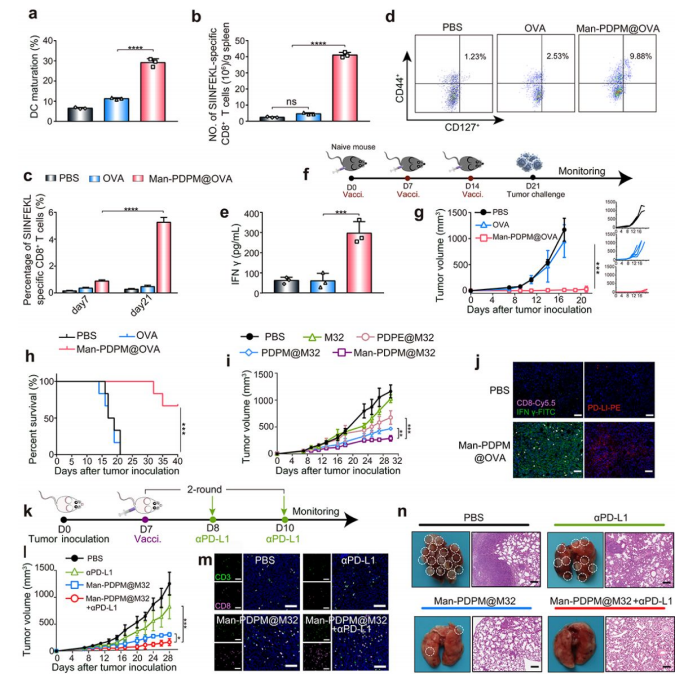
图5:预防性免疫与联合治疗策略
5f-h:预防性接种完全阻止B16-OVA肿瘤发生;
5j:4T1模型中联合αPD-L1抑制PD-L1上调,增强CD8+T细胞浸润;
5n:联合治疗显著减少4T1肺转移灶。
本研究开发的酸响应性纳米疫苗通过靶向递送新抗原与STING激动剂至淋巴结DCs,显著提升抗原呈递效率:
1)甘露糖修饰增强淋巴结靶向,促进DCs摄取;
2)酸响应性纳米颗粒在溶酶体酸性环境中释放抗原,并通过阳离子聚合物OEI-C14介导的内体逃逸促进胞质抗原递送;
3)DMXAA激活STING-TBK1-IRF3通路,诱导IFN-β分泌,增强DCs成熟与T细胞活化。在B16-OVA模型中,纳米疫苗显著抑制肿瘤生长(80%抑制率),并完全预防肿瘤发生(4/6小鼠无瘤生存);
在4T1乳腺癌模型中,联合αPD-L1抗体通过逆转免疫抑制微环境,显著抑制原发肿瘤生长及肺转移。该策略为个性化癌症免疫治疗提供了高效、安全的纳米平台。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:基因治疗‘快递员’动态追踪大揭秘!PET影像首次捕捉AAV病毒18天体内运输全程
下一篇:糖尿病元凶竟是肠道菌群?最新研究揭秘胆汁酸代谢失衡的关键作用!