常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-03-22 12:00:00 细胞资源库平台 访问量:361
英文标题:Ursodeoxycholic acid inhibits the uptake of cystine through SLC7A11 and impairs de novo synthesis of glutathione
中文标题:熊去氧胆酸(UDCA)通过SLC7A11抑制胱氨酸摄取及抗肿瘤机制
发表期刊:《Journal of Pharmaceutical Analysis》
影响因子:6.1
作者单位:厦门大学医学院翔安医院癌症研究中心、细胞应激生物学国家重点实验室、健康与医学数据科学国家研究院、厦门大学医学院翔安医院肝胆外科
作者信息:Fu'an Xie;Yujia Niu;Xiaobing Chen;Xu Kong;Guangting Yan;Aobo Zhuang;Xi Li;Lanlan Lian;Dongmei Qin;Quan Zhang;Ruyi Zhang;Kunrong Yang;Xiaogang Xia;Kun Chen;Mengmeng Xiao;Chunkang Yang;Ting Wu;Ye Shen;Chundong Yu;Chenghua Luo;Wengang Li
UDCA抑制胱氨酸转运机制:熊去氧胆酸(UDCA)通过直接结合胱氨酸转运蛋白SLC7A11,阻断其介导的胱氨酸摄取功能,导致细胞内胱氨酸水平下降。
谷胱甘肽合成受阻:胱氨酸摄取减少抑制谷胱甘肽(GSH)的从头合成,破坏细胞抗氧化系统,引发活性氧(ROS)累积和线粒体氧化损伤。
抗肿瘤效应验证:
体外实验显示,UDCA(≥125 μg/mL)显著抑制脂肪肉瘤细胞增殖;
同位素示踪([15N2]-胱氨酸、[13C5]-谷氨酰胺)证实UDCA干扰胱氨酸代谢及GSH合成通路。
协同治疗潜力:UDCA可增强铁死亡诱导剂(Erastin、RSL3)、MDM2抑制剂(Nutlin 3a、RG7112)、CDK4抑制剂(Abemaciclib)及谷氨酰胺酶抑制剂(CB839)的抗癌效果。
临床相关性:
腹膜后脂肪肉瘤(RLPS)患者血清中UDCA水平显著低于健康人群;
动物模型证实UDCA通过ROS依赖途径抑制肿瘤生长,且与胱氨酸补充具有拮抗效应。
代谢组学分析
样本来源:89例RLPS患者 vs. 健康人血清。
技术平台:LC-MS/MS脂质组学,MetaboAnalyst软件分析。
结果:UDCA是RLPS患者血清中下调最显著的代谢物之一(P<0.01)。
细胞功能实验
CCK-8增殖实验:UDCA处理72小时后,SW872细胞活力下降50%(IC50≈125 μg/mL)。
Seahorse能量代谢分析:UDCA导致线粒体OCR(氧消耗速率)下降30%,ATP生成减少。
动物模型数据
肿瘤体积抑制率:UDCA单药治疗组肿瘤体积减少60%(vs. 对照组,P<0.001)。
生存期延长:联合CB839治疗组小鼠中位生存期延长40%(P<0.01)。
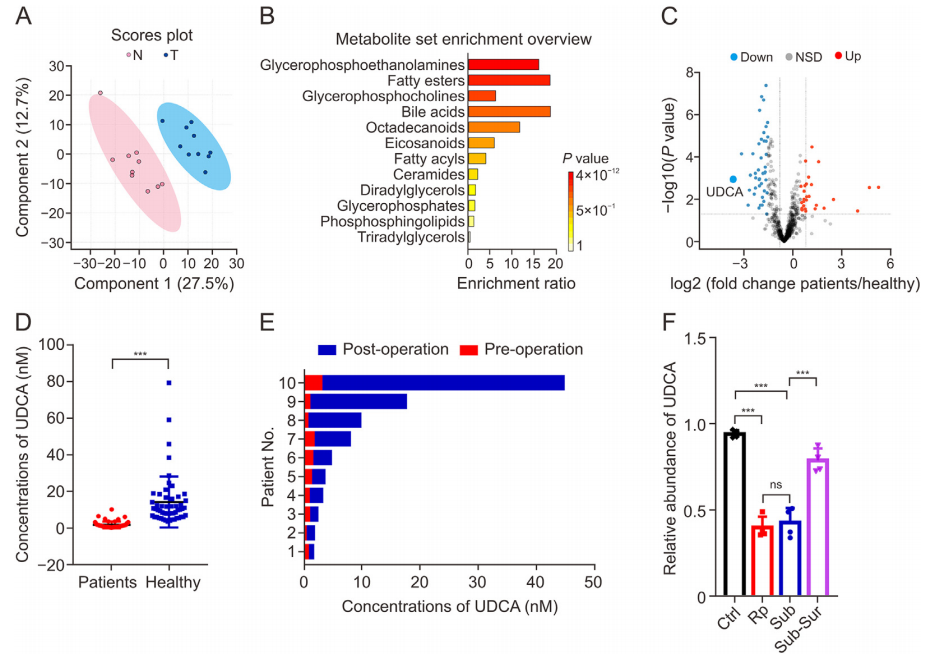
图1:腹膜后脂肪肉瘤(RLPS)患者和健康捐赠者血清样本的脂质组学分析
(A) 对健康组和患者组的脂质组学数据进行偏最小二乘判别分析。n = 10每组。N: 正常健康个体;T: 腹膜后去分化脂肪肉瘤患者。
(B) 脂质水平的京都基因与基因组百科全书(KEGG)功能富集分析。n = 10每组。
(C) 脂质相对丰度的火山图,其中差异表达的脂质用红色(上调)和蓝色(下调)标注。在RLPS患者的血清中观察到UDCA减少。n = 10每组。NSD: 无显著差异。
(D) 使用内标(D4-鹅去氧胆酸)对患者和健康个体中UDCA浓度进行绝对定量。n = 53每组。数据以平均值 ± 标准误差(SEM)表示。***P<0.0001。
(E) 术前和术后期间UDCA的浓度,通过内标(D4-鹅去氧胆酸)测定。n = 10。
(F) 在UDCA(200 mg/kg)处理24小时后,对携带脂肪肉瘤的小鼠中UDCA浓度进行相对定量(Ctrl: 未接种脂肪肉瘤;Rp: 腹膜后接种脂肪肉瘤;Sub: 皮下接种脂肪肉瘤;Sub-Sur: 皮下接种脂肪肉瘤并通过手术切除肉瘤)。n = 3。数据以平均值 ± SEM表示。** *P<0.001;ns: 无显著性。数据使用双尾Student’s t检验进行分析。
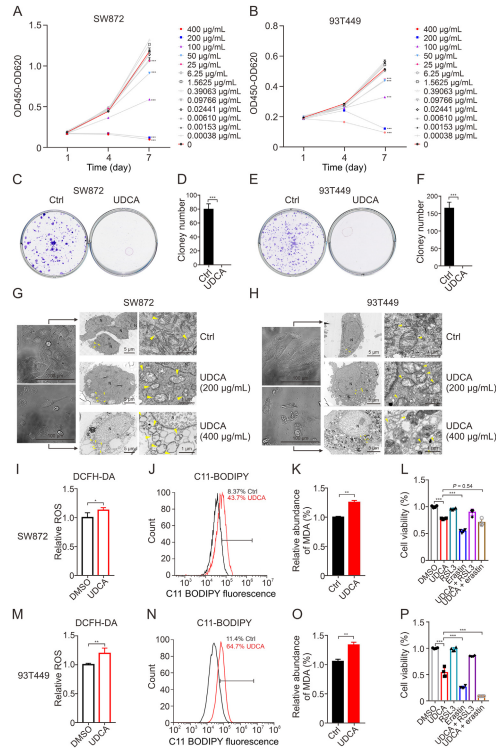
图2:UDCA抑制脂肪肉瘤细胞的增殖并增加其对铁死亡的敏感性
(A, B) 在不同浓度的UDCA(400、200、100、50、25、6.25、1.5625、0.39063、0.09766、0.02441、0.00610、0.00153、0.00038、0 mg/mL)处理下,SW872 (A) 和 93T449 (B) 细胞的存活率分析。n = 5。
(C-F) 使用UDCA(200 mg/mL)处理导致SW872 (C, D) 和 93T449 (E, F) 细胞的克隆形成减少。n = 3。数据为平均值 ± 标准差(SD)。***P <0.001。Ctrl: DMSO。
(G, H) 显微镜下获得的SW872细胞在400 mg/mL UDCA处理12小时后的代表性图像,以及200 mg/mL和400 mg/mL UDCA处理12小时后SW872细胞的透射电子显微镜(TEM)图像(G)。93T449细胞的情况相同(H)。N: 细胞核。
(I, M) 在SW872和93T449细胞中,使用UDCA(400 mg/mL)处理后的活性氧(ROS)(DCFH-DA)水平测量。n = 3。数据为平均值 ± SD。*P <0.05, **P <0.01。
(J, N) 在SW872 (J) 和 93T449 (N) 细胞中,使用UDCA(400 mg/mL)处理6小时后的C11-BODIPY荧光流式细胞术分析。
(K, O) 在SW872 (K) 和 93T449 (O) 细胞中,使用UDCA(400 mg/mL)处理后的丙二醛(MDA)水平。n = 3。数据为平均值 ± SD。**P <0.01。
(L, P) 在SW872 (L) 和 93T449 (P) 细胞中,单独使用UDCA或与RSL3(1 mM)和erastin(10 mM)联合使用后的细胞存活率分析。n = 3。数据为平均值 ± SD。** *P <0.001。数据使用双尾Student’s t检验进行分析。
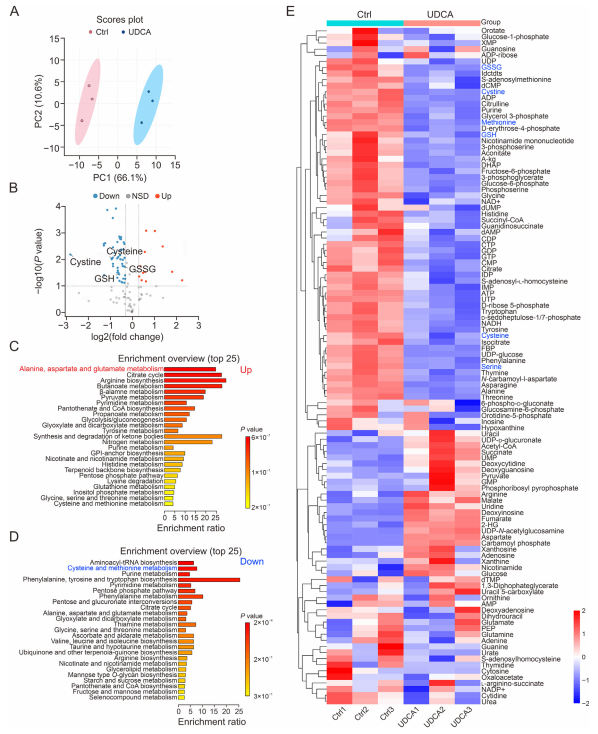
图3:UDCA处理后的SW872细胞的代谢组学分析
(A) 对代谢组数据进行的偏最小二乘判别分析。每组n=3。Ctrl:DMSO。
(B) 火山图展示了对照组和UDCA处理组细胞中差异代谢物的相对丰度,其中上调代谢物用红色标记,下调代谢物用蓝色标记。每组n=3。NSD:无显著差异。
(C, D) 对UDCA处理的SW872细胞中的差异代谢物进行的京都基因与基因组百科全书(KEGG)功能富集分析。每组n=3。
(E) UDCA处理的SW872细胞中差异代谢物的热图。每组n=3。Ctrl:对照组。

图4:UDCA处理后的SW872细胞的稳定同位素示踪分析
(A) 示意图展示了15N(黄色三角形)从胱氨酸整合到谷胱甘肽(GSH)合成途径的过程。
(B) 在含有[15N2]-胱氨酸的培养基中,UDCA或DMSO处理后3、6、12和24小时细胞内标记胱氨酸(M2)的比值。n=3。数据为均值±SEM。*P <0.05。
(C, D) 在含有[15N2]-胱氨酸的培养基中,UDCA和DMSO处理3、6、12和24小时后,SW872细胞中标记和未标记的GSH和GSSG水平。n=3。数据为均值±SEM。**P <0.01,***P <0.001。
(E, F) 用于计算标记率的GSH水平(每组时间点n=3生物重复),UDCA组(E)和对照组(F);黑点代表标记程度的中位数,须线代表±SEM。
(G) 在UDCA和DMSO处理6和12小时后,培养基中胱氨酸的相对强度。*P <0.05,***P <0.001。
(H) 示意图展示了13C(黄色圆圈)从谷氨酰胺整合到GSH合成途径和三羧酸(TCA)循环的过程,使用[13C5]-谷氨酰胺。
(I-N) 在含有[13C5]-谷氨酰胺的培养基中,UDCA和DMSO处理3、6和12小时后,SW872细胞中标记和未标记的谷氨酰胺(I)、谷氨酸(J)、GSH(K)和GSSG(L)水平。n=3。数据为均值±SEM。*P <0.05;**P <0.01;***P <0.001。
(M) 在含有[13C5]-谷氨酰胺的培养基中,UDCA或DMSO处理后3、6和12小时,细胞内标记谷氨酸[M5]与谷氨酰胺[M5]的比值。n=3。数据为均值±SEM。**P <0.01,***P <0.001。
(N) 在UDCA和DMSO处理6和12小时后,培养基中谷氨酸的相对强度。
(O, P) 在含有[13C5]-谷氨酰胺的培养基中,UDCA和DMSO处理的SW872细胞中标记和未标记的柠檬酸(O)和异柠檬酸(P)水平。n=3。数据为均值±SEM。*P <0.05;**P <0.01;***P <0.001。
(Q) 示意图展示了[13C2](黄色圆圈)从葡萄糖整合到TCA循环的过程。
(R) 在含有[13C2]-葡萄糖的培养基中,UDCA和DMSO处理的SW872细胞中标记和未标记的代谢物水平。n=3。数据为均值±SEM。***P <0.001。
(S) 示意图展示了[13C2](黄色圆圈)从葡萄糖生成烟酰胺腺嘌呤二核苷酸磷酸氢(NADPH)的过程。
(T) 核酮糖-5-磷酸(Ru5P)/葡萄糖-6-磷酸(G6P)的比值。n=3。数据为均值±SEM。***P <0.001。
(U, V) 糖酵解和TCA循环通量。箭头表示净相对通量的方向;数字表示净相对通量。使用INCA软件将葡萄糖摄入通量固定在100(V1)稳态。细胞经UDCA处理后,谷氨酰胺进入TCA循环的代谢通量增加(V7)。Glu:谷氨酸;Cys:半胱氨酸;a-KG:α-酮戊二酸;Cit:柠檬酸;Isocit:异柠檬酸;Pyr:丙酮酸;Glc:葡萄糖;Fum:延胡索酸;PEP:磷酸烯醇丙酮酸;AcCoA:乙酰辅酶A;Mal:苹果酸;Suc:琥珀酸。
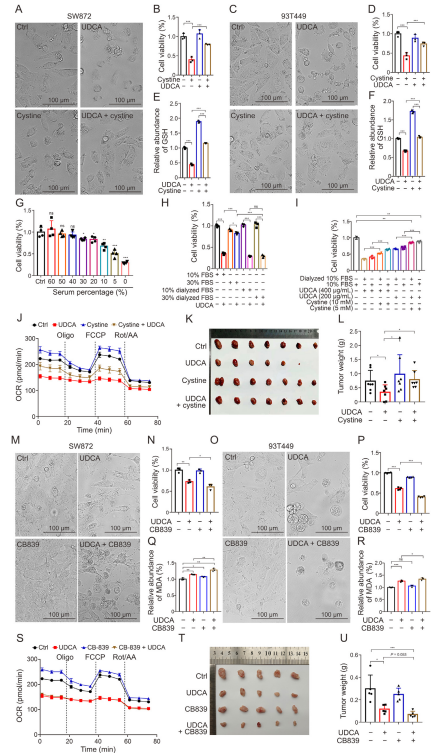
图5:胱氨酸和CB839对UDCA介导的细胞死亡的影响
(A-D) 在SW872(A, B)和93T449(C, D)细胞中,分别用UDCA(400 mg/mL)、胱氨酸(10 mM)及其组合处理12小时后,分析细胞活力。n=5。数据为均值±标准差(SD)。***P <0.001。Ctrl:二甲基亚砜(DMSO)。
(E, F) 在SW872(E)和93T449(F)细胞中,分别用UDCA(400 mg/mL)、胱氨酸(10 mM)及其组合处理12小时后,分析谷胱甘肽(GSH)水平。n=5。数据为均值±SD。***P <0.001。
(G) 在不同血清浓度的培养基中,用UDCA(400 mg/mL)处理SW872细胞后,分析细胞活力。n=4。数据为均值±SD。*P <0.05,**P <0.01,***P <0.001;ns:无显著差异。
(H) 在含有胎牛血清(FBS)和透析FBS的培养基中,用UDCA(400 mg/mL)处理SW872细胞后,分析细胞活力。n=3。数据为均值±SD。*P <0.05,***P <0.001;ns:无显著差异。
(I) 在补充FBS或透析FBS的培养基中,用不同浓度的UDCA和胱氨酸处理SW872细胞后,分析细胞活力。n=4。数据为均值±SD。**P <0.01,***P <0.001。
(J) 在SW872和93T449细胞中,分别用UDCA(400 mg/mL)和胱氨酸(10 mM)单独或联合处理12小时后,检测氧消耗率(OCR)。n=3。数据为均值±SEM。
(K, L) 分析单独或联合使用UDCA(250 mg/kg/天)和胱氨酸(1 mmol/kg/天)对SW872细胞皮下成瘤能力的影响。n=7。数据为均值±SD。*P <0.05。
(M-P) 在SW872(M, N)和93T449(O, P)细胞中,分别用UDCA(400 mg/mL)和CB839(50 nM)单独或联合处理12小时后,分析细胞活力。n=5。数据为均值±SD。*P <0.05,**P <0.01,***P <0.0001。
(Q, R) 在SW872(Q)和93T449(R)细胞中,分别用UDCA(400 mg/mL)和CB839(50 nM)单独或联合处理12小时后,检测丙二醛(MDA)水平。n=3。数据为均值±SD。*P <0.05,**P <0.01,***P <0.001;ns:无显著差异。
(S) 在SW872细胞中,分别用UDCA(400 mg/mL)和CB839(50 nM)单独或联合处理12小时后,检测氧消耗率(OCR)。n=3。数据为均值±SEM。
(T, U) 分析单独或联合使用UDCA(250 mg/kg/天)和CB839(200 mg/kg/天)对SW872细胞皮下成瘤能力的影响。n=5。数据为均值±SD。**P <0.01,***P <0.001。Oligo:寡霉素;FCCP:羰基氰化物4-(三氟甲氧基)苯腙;Rot/AA:鱼藤酮/抗霉素A。
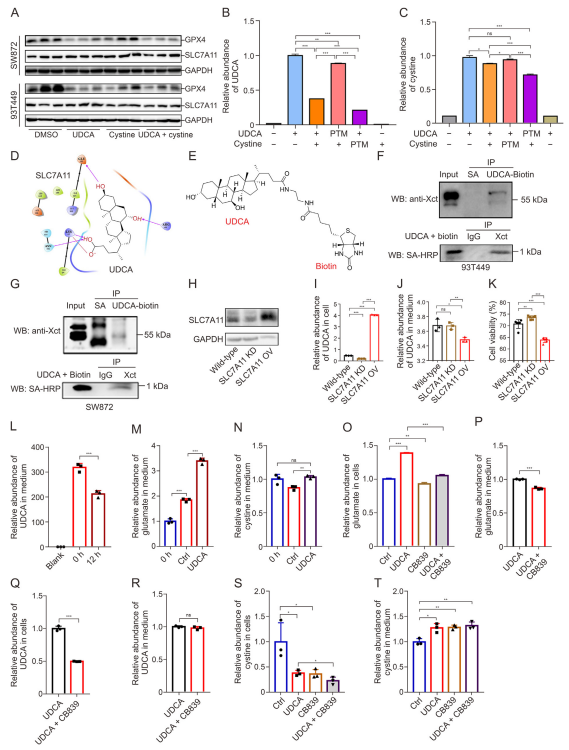
图6:基于SLC7A11的UDCA结合和转运分析
(A) 在SW872细胞中,分别用UDCA和胱氨酸单独或联合处理12小时后,通过Western blot分析GPX4和SLC7A11的表达。n=3。数据为均值±标准差(SD)。
(B, C) UDCA(B)和胱氨酸(C)与SLC7A11的结合抑制分析。n=3。数据为均值±SEM。*P <0.05,**P <0.01,***P <0.001;ns:无显著差异。
(D) 使用Schrodinger 2018软件进行分子建模和对接分析,展示野生型SLC7A11及其预测的结合位点。
(E) UDCA和乙二胺生物素(EA-Biotin)偶联化合物(UDCA-Biotin)的化学结构。
(F, G) 在93T449(F)和SW872(G)细胞中,通过免疫共沉淀分析UDCA-Biotin与SLC7A11的相互作用。
(H) 在野生型(空载体)、SLC7A11敲低(SLC7A11 KD)和SLC7A11过表达(SLC7A11 OV)的SW872细胞系中,通过Western blot分析SLC7A11的表达。
(I, J) 在野生型、SLC7A11 KD和SLC7A11 OV细胞系中,用UDCA处理后,细胞内(I)和培养基中(J)UDCA的相对丰度。n=3。数据为均值±SD。*P <0.05,**P <0.01,***P <0.001;ns:无显著差异。
(K) 在野生型、SLC7A11 KD和SLC7A11 OV细胞系中,用UDCA处理12小时后,评估细胞活力。n=5。数据为均值±SEM。*P <0.05,***P <0.001。
(L-N) 培养基中UDCA(L)、谷氨酸(M)和胱氨酸(N)的相对丰度。n=3。数据为均值±SEM。**P <0.01,***P <0.001;ns:无显著差异。
(O-T) 用UDCA和CB839(1 mM)处理后,细胞和培养基中谷氨酸(O, P)、UDCA(Q, R)和胱氨酸(S, T)的相对丰度。数据为均值±SEM。*P <0.05,**P <0.01,***P <0.001;ns:无显著差异。Ctrl:DMSO;PTM:预处理;SA:链霉亲和素;Xct:Xct抗体。
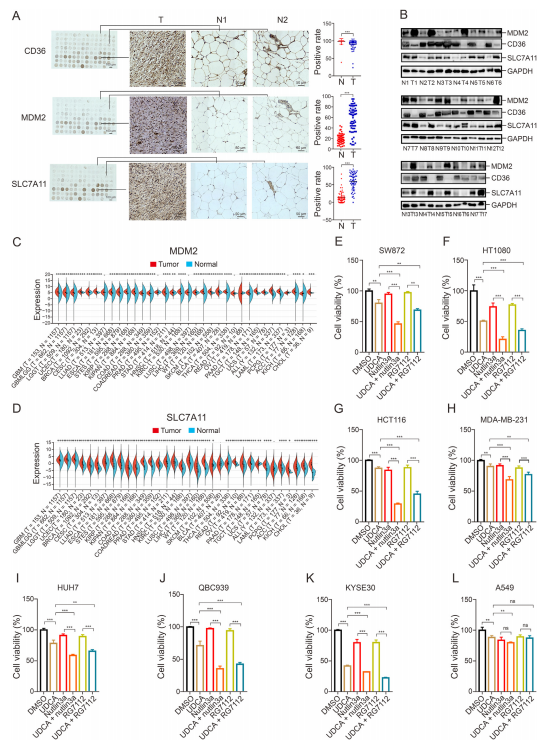
图7:SLC7A11在腹膜后脂肪肉瘤(RLPS)临床组织样本中的表达及UDCA增强多种肿瘤细胞对活性氧(ROS)诱导的抑制剂介导的抗肿瘤治疗的敏感性
(A) 使用指定抗体对RLPS组织和邻近脂肪组织微阵列进行免疫组织化学(IHC)染色。n=50。数据为均值±标准差(SD)。*P <0.001。
(B) 通过Western blot检测来自腹膜后去分化脂肪肉瘤和分化良好脂肪肉瘤患者的RLPS和邻近脂肪组织裂解液中的MDM2、CD36和SLC7A11。n=17。
(C, D) 对MDM2(C)和SLC7A11(D)进行的泛癌分析(数据来源:http://www.sangerbox.com/home.html)。
(E-L) 在去分化脂肪肉瘤(SW872)(E)、纤维肉瘤(HT1080)(F)、结直肠癌(HCT116)(G)、乳腺癌(MDA-MB-231)(H)、肝癌(HUH7)(I)、胆管癌(QBC939)(J)、食管癌(KYSE30)(K)和肺癌(A549)(L)细胞中,分别用UDCA(400 mg/mL)、nutlin3a(10 mM)和RG7112(5 mM)单独或联合处理24小时后,分析细胞活力。n=5。数据为均值±SD。P <0.01,***P <0.001;ns:无显著差异。
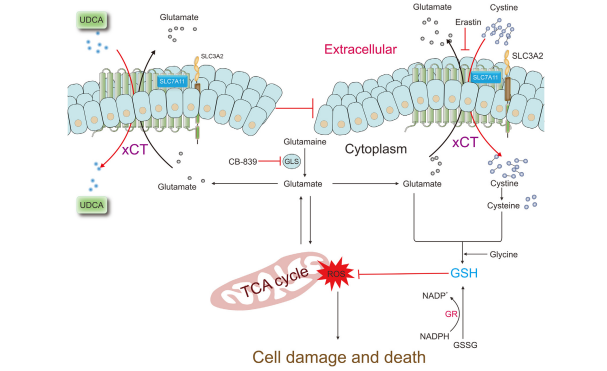
图8:UDCA抑制SLC7A11介导的胱氨酸摄取并破坏谷胱甘肽(GSH)从头合成的机制示意图
UDCA抑制胱氨酸的细胞内转运,导致细胞内胱氨酸、半胱氨酸和GSH水平降低,进而引发线粒体损伤和三羧酸循环(TCA循环)紊乱。
研究背景
对RLPS患者的血清进行脂质组学分析,发现UDCA水平在手术后显著下降并反弹。
UDCA的作用机制
UDCA的功能和机制因癌细胞类型、治疗持续时间、剂量及药物组合而异。
UDCA通过抑制SLC7A11介导的胱氨酸转运,导致GSH合成受损,并增加细胞对ROS的敏感性。
研究意义
揭示了UDCA在肿瘤中的新机制,特别是其通过SLC7A11调控胱氨酸代谢的作用。
为UDCA在抗肿瘤治疗中的应用提供了理论基础。
未来研究方向
研究肿瘤发生与其他胆汁酸(如EDCA)的关系,EDCA在脂肪肉瘤患者血清中也显著下降。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:开发靶向NanoLuc的蛋白降解剂及通用报告系统以评估标签靶向降解平台
下一篇:建立基于荧光素酶的报告系统以研究人类巨细胞病毒感染、复制特性及抗病毒药物疗效