常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-03-24 17:10:00 细胞资源库平台 访问量:256
英文标题:LncRNA MACC1-AS1 induces gemcitabine resistance in pancreatic cancer cells through suppressing ferroptosis
中文标题:LncRNA MACC1-AS1通过抑制铁死亡诱导胰腺癌细胞对吉西他滨耐药
发表期刊:《Cell Death Discovery》
影响因子:7
作者单位:宁波大学第一附属医院肝胆胰外科、福建医科大学、宁波大学医学部等
作者信息:Jiyun Zhu, Zehao Yu, Xuguang Wang, Jinghui Zhang et al.
胰腺癌是一种罕见但致死率高的恶性肿瘤。
吉西他滨是胰腺癌的主要化疗药物,但响应率低,易产生抗药性。
铁死亡是一种新的细胞死亡方式,与胰腺癌细胞的抗氧化系统有关。
Nrf2-ARE和Keap1-Nrf2途径在调节铁死亡中起重要作用。
非编码RNA,特别是MACC1-AS1,可能在胰腺癌细胞的抗药性中发挥作用。
MACC1-AS1通过特定途径影响胃癌细胞的行为。
STK33与PDAC细胞的恶性行为和低氧诱导因子-1α有关。
MACC1-AS1/STK33轴可能在胰腺癌的吉西他滨抗药性中起关键作用。
研究评估了抑制MACC1-AS1和STK33在临床治疗中的效果。
临床预测DCA的效果被纳入研究评估。
1. 样本来源:来自中国宁波大学医学院第一附属医院的30名胰腺癌患者的胰腺癌组织样本,通过抽签方式选择样本,所有患者均签署了研究同意书,研究方案得到医院伦理委员会的预先批准。
2. 细胞和细胞培养:使用中国科学院细胞库和IMMOCELL购买的人胰腺导管腺癌(PDAC)细胞系,包括PANC-1、MIAPACA、PANC-1/Gem和MIAPACA/Gem,通过短串联重复(STR)标记确认细胞系的真实性,所有细胞均使用DMEM培养基在37°C、5%二氧化碳的环境中培养。
3. 慢病毒和逆转病毒生产和感染:使用针对MACC1-AS1、STK33、Kras的shRNA和siRNA进行基因沉默,并通过慢病毒和逆转病毒载体进行感染。
4. CRISPR/Cas9介导的基因敲除:使用基于CRISPR/Cas9的工具对MACC1-AS1基因进行敲除。
5. 细胞增殖实验:使用CCK8试剂盒评估细胞增殖。
6. 脂质过氧化产物(MDA)和活性氧(ROS)分析:使用试剂盒评估脂质过氧化产物和活性氧水平。
7. 细胞器特异性染色:使用C11-BODIPY、JC-1和脂质-BODIPY进行细胞器特异性染色。
8. RIP和RNA pulldown分析:使用Millipore的Magna RNA结合蛋白免疫沉淀试剂盒和Pierce Magnetic RNA-Protein Pull-Down Kit进行RNA结合蛋白的免疫沉淀和RNA pulldown实验。
9. CLIP-qPCR:使用交联免疫沉淀和qPCR试剂盒进行RNA结合蛋白的特异性结合位点的。
10. 亚细胞分离:使用Norgen Biotek Corp的试剂盒进行细胞质和细胞核的分离。
11. FISH和免疫荧光染色:使用lncRNA FISH试剂盒和抗STK33抗体进行荧光原位杂交和免疫荧光染色。
12. 细胞和组织的总RNA提取和定量PCR:使用定量PCR分析细胞和组织中的RNA水平。
13. 蛋白质提取和Western blot分析:使用RIPA缓冲液提取蛋白质,并通过Western blot分析蛋白质表达。
14. 动物和肿瘤模型:使用Balb/c裸鼠建立肿瘤模型,评估肿瘤生长和生存期,动物实验遵守相关伦理规定,并得到大学伦理委员会的批准。
15. 质谱分析:使用Orbitrap-Elite质谱仪进行蛋白组学分析。
16. 生物信息学分析:使用R软件对TCGA和GTEx数据库中的MACC1-AS1和STK33表达数据进行分析。
17. 统计学分析:使用SPSS和GraphPad Prism软件进行统计学分析,P值小于0.05被认为具有统计学意义。
18. 数据可用性:实验数据可在合理请求下从通讯作者处获得。

图1:MACC1-AS1在胰腺癌中高度表达,并与吉西他滨耐药性不良预后相关
- A, B:通过TCGA数据分析,MACC1-AS1在PDAC(胰腺导管腺癌)患者中的表达与生存率(OS)的关系。- C:MACC1-AS1在不同PDAC细胞系和正常胰腺细胞中的表达。- D:下调或上调MACC1-AS1基因对PANC-1/Gem和MIAPACA/Gem细胞在吉西他滨(20 uM)处理下的细胞活力的影响。- E, F:MACC1-AS1对肿瘤药物耐药性相关基因(MDR1, GSS, P450 3A4/5, E-cadherin)蛋白水平的影响。
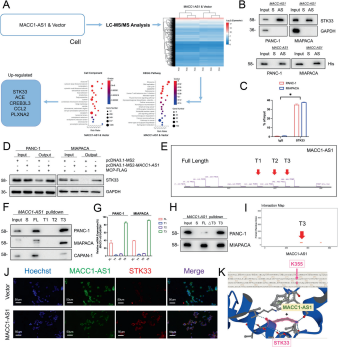
图2:MACC1-AS1直接与STK33相互作用,促进吉西他滨耐药
- A:通过LC-MS/MS分析MACC1-AS1过表达后的下游目标。
- B:通过共沉淀实验验证MACC1-AS1与STK33的结合。
- C:通过RIP实验证明MACC1-AS1与STK33的相互作用。
- D:通过免疫沉淀法证实MACC1-AS1结合蛋白。
- E, F:从预测网站选取MACC1-AS1全长及T1, T2, T3片段进行进一步研究,并通过RNA沉淀和Western blot进行验证。
- G:通过CLIP-qPCR研究T1/T2/T3片段与STK33的结合。
- H:确认MACC1-AS1的T3片段与STK33的相互作用。
- I–K:利用IF和Alphafold数据库展示STK33与MACC1-AS1(T3片段)结合的特定位点和细胞共定位。
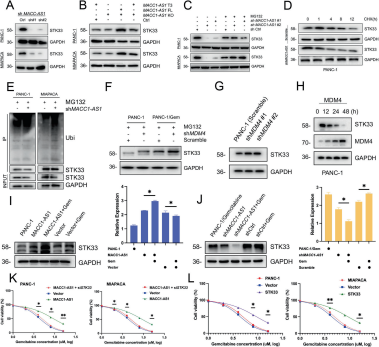
图3:MACC1-AS1通过阻止STK33的泛素化和降解,增强其活性
- A:下调MACC1-AS1后STK33的表达量。
- B:通过CRISPR KO工具研究MACC1-AS1 FL或T3片段对STK33的影响。
- C:探索STK33的稳定性,通过下调MACC1-AS1和MG-132处理。
- D:通过CHX处理评估STK3的表达量。
- E:下调MACC1-AS1条件下STK33泛素化水平。
- F–H:研究MDM4与STK33的关系。
- I, J:通过过表达或下调MACC1-AS1及STK33评估STK33的表达量。
- K, L:通过过表达MACC1-AS1和下调STK33,或在两种细胞中上调STK33,评估细胞活力。
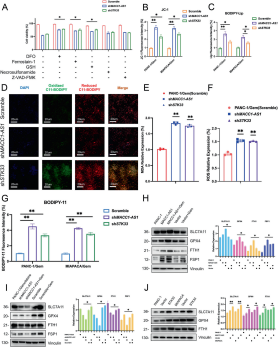
图4:MACC1-AS1/STK33通过抑制铁死亡产生吉西他滨耐药
- A:评估在不同的细胞死亡抑制剂存在或不存在条件下,shMACC1-AS1和shSTK33的细胞活力。
- B–G:通过共聚焦激光显微镜捕捉JC-1, 脂质染色, BODIPY C-11, MDA和ROS assay的代表性图像。
- H–J:通过过表达MACC1-AS1, 敲低MACC1-AS1或上调STK33条件下铁死亡抑制蛋白的表达量。
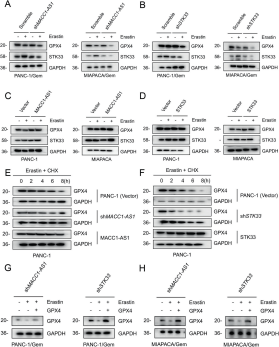
图5:MACC1-AS1/STK33抑制铁死亡中的GPX4降解
- A, B:在PDAC药物抵抗细胞中,通过erastin(30 μM)处理24小时后,下调MACC1-AS1或STK33对STK33和GPX4蛋白水平表达的影响。
- C, D:通过基因转染过表达MACC1-AS1或STK33,在PANC-1和MIAPACA细胞中,处理erastin(30 μM)24小时后对GPX4蛋白表达以及STK33的影响。
- E, F:MACC1-AS1或STK33下调或过表达的PANC1细胞在erastin(25 μM)和 cycloheximide(CHX,25 μg/ml)处理下,设计时间点的Western blot分析结果。
- G, H:过表达GPX4恢复了MACC1-AS1或STK33下调的PDAC药物抵抗细胞在erastin(30 μM)处理24小时后的GPX4表达。
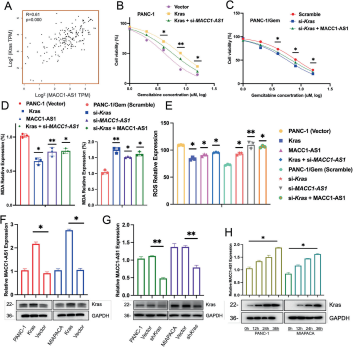
图6:Kras调节MACC1-AS1以维持胰腺癌细胞对吉西他滨的耐药性
- A:在TCGA数据的PDAC患者队列中,分析MACC1-AS1和Kras表达的相关性。
- B, C:通过过表达Kras或敲低Kras,并伴随siMACC1-AS1在PANC-1细胞中或伴随过表达MACC1-AS1在PANC-1/Gem细胞中,评估MACC1-AS1和Kras的功能。
- D, E:在上述条件下,测量MAD和ROS assays的结果。
- F, G:通过qPCR检测在过表达Kras或敲低Kras细胞中的MACC1-AS1表达。
- H:通过诱导剂Doxycycline(30 ng/ml)诱导过表达Kras表达,并在0, 12, 24, 36小时后检测MACC1-AS1表达的qPCR分析。
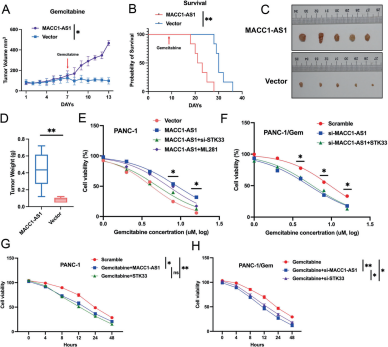
图7:MACC1-AS1/STK33信号轴在胰腺癌动物和细胞模型中的潜在应用
- A–D:在动物模型中,通过注射过表达MACC1-AS1的PANC-1细胞和对照细胞,并在第7天给予Gemcitabine,测量肿瘤体积、生存时间、肿瘤照片和肿瘤重量。
- E, F:PANC-1和PANC-1/Gem细胞共转染指定 vectors/MACC1-AS1/si-STKSS/ML281(治疗)和scramble/si-MACC1-AS1/STK33,在不同浓度的Gemcitabine处理后,通过CCK8 assay测量细胞活力。
- G, H:PANC-1和PANC-1/Gem细胞共转染指定 scramble/MACC1-AS1/STKSS 和scramble/si-MACC1-AS1/si-STK33,在不同时间的Gemcitabine处理后,通过CCK8 assay测量细胞活力。

图8:MACC1-AS1/STK33信号轴在胰腺癌患者中的临床预后潜力
- A, B:分别分析TCGA PADC患者中MACC1-AS1, MACC1-AS1+STK33的OS, PFS和DFS。
- C:使用MACC1-AS1和STK33的组合、MACC1-AS1、STK33建立DCA模块,并分析PDAC患者的1年OS时间。
重要图片提示:
- 图5和图6展示了MACC1-AS1/STK33信号轴对铁死亡相关蛋白GPX4的调控作用,这对于理解耐药机制至关重要。
1. MACC1-AS1在胰腺癌中高表达,与吉西他滨耐药性相关。
2. MACC1-AS1通过抑制铁死亡,增强胰腺癌细胞对吉西他滨的耐药性。
3. MACC1-AS1通过与STK33相互作用,抑制其泛素化和降解。
4. MACC1-AS1/STK33信号轴通过激活GPX4,抑制铁死亡。
5. 过表达MACC1-AS1的胰腺癌细胞表现出对吉西他滨的耐药性增强。
6. 下调MACC1-AS1可以恢复胰腺癌细胞对吉西他滨的敏感性。
7. MACC1-AS1与STK33的联合检测可预测胰腺癌患者的预后。
8. MACC1-AS1/STK33信号轴是胰腺癌化疗耐药性中的关键因素。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
下一篇:利用可吸入的纳米治疗剂对巨噬细胞进行免疫代谢重编程,用于急性肺损伤干预