常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-03-23 17:30:30 细胞资源库平台 访问量:248
英文标题:USP35 promotes HCC development by stabilizing ABHD17C and activating the PI3K/AKT signaling pathway
中文标题:USP35通过稳定ABHD17C并激活PI3K/AKT信号通路促进HCC发展
发表期刊:《Cell Death Discovery》
影响因子:7
作者单位:福建医科大学附属第二医院肝胆胰外科、浙江大学医学院附属第一医院肝胆胰外科、中国人民解放军第910医院健康管理部
作者信息:Linpei Wang,Jiawei Wang,Xiaoqiu Ma,Guomin Ju,Chunfeng Shi,Wei Wang (通讯作者),Jian Wu (通讯作者).
肝细胞癌(HCC)是最常见的肝癌类型,每年报告超过75万例病例。
已确定几种与HCC相关的风险因素,包括肝硬化、严重肝纤维化、酒精滥用、乙型/丙型肝炎病毒感染和代谢性疾病。
尽管有新药如索拉非尼用于治疗中期和晚期HCC,但HCC的治疗仍然具有挑战性且效率低下,因为存在药物耐药性和副作用。
S-棕榈酰化是一种可逆过程,其中16碳饱和脂肪酸与目标蛋白的Cys残基共价连接。
ABHD17C是一种新发现的去棕榈酰酶家族成员,可去除底物的S-棕榈酰化。
此前研究发现,miR-145-5p调节HCC细胞中ABHD17C的mRNA稳定性,但其翻译后修饰仍不清楚。
文章描述了细胞培养、患者样本处理、生物信息学分析、质粒构建、细胞转染、蛋白质分析和一系列细胞功能测试的方法。
研究使用了多种技术,包括荧光素酶活性测定、qPCR、免疫沉淀、免疫印迹、MTT实验、集落形成实验、细胞周期和凋亡分析、Transwell实验以及动物移植瘤模型。
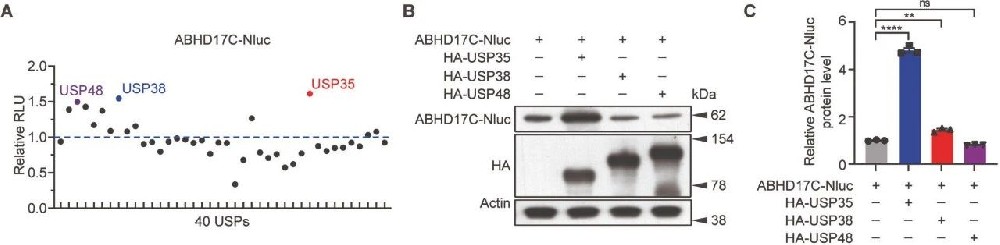
图1. 多种USP影响ABHD17C稳定性
USP35、USP38、USP48过表达时,293T细胞中ABHD17C-Nluc活性最高。
免疫印迹证实USP35、USP38、USP48过表达,ABHD17C在USP35过表达细胞中最高。
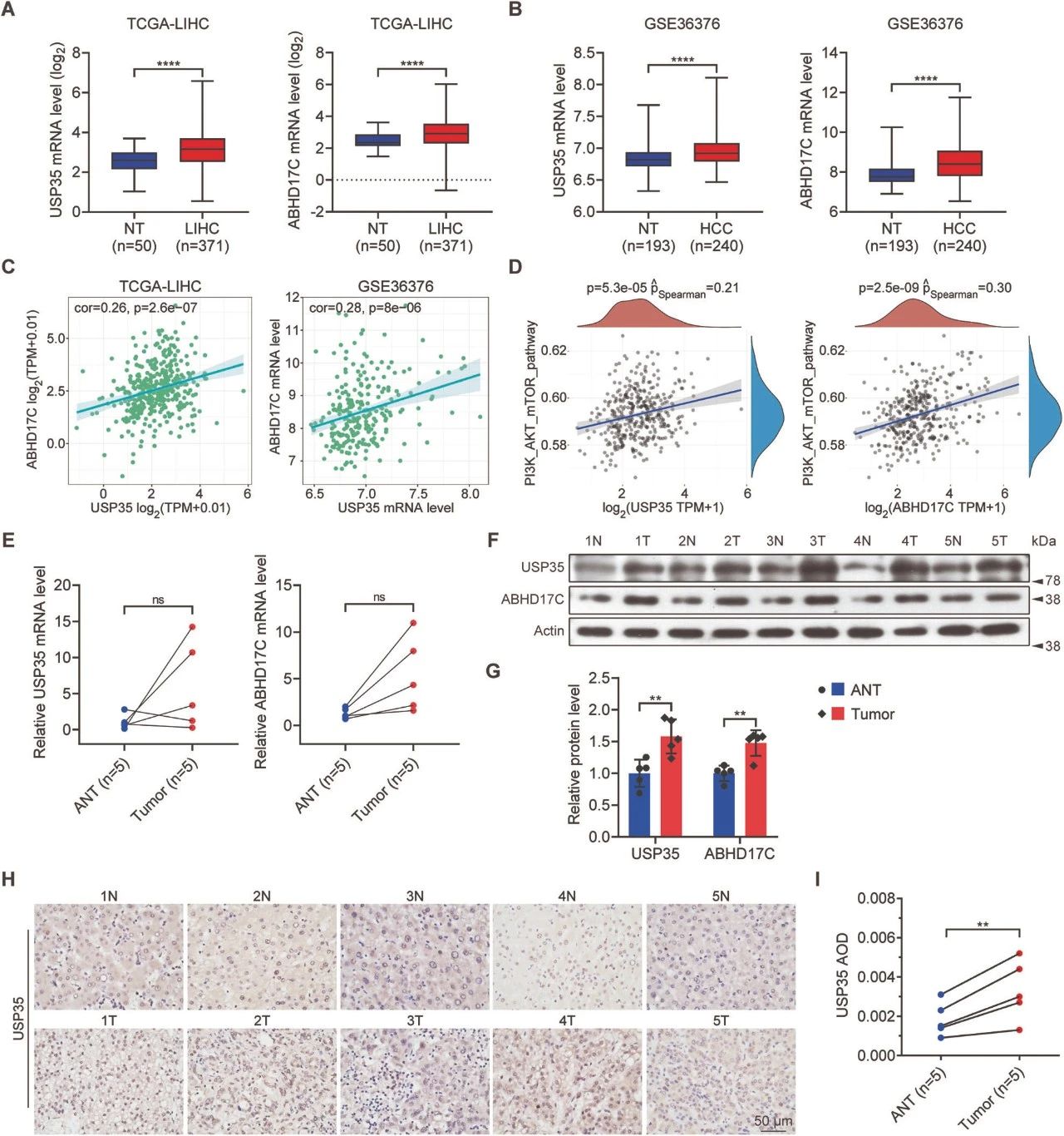
图2. 人类肝细胞癌(HCC)样本中USP35和ABHD17C的表达水平升高,并与HCC和激活的PI3K/AKT途径呈正相关
A.USP35和ABHD17C在HCC样本中的表达水平升高。
B.USP35和ABHD17C的表达与HCC的发展和PI3K/AKT途径的激活相关。
C.在两个独立的数据集中,HCC样本的USP35和ABHD17C mRNA水平均上调。
D.USP35和ABHD17C的表达在HCC样本中呈正相关。
E.GSEA分析支持USP35或ABHD17C与PI3K/AKT途径的关联。
F.qPCR结果未显示HCC肿瘤组织与相邻正常组织之间USP35和ABHD17C mRNA水平的显著差异。
G.免疫印迹和IHC数据均表明HCC肿瘤组织中USP35和ABHD17C蛋白水平升高。
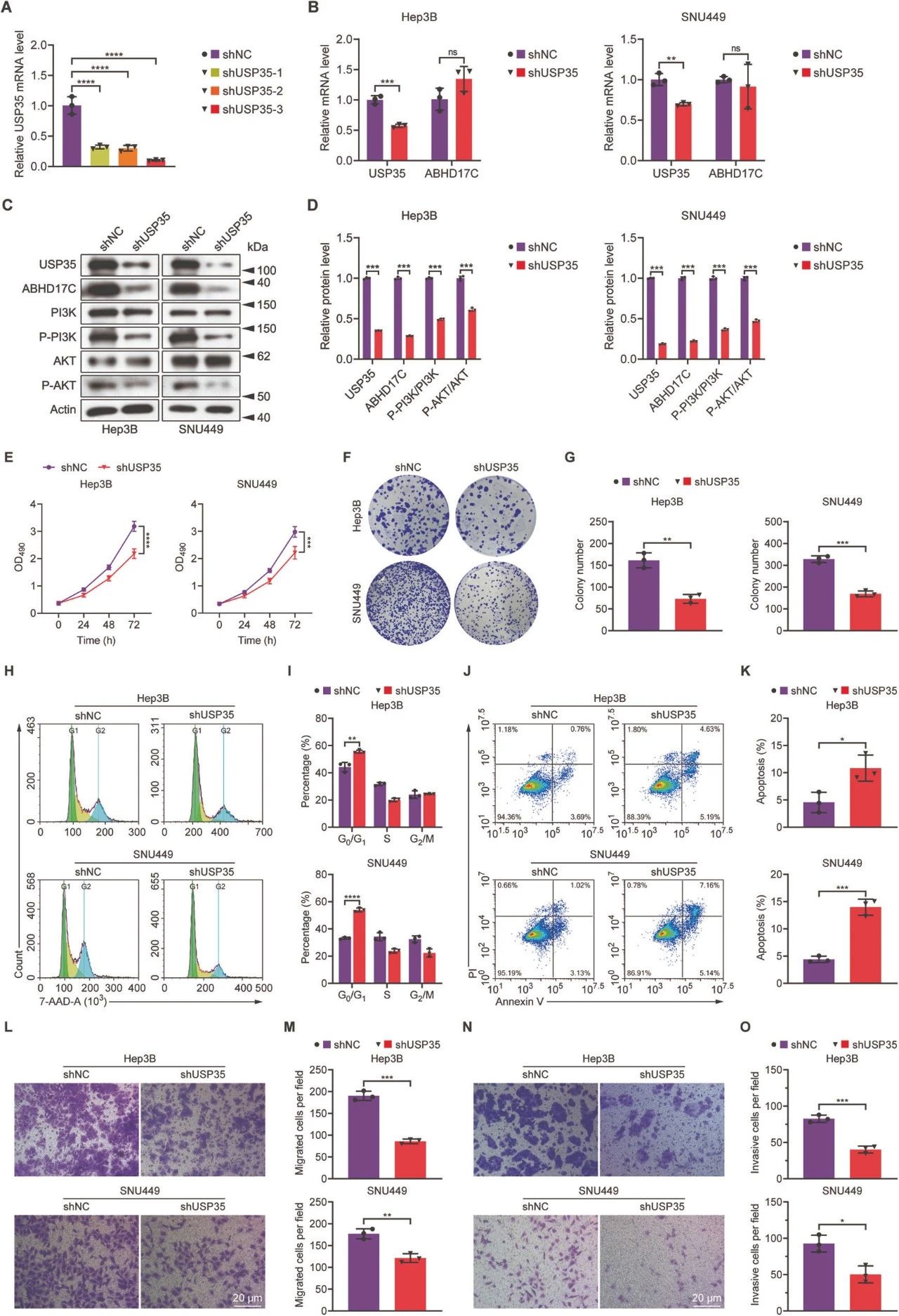
图3. USP35敲除影响HCC细胞功能
qPCR显示USP35敲除后,USP35 mRNA降低,ABHD17C mRNA变化不大。
免疫印迹显示USP35敲除后,ABHD17C、p-PI3K、p-AKT蛋白水平降低。
MTT和集落形成实验显示USP35敲除抑制HCC细胞增殖。
7-AAD和Annexin-V/PI染色显示USP35敲除促进HCC细胞凋亡。
Transwell实验显示USP35敲除减少HCC细胞迁移和侵袭。
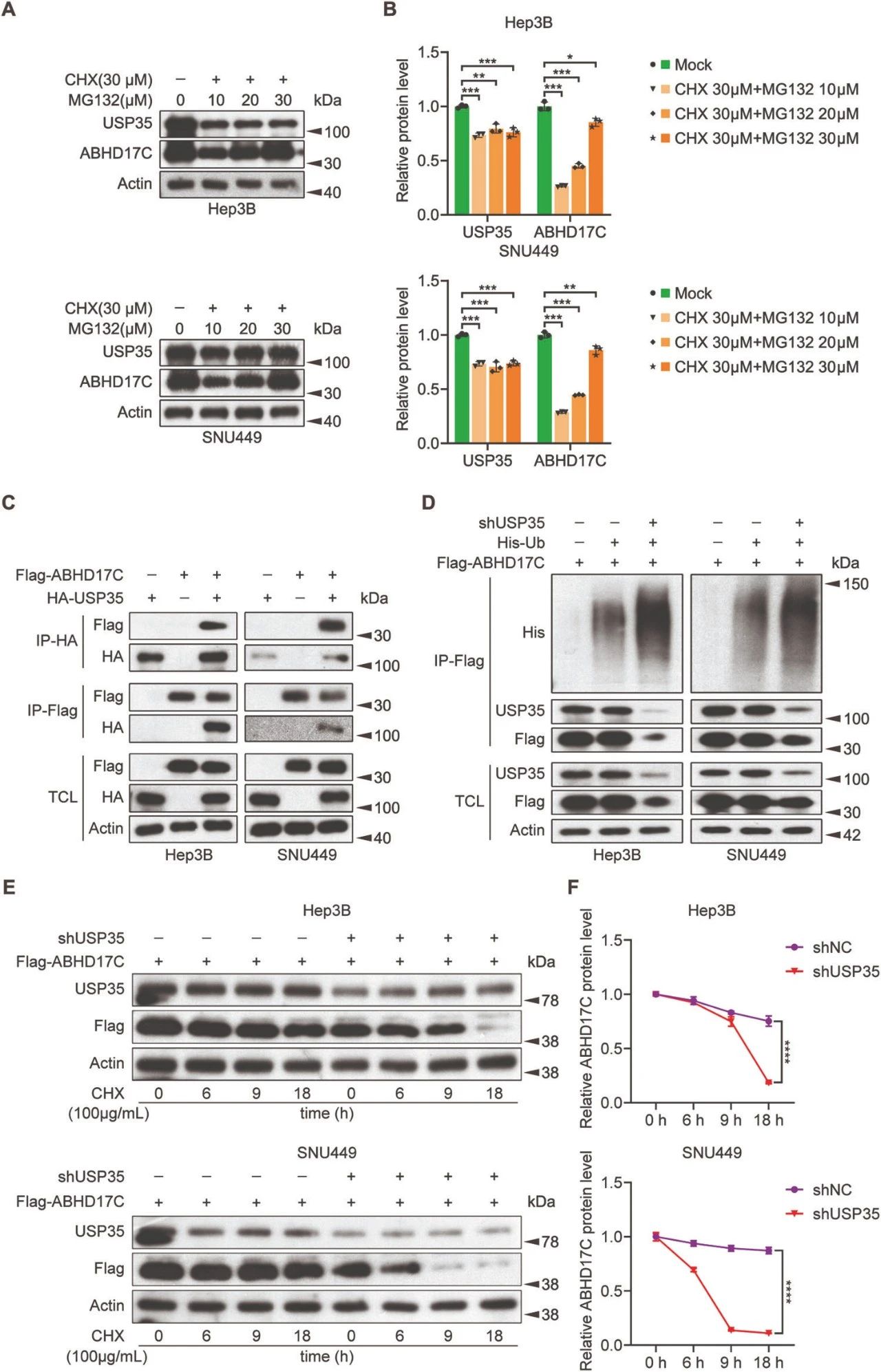
图4. USP35与ABHD17C相互作用并去泛素化
MG132处理稳定ABHD17C蛋白。
Co-IP显示USP35与ABHD17C相互作用。
免疫印迹显示USP35敲除增加ABHD17C泛素化,加快ABHD17C降解。
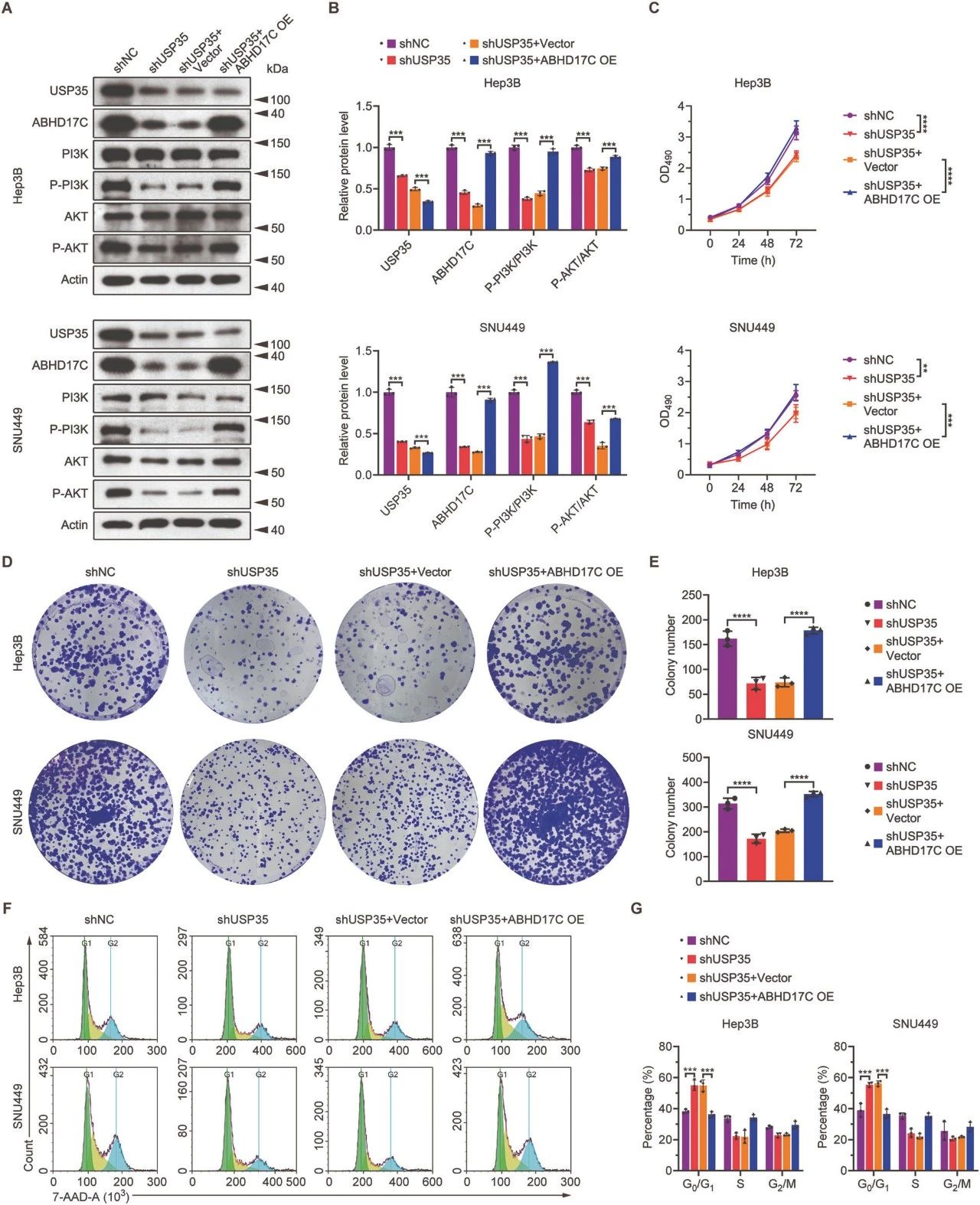
图5. ABHD17C过表达挽救了USP35缺乏的HCC细胞的增殖缺陷
A. 免疫印迹数据显示,在USP35缺乏的Hep3B和SNU449细胞中过表达ABHD17C,可以恢复p-PI3K和p-AKT的水平至对照组相当的水平。
B. A图的定量结果。
C. MTT实验结果显示,USP35缺乏的HCC细胞的增殖可以被过量的ABHD17C挽救。
D. 集落形成实验数据显示,USP35缺乏的HCC细胞的集落形成能力可以通过ABHD17C过表达得到挽救。
E. D图的定量结果。
F. 7-AAD染色实验显示,USP35缺乏引起的HCC细胞周期停滞可以通过ABHD17C过表达得到挽救。
G. F图的定量结果。
OE表示过表达。
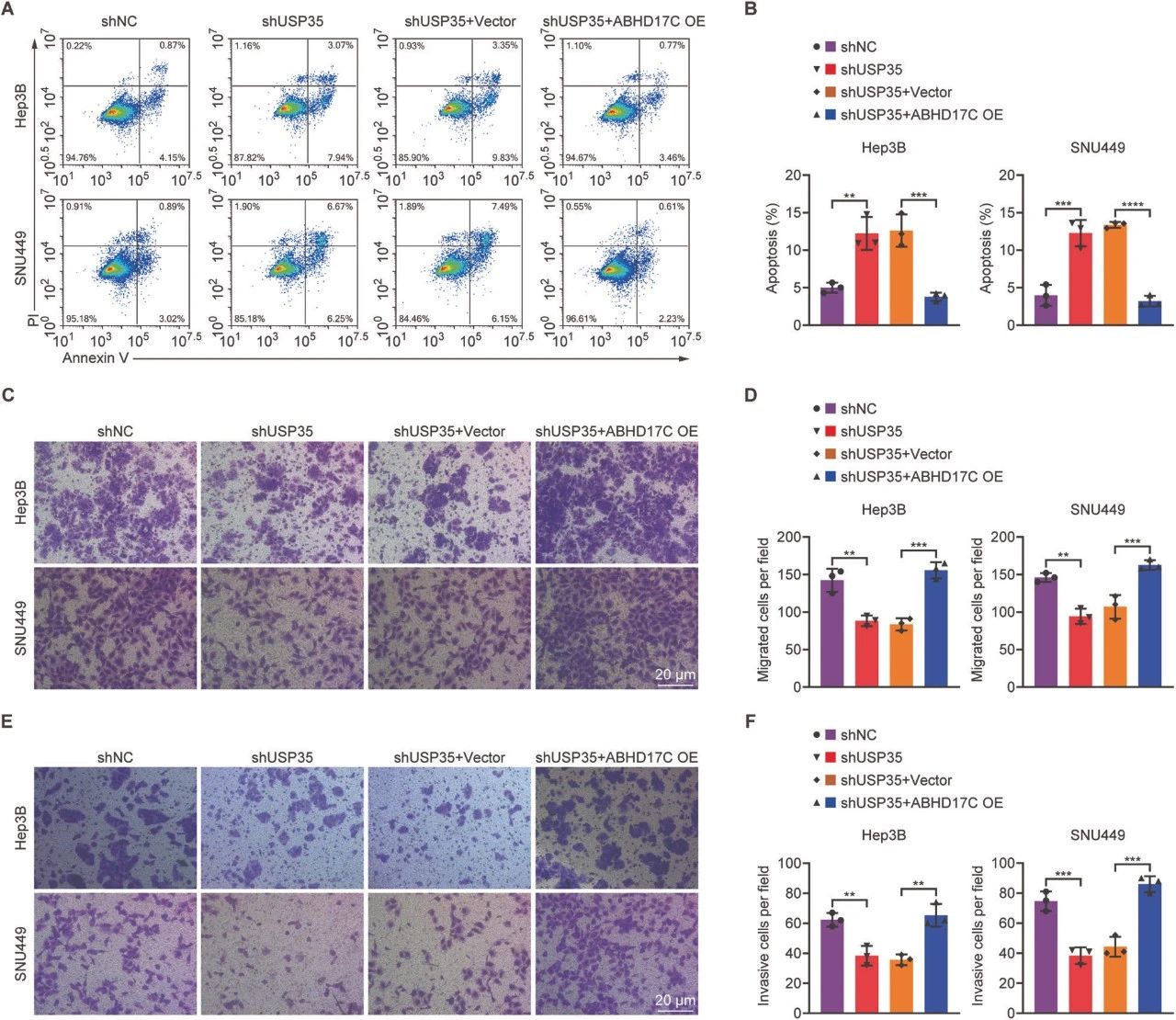
图6. ABHD17C过表达挽救了USP35缺乏的HCC细胞的凋亡、迁移和侵袭缺陷
A. Annexin-V/PI染色实验显示,USP35缺乏的HCC细胞增加的凋亡可以通过过量的ABHD17C减轻。
B. A图的定量结果。
C. Transwell实验结果显示,USP35缺乏的HCC细胞的迁移减弱可以通过ABHD17C过表达得到挽救。
D. C图的定量结果。
E. Transwell实验结果显示,USP35缺乏的HCC细胞的侵袭缺陷可以通过ABHD17C过表达得到挽救。
F. E图的定量结果。
OE表示过表达。
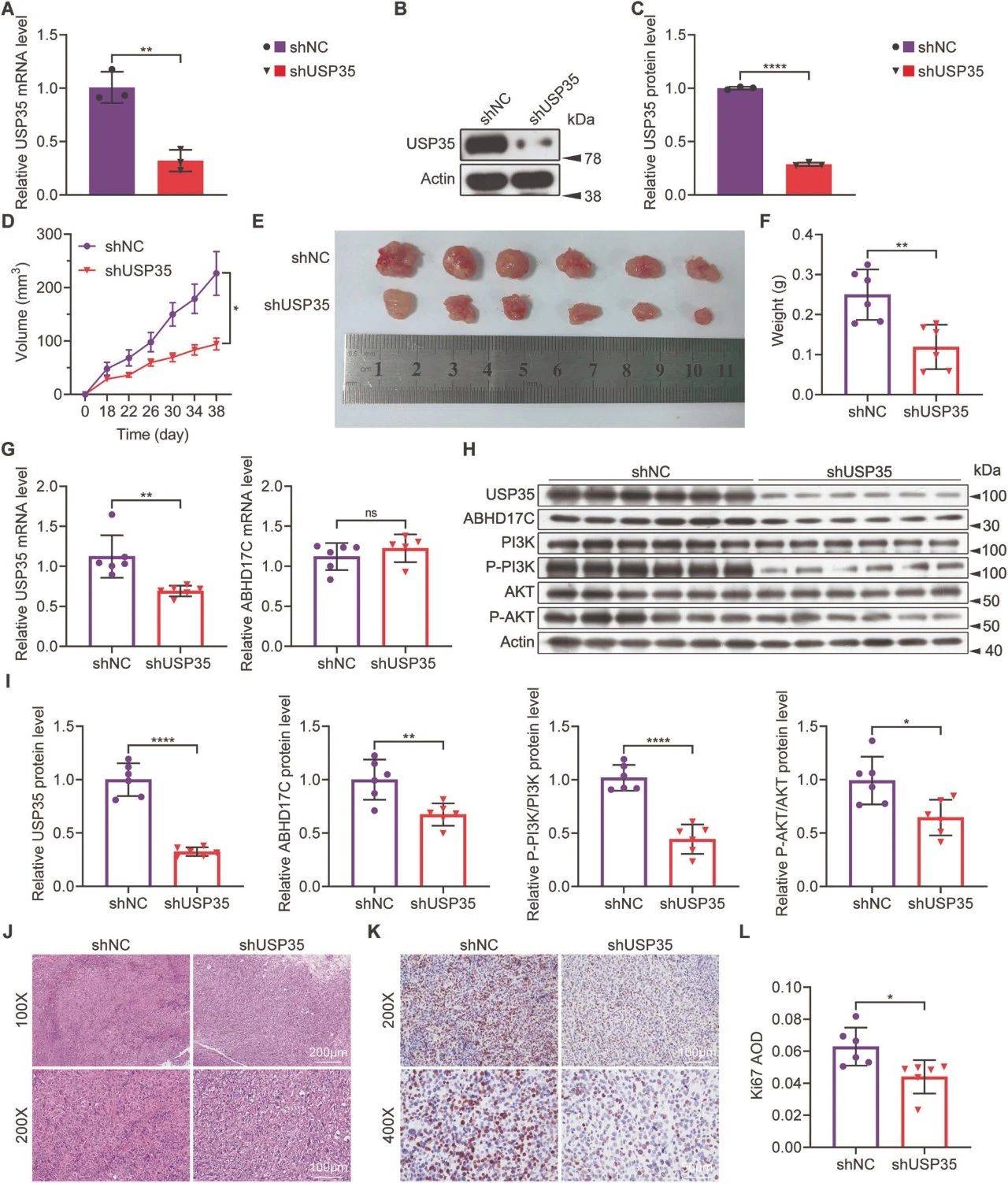
图7. USP35敲除抑制HCC移植瘤在体内的发展
A. qPCR结果确认,在稳定的Hep3B细胞中转染shUSP35后,USP35 mRNA表达有效敲除。
B. 免疫印迹结果显示,在USP35缺乏的稳定Hep3B细胞中,USP35表达显著减少。
C. B图的定量结果。
D. 肿瘤体积曲线显示,USP35敲除的HCC移植瘤生长受到抑制。
E. 终点时移植瘤的形态。
F. 终点时移植瘤重量的定量结果。
G. qPCR结果显示,与对照肿瘤相比,USP35敲除的HCC移植瘤中USP35 mRNA水平显著降低,而ABHD17C mRNA水平相当。
H. 免疫印迹数据显示,与对照肿瘤相比,USP35敲除的HCC移植瘤中USP35、ABHD17C、p-PI3K和p-AKT蛋白水平显著降低。
I. H图的定量结果。
J. H&E染色结果显示,USP35敲除的HCC移植瘤细胞密度较低。
K, L. IHC结果显示,Ki-67表达降低,表明USP35敲除的HCC移植瘤细胞增殖减少。
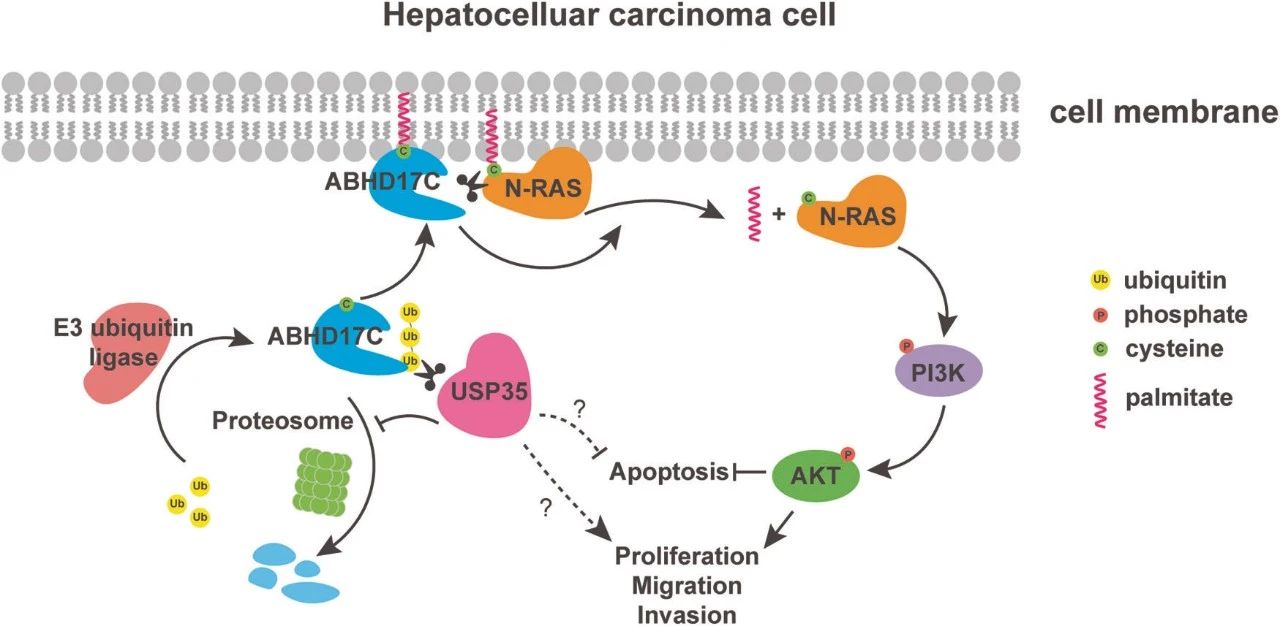
图8. USP35在调控HCC发展中的功能示意图
ABHD17C在细胞膜上去除N-RAS的棕榈酰化,释放N-RAS并促进N-RAS激活。
激活的N-RAS触发PI3K/AKT信号通路,促进HCC细胞的增殖、迁移和侵袭,但抑制凋亡。
ABHD17C被E3泛素连接酶泛素化,通过蛋白酶体介导的降解,这一过程被USP35逆转。
因此,ABHD17C被稳定化并持续促进N-RAS激活。
USP35是否通过其他机制(虚线)调控HCC发展需要进一步研究。
USP35稳定了HEK293T细胞中的ABHD17C,表明ABHD17C的稳定性受泛素系统的调控,尤其是USP35。
在人类HCC样本中,USP35和ABHD17C的表达水平上调,两者之间有显著的相关性,且与PI3K/AKT通路的激活相关。
USP35敲除导致HCC细胞增殖、细胞周期停滞、凋亡增加以及迁移和侵袭能力减弱。
USP35与HCC细胞中的ABHD17C相互作用并稳定其表达,通过调节其泛素化。
ABHD17C过表达可以挽救USP35敲除引起的HCC细胞缺陷,表明ABHD17C在USP35的致癌功能中起重要作用。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:环状RNA circ0007360通过改变miR-762/IRF7轴抑制胃癌进展