常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-03-17 09:00:00 细胞资源库平台 访问量:291
英文标题:Vascular mimicry induced by m6A mediated IGFL2-AS1/AR axis contributes to pazopanib resistance in clear cell renal cell carcinoma.
中文标题:m6A介导的IGFL2-AS1/AR轴诱导的血管拟态参与了肾透明细胞癌对帕唑帕尼的耐药
发表期刊:《Cell Death Discovery》
影响因子:7
作者单位:西南医科大学
作者信息:Bo Cheng,Mingyue Xie,Yong Zhou,Tian Li,Wanting Liu,Wenjing Yu,Man Jia,Shuang Yu,Lixuan Chen,Rongyang Dai (通讯作者),Ronghao Wang (通讯作者).
转移性透明细胞肾癌(ccRCC)是一种致命的肾癌亚型。血管拟态(VM)被认为是肿瘤获取营养的替代途径,在肿瘤发展中起着关键作用。然而,VM的发展是否与帕唑帕尼的疗效相关尚不清楚。
通过体外和体内模型,研究发现与敏感对照组相比,帕唑帕尼耐药的ccRCC中VM的发展显著增加,这是由于IGFL2-AS1/AR/TWIST1信号通路的激活。研究通过一系列实验方法,包括细胞培养、质粒构建、病毒包装、组织染色、VM形成测定、RNA免疫沉淀、原位杂交、细胞核分离、RNA提取和定量PCR、西方印迹分析、荧光素酶报告基因检测、共识聚类分析、免疫组化染色和体内研究等,探讨了IGFL2-AS1/AR轴在帕唑帕尼耐药ccRCC中的作用。
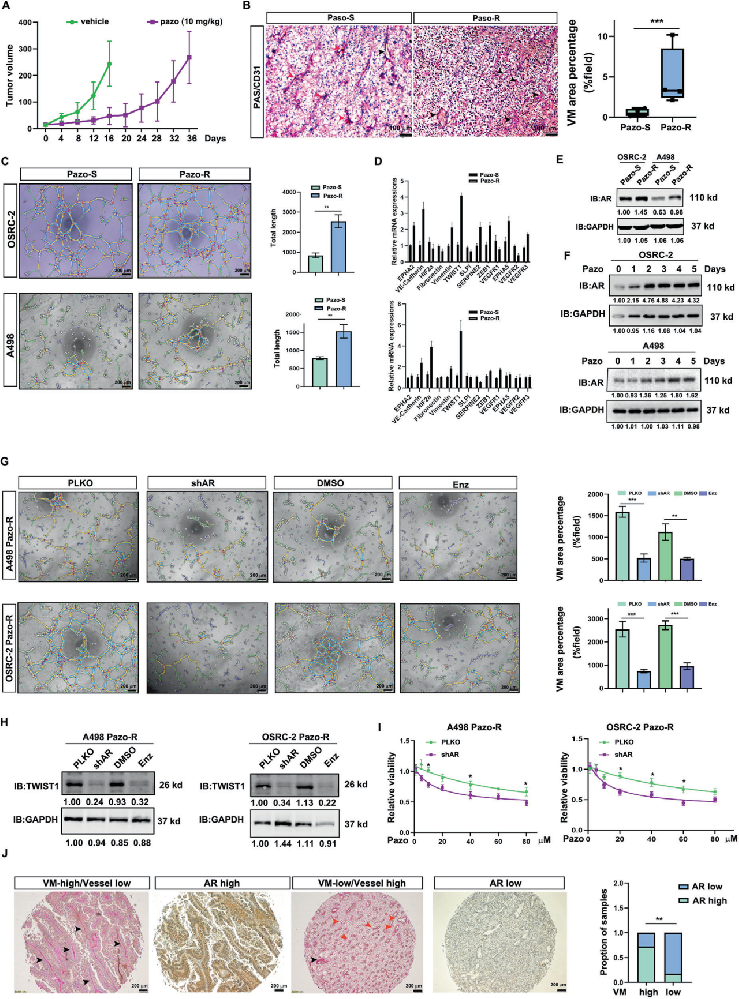
A. 肿瘤生长曲线:
帕唑帕尼或对照处理的小鼠肿瘤生长曲线。每两天腹腔注射10 mg/kg帕唑帕尼。
B. CD31/PAS染色:
帕唑帕尼或对照处理的肿瘤切片进行CD31/PAS染色。左侧为代表性图像,右侧为统计分析。红色箭头:血管;黑色箭头:肿瘤细胞的血管拟态。
C. 血管拟态形成实验:
OSRC-2和A498细胞在帕唑帕尼耐药前后进行血管拟态形成实验。左侧为代表性图像,右侧为统计分析。
D. QPCR检测:
QPCR检测显示OSRC-2和A498细胞在帕唑帕尼耐药前后血管拟态相关基因的表达模式。基因表达水平以GAPDH mRNA为对照进行标准化。
E. Western blotting分析:
Western blotting显示OSRC-2和A498细胞在帕唑帕尼耐药前后AR蛋白的表达水平。GAPDH作为加载对照。
F. 短暂帕唑帕尼处理:
短暂的帕唑帕尼处理也促进了OSRC-2和A498细胞中AR的表达。GAPDH作为内部对照。
G. AR抑制实验:
使用shRNAs或恩杂鲁胺抑制AR,可以抑制OSRC-2和A498帕唑帕尼耐药细胞的血管拟态发展。左侧为代表性图像,右侧为统计分析。
H. AR抑制对TWIST1表达的影响:
使用shRNAs或恩杂鲁胺抑制AR,可以降低OSRC-2和A498帕唑帕尼耐药细胞中TWIST1的表达。GAPDH作为加载对照。
I. AR敲低后的敏感性:
敲低AR可以使OSRC-2和A498帕唑帕尼耐药细胞重新对帕唑帕尼治疗敏感。
J. AR表达水平与血管拟态的关系:
高AR表达的ccRCC倾向于具有更多的血管拟态数量,而低AR表达的ccRCC则相反。
要点:
研究揭示了AR介导的血管拟态是ccRCC对帕唑帕尼耐药的机制之一。
通过多种实验方法,如染色、QPCR、Western blotting等,验证了AR在耐药细胞中的表达和功能。
抑制AR可以减缓耐药细胞的血管拟态发展,并恢复对帕唑帕尼的敏感性。
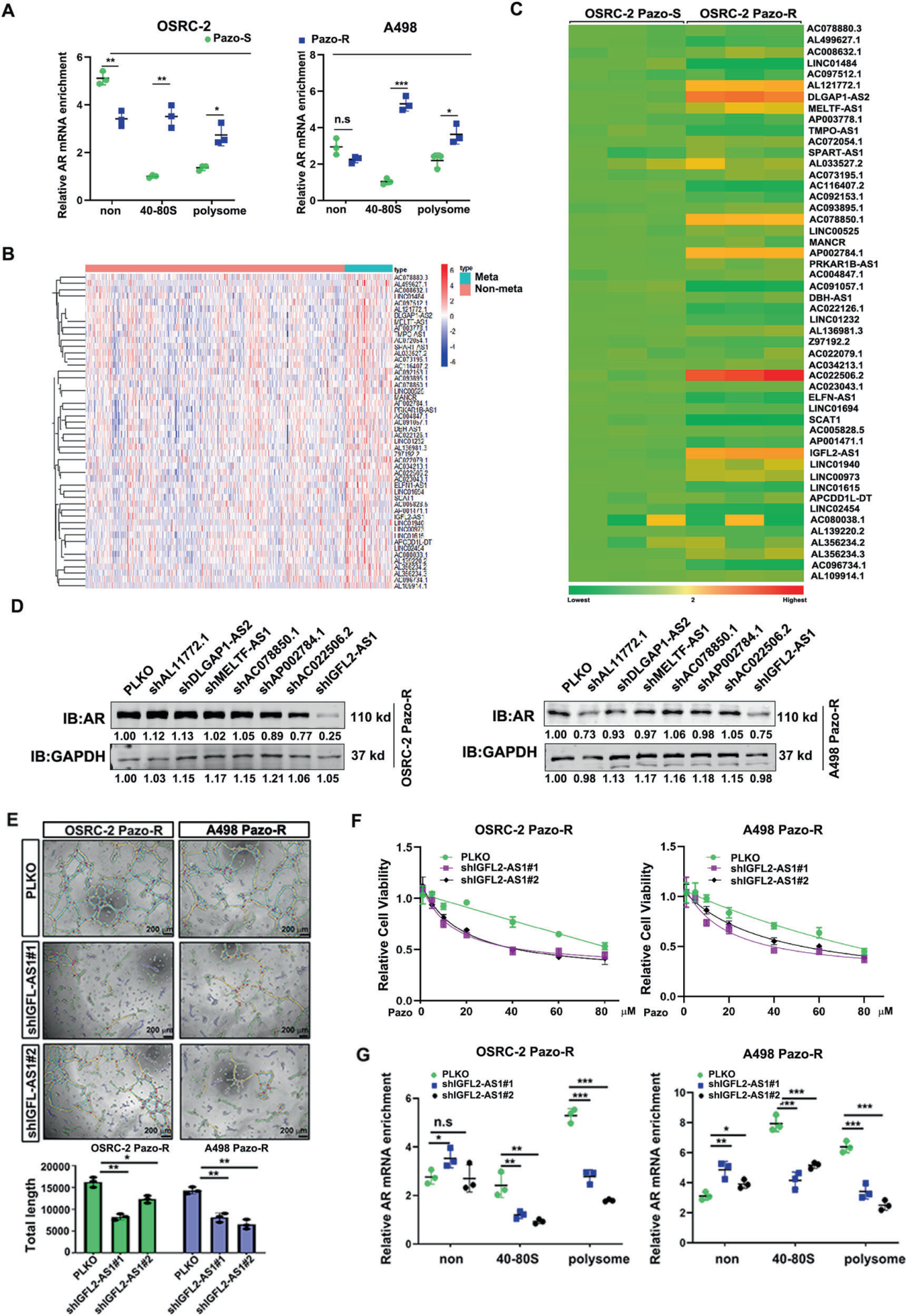
A. 核糖体分析:
使用多核糖体分析方法和随后的qPCR检测,研究了A498和OSRC-2细胞在帕唑帕尼耐药前后与核糖体结合的AR mRNA的富集情况。
B. 热图分析:
热图显示了在转移性ccRCC中高表达的50个长链非编码RNA(lncRNA)。
C. qPCR检测:
qPCR检测了OSRC-2细胞在帕唑帕尼敏感和耐药状态下这50个转移性lncRNA的表达水平。基因表达水平以GAPDH mRNA为对照进行标准化。
D. shRNA抑制实验:
在OSRC-2(左)和A498(右)帕唑帕尼耐药细胞中,通过shRNA抑制lncRNA候选基因后,检测了AR的表达水平。GAPDH作为加载对照。
E. IGFL2-AS1敲低实验:
敲低IGFL2-AS1可以抑制OSRC-2和A498帕唑帕尼耐药细胞的血管拟态发展。左侧为代表性图像,右侧为统计分析。
F. IGFL2-AS1敲低对帕唑帕尼敏感性的影响:
敲低IGFL2-AS1可以恢复OSRC-2和A498帕唑帕尼耐药细胞对帕唑帕尼的敏感性。
G. IGFL2-AS1敲低对核糖体结合的影响:
敲低IGFL2-AS1可以减少AR mRNA与核糖体的结合。
要点:
研究确定了IGFL2-AS1是帕唑帕尼耐药ccRCC细胞中AR的上游调控因子。
通过多核糖体分析,发现AR mRNA在耐药细胞中与核糖体的结合增加。
热图分析揭示了转移性ccRCC中高表达的lncRNA。
敲低IGFL2-AS1可以抑制耐药细胞的血管拟态,并恢复其对帕唑帕尼的敏感性。
IGFL2-AS1敲低减少了AR mRNA与核糖体的结合,表明IGFL2-AS1可能通过调节AR的翻译来发挥作用。
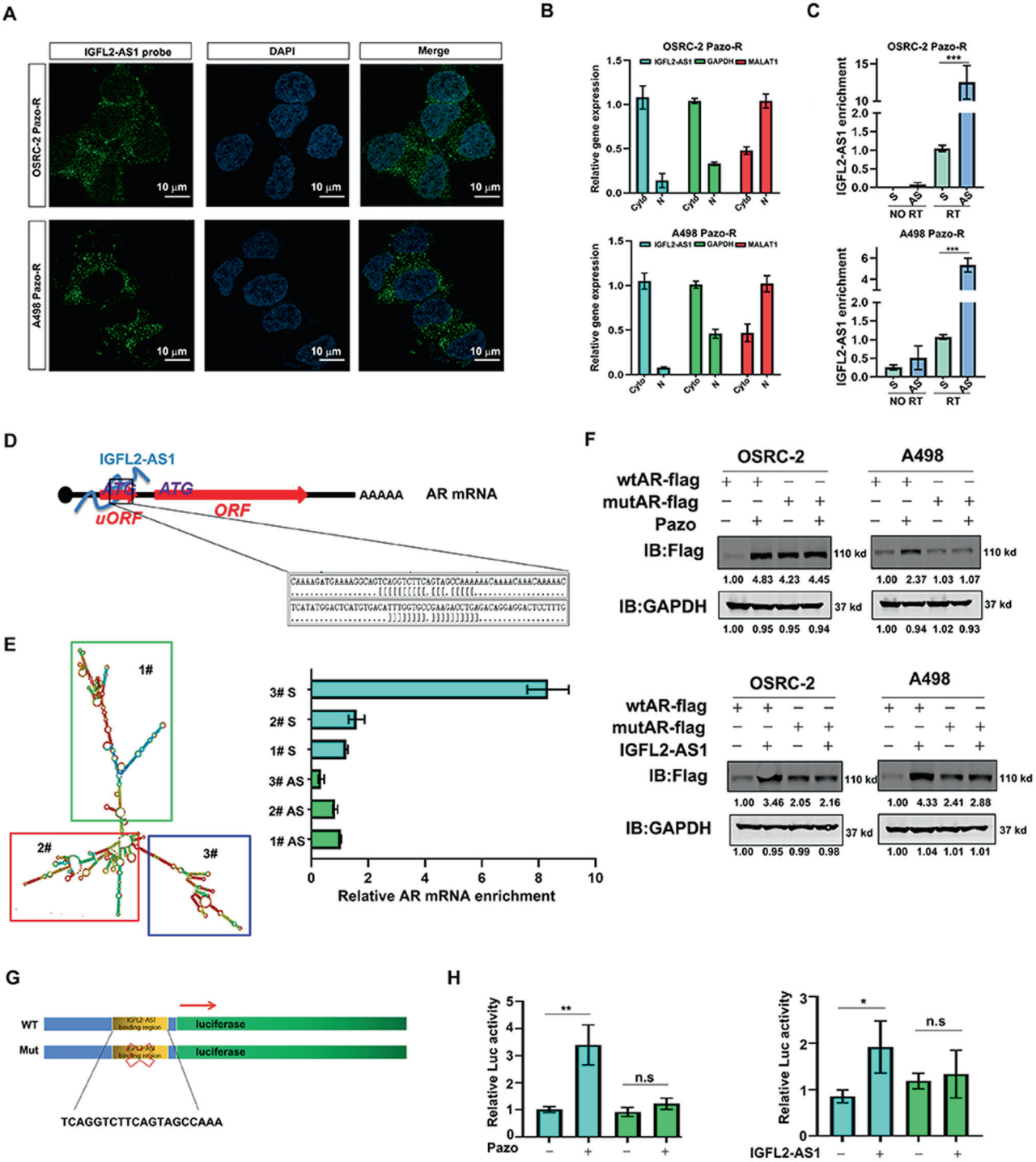
A. IGFL2-AS1的FISH染色:
在帕唑帕尼耐药的ccRCC细胞中进行了IGFL2-AS1的荧光原位杂交(FISH)染色。
B. 细胞质-细胞核分离:
通过细胞质-细胞核分离实验来识别IGFL2-AS1的位置。细胞质RNA以GAPDH为标记;细胞核RNA以MALAT1为标记。
C. RNA免疫沉淀(RNA IP):
使用针对AR mRNA的4个反义探针进行RNA IP,以检测IGFL2-AS1的富集。AS表示反义探针;S表示正义探针。
D. IGFL2-AS1与AR mRNA的相互作用:
插图显示了IGFL2-AS1与AR mRNA的相互作用。
E. RNA结构分析:
左侧:使用RNAfold Webserver预测的IGFL2-AS1的RNA结构。右侧:截断映射显示含有AR结合位点的片段3#与AR mRNA相互作用。
F. 帕唑帕尼处理对AR表达的影响:
帕唑帕尼处理增加了OSRC-2和A498细胞中具有野生型5'-UTR的AR的表达,但未增加具有ATG缺失的5'-UTR的AR的表达。IGFL2-AS1增强了具有野生型5'-UTR的AR的表达,但未增强具有ATG缺失的5'-UTR的AR的表达。GAPDH作为内参。
G. 构建AR 5'-UTR启动子报告基因:
插图显示了野生型和突变型AR 5'-UTR携带的荧光素酶报告基因构建过程。
H. 帕唑帕尼和IGFL2-AS1对AR 5'-UTR活性的影响:
帕唑帕尼和IGFL2-AS1增强了OSRC-2细胞中野生型AR 5'-UTR携带的荧光素酶的活性,但未增强突变型AR 5'-UTR的活性。
要点:
研究表明IGFL2-AS1调节AR mRNA的上游开放阅读框(uORF)活性,并促进其翻译。
IGFL2-AS1位于细胞核中,并通过与AR mRNA相互作用来调节AR的表达。
IGFL2-AS1通过增强具有野生型5'-UTR的AR的表达来促进AR的翻译。
帕唑帕尼和IGFL2-AS1协同作用于野生型AR 5'-UTR,提高了活性。
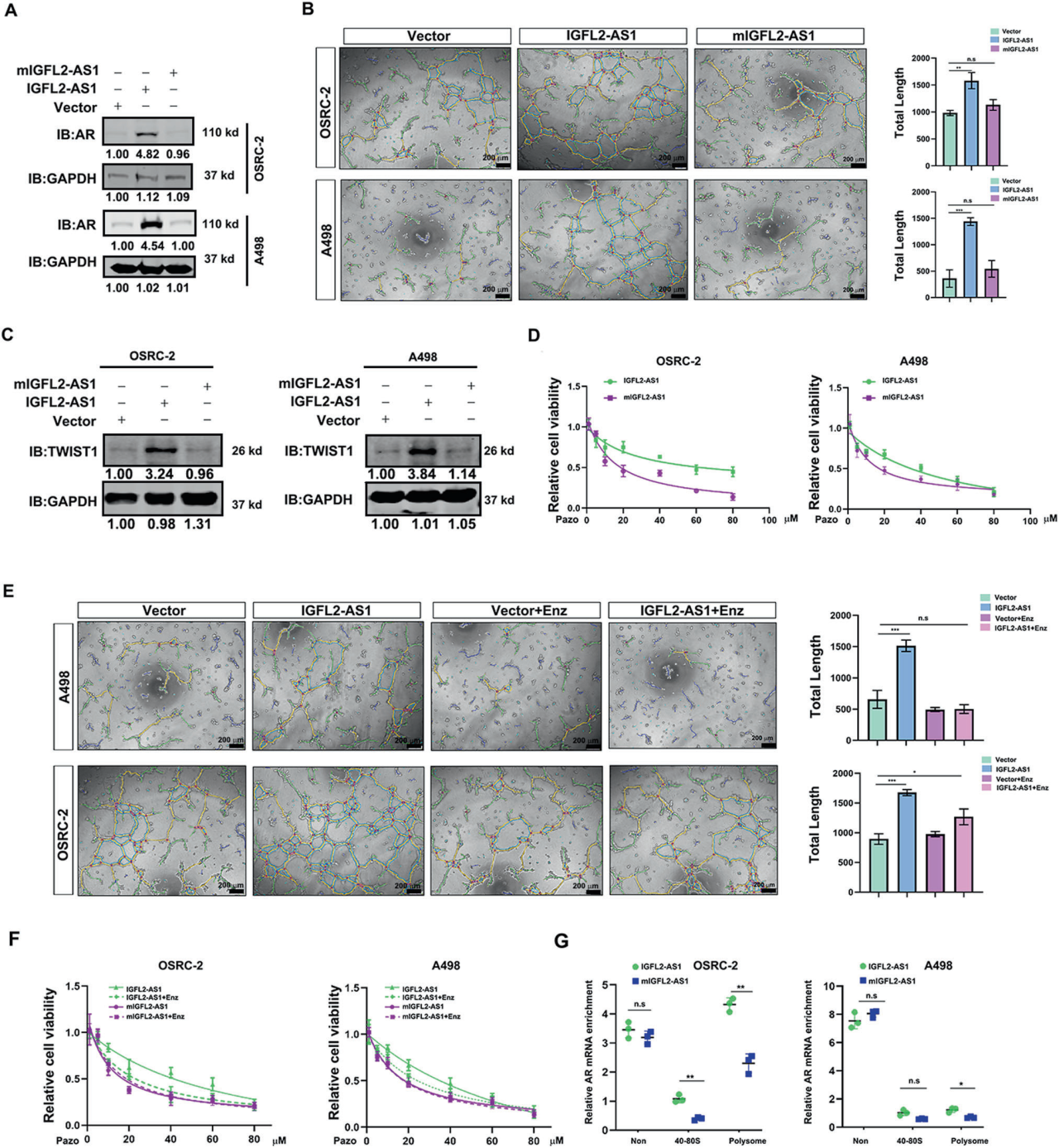
A. IGFL2-AS1对ccRCC血管拟态形成和帕唑帕尼耐药的贡献:
野生型IGFL2-AS1,而不是突变型,在A498和OSRC-2细胞中增加了AR的表达。GAPDH作为正常化对照。
B. 野生型IGFL2-AS1对A498和OSRC-2细胞VM形成的影响:
野生型IGFL2-AS1,而不是突变型,增加了A498和OSRC-2细胞的血管拟态发展。左侧为代表性图像;右侧为统计分析。标尺:200 μm。
C. 野生型IGFL2-AS1对TWIST1表达的影响:
野生型IGFL2-AS1,而不是突变型,在A498和OSRC-2细胞中增加了TWIST1的表达。GAPDH作为加载对照。
D. 野生型IGFL2-AS1促进帕唑帕尼耐药的能力:
野生型IGFL2-AS1比突变型具有更强的能力促进A498和OSRC-2细胞的帕唑帕尼耐药性。
E. 恩杂鲁胺对IGFL2-AS1诱导的VM形成的影响:
恩杂鲁胺处理减轻了IGFL2-AS1在A498和OSRC-2细胞中诱导的血管拟态发展。左侧为代表性图像;右侧为统计分析。标尺:200 μm。
F. 恩杂鲁胺对IGFL2-AS1诱导的帕唑帕尼耐药性的影响:
恩杂鲁胺处理消除了IGFL2-AS1诱导的ccRCC细胞的帕唑帕尼耐药性。
G. 野生型IGFL2-AS1促进AR翻译的能力:
使用多核糖体分析(polysome profiling)法监测,野生型IGFL2-AS1比突变型具有更强的能力促进AR的翻译。
要点:
IGFL2-AS1的结合对于ccRCC血管拟态形成和帕唑帕尼耐药性是必需的。
野生型IGFL2-AS1能够增加AR和TWIST1的表达,促进血管拟态的发展,并增强帕唑帕尼耐药性。
恩杂鲁胺可以减轻IGFL2-AS1诱导的血管拟态发展和帕唑帕尼耐药性。
野生型IGFL2-AS1在促进AR翻译方面比突变型更有效。
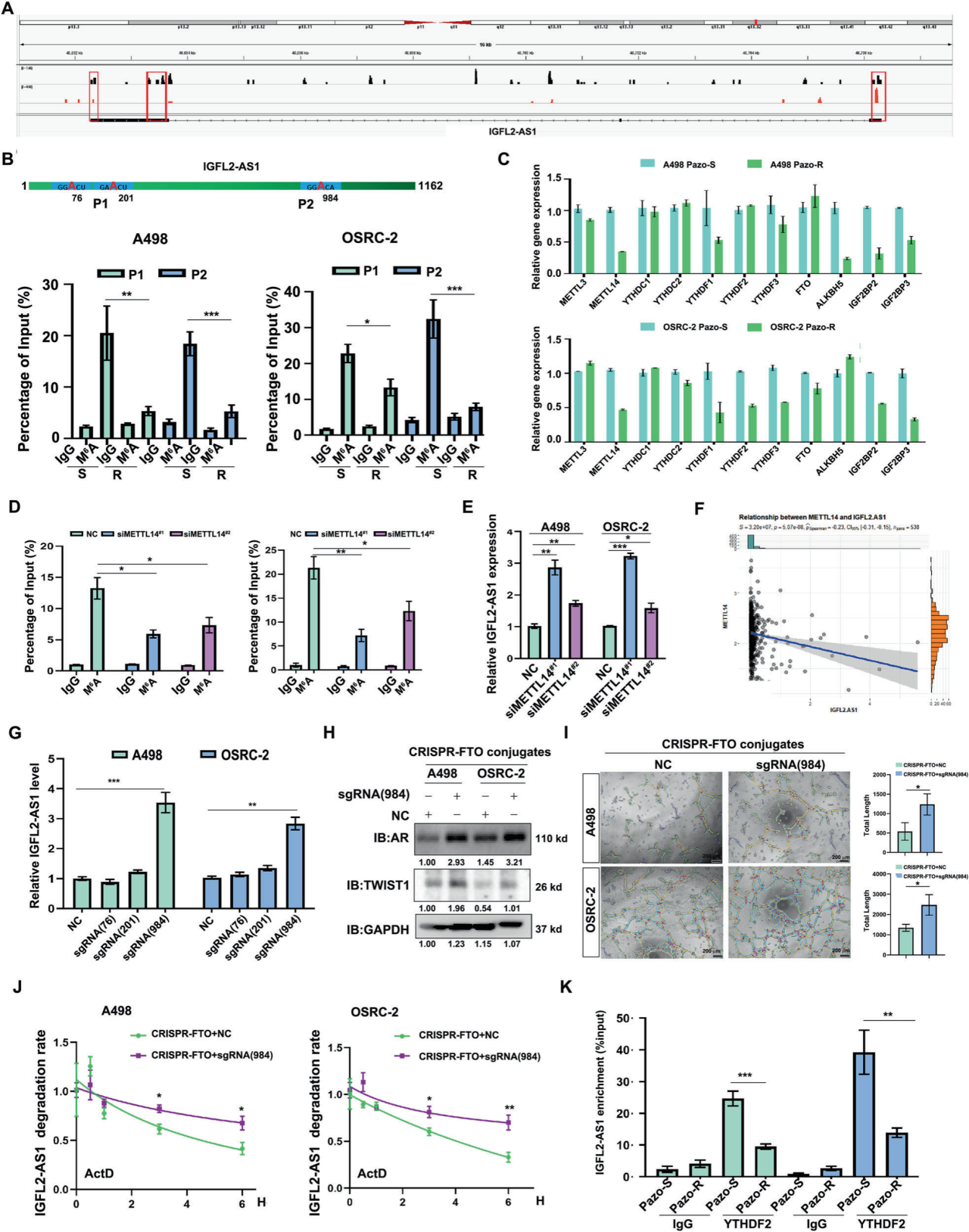
A. IGFL2-AS1的m6A修饰:
pazopanib处理导致IGFL2-AS1的m6A修饰去甲基化,并由YTHDF2释放而稳定。
分析根据GSE161304 miCLIP数据集对IGFL2-AS1的m6A峰进行分析。红色框表示m6A峰。
B. m6A水平比较:
SRAMP预测的高置信度m6A位点。底部,m6A RIP揭示了帕唑帕尼敏感和耐药的ccRCC细胞中IGFL2-AS1的m6A水平差异。P1、P2是检测IGFL2-AS1指定区域的引物对。
C. m6A调节剂的表达水平:
帕唑帕尼敏感和耐药的ccRCC细胞中m6A调节剂的mRNA表达水平。RNA水平以GAPDH mRNA为对照进行标准化。
D. METTL14敲低:
使用两种独立的siRNA敲低METTL14,降低了A498和OSRC-2细胞中IGFL2-AS1的m6A水平。
E. METTL14敲低对IGFL2-AS1表达的影响:
使用两种独立的siRNA敲低METTL14,增加了A498和OSRC-2细胞中IGFL2-AS1的表达。GAPDH mRNA作为内参。
F. METTL14与IGFL2-AS1的关系:
METTL14在TCGA-KIRC中与IGFL2-AS1呈负相关。
G. dCas9 CRISPR-FTO系统:
dCas9 CRISPR-FTO结合sgRNA靶向IGFL2-AS1的A984相邻区域,显著增加了A498和OSRC-2细胞中IGFL2-AS1的表达。RNA水平以GAPDH mRNA为对照进行标准化。
H. dCas9 CRISPR-FTO系统对AR和TWIST1表达的影响:
dCas9 CRISPR-FTO结合sgRNA靶向IGFL2-AS1的A984相邻区域,增强了A498和OSRC-2细胞中AR和TWIST1的表达。GAPDH作为加载对照。
I. dCas9 CRISPR-FTO系统对VM形成的影响:
dCas9 CRISPR-FTO结合sgRNA靶向IGFL2-AS1的A984相邻区域,促进了A498和OSRC-2细胞的血管拟态(VM)发展。左侧为代表性VM图像;右侧为VM的统计分析。标尺:200 μm。
J. dCas9 CRISPR-FTO系统对IGFL2-AS1稳定性的影响:
dCas9 CRISPR-FTO结合sgRNA靶向IGFL2-AS1的A984相邻区域,增加了IGFL2-AS1的稳定性。使用5 μM ActD。
K. dCas9 CRISPR-FTO系统与YTHDF2的结合:
dCas9 CRISPR-FTO结合sgRNA靶向IGFL2-AS1的A984相邻区域,将其从YTHDF2的结合位点解离。
要点:
pazopanib处理导致IGFL2-AS1的m6A修饰去甲基化和稳定化。
METTL14的敲低降低了IGFL2-AS1的m6A水平并增加了其表达。
dCas9 CRISPR-FTO系统通过靶向IGFL2-AS1的A984相邻区域增强了其表达,促进了AR和TWIST1的表达,促进了血管拟态的发展,并增加了IGFL2-AS1的稳定性,同时解离了其与YTHDF2的结合。
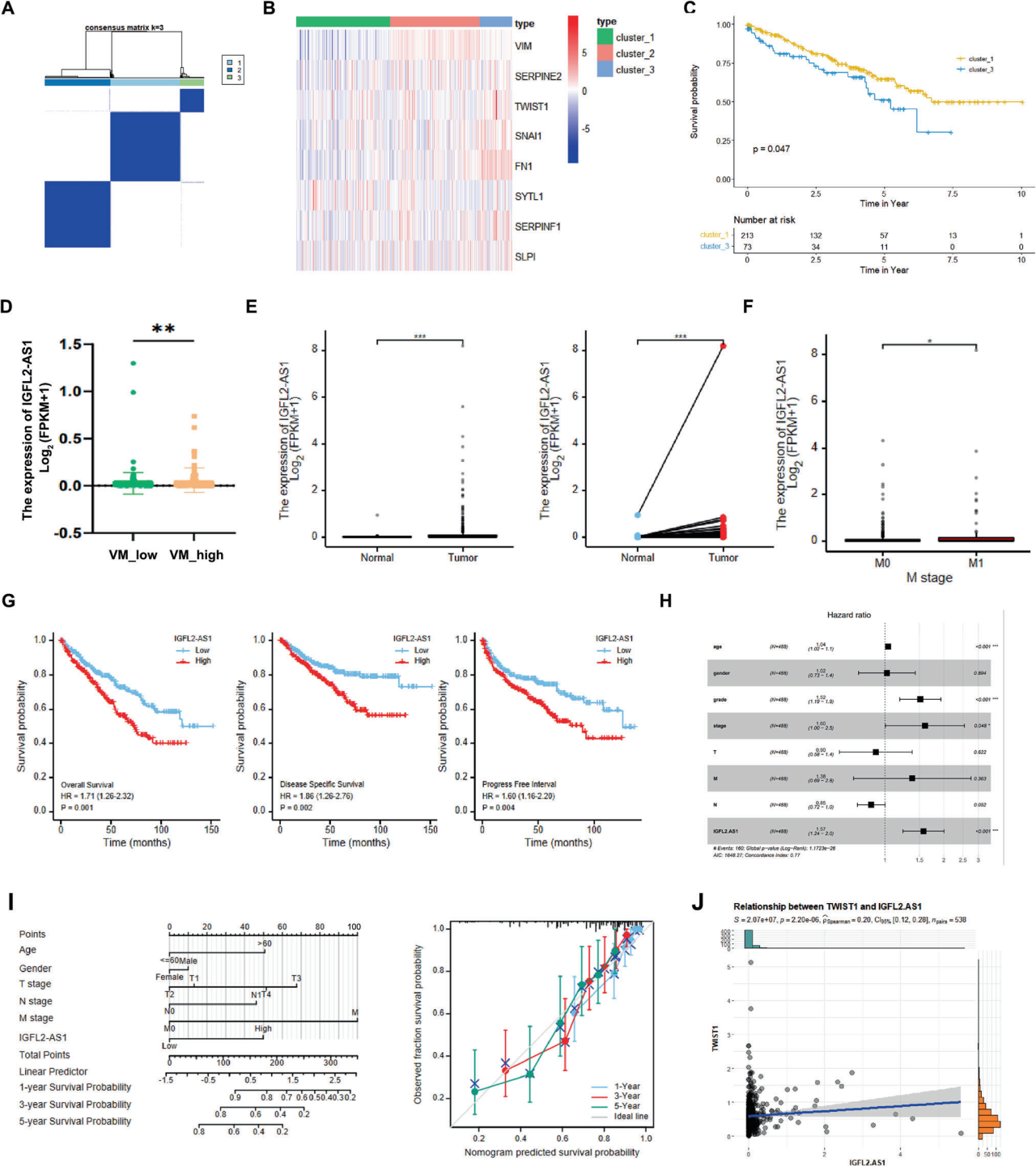
A. 一致性矩阵:
当k=3时,一致性矩阵显示三个聚类。
B. VM相关基因的表达模式热图:
热图展示了个体聚类中VM相关基因的表达模式。
C. 生存时间分析:
VM_high(聚类3)的患者比VM_low(聚类1)的患者生存时间更短。
D. IGFL2-AS1在ccRCC中的表达:
在VM_high亚型的ccRCC中,IGFL2-AS1过表达。
E. IGFL2-AS1在ccRCC和正常肾脏组织中的表达水平:
与正常肾脏组织相比,ccRCC中IGFL2-AS1的表达水平明显更高。
F. IGFL2-AS1在远处转移ccRCC中的表达:
与局部控制的ccRCC相比,远处转移的ccRCC中IGFL2-AS1的表达更高。
G. 生存分析:
Kaplan-Meier生存分析显示,IGFL2-AS1水平高的ccRCC患者比IGFL2-AS1水平低的患者总体生存期(OS)、无病生存期(DSS)和无进展间隔(PFI)更差。
H. 多因素Cox回归分析:
多因素Cox回归分析年龄、性别、TNM、T期、分级和IGFL2-AS1的影响。
I. IGFL2-AS1为基础的诺模图预测模型:
基于IGFL2-AS1的诺模图预测模型。
J. IGFL2-AS1和VM基因TWIST1的表达相关性:
在TCGA-KIRC中,IGFL2-AS1和VM基因TWIST1的表达水平高度相关。
要点:
IGFL2-AS1在ccRCC中过表达,与血管拟态(VM)的形成相关,并且表达水平高的患者预后较差。
IGFL2-AS1的表达与患者的生存期、肿瘤进展和远处转移相关。
IGFL2-AS1可以作为ccRCC患者预后的独立预测因子,并可能用于构建预测模型。
IGFL2-AS1与VM相关基因TWIST1的表达水平高度相关。
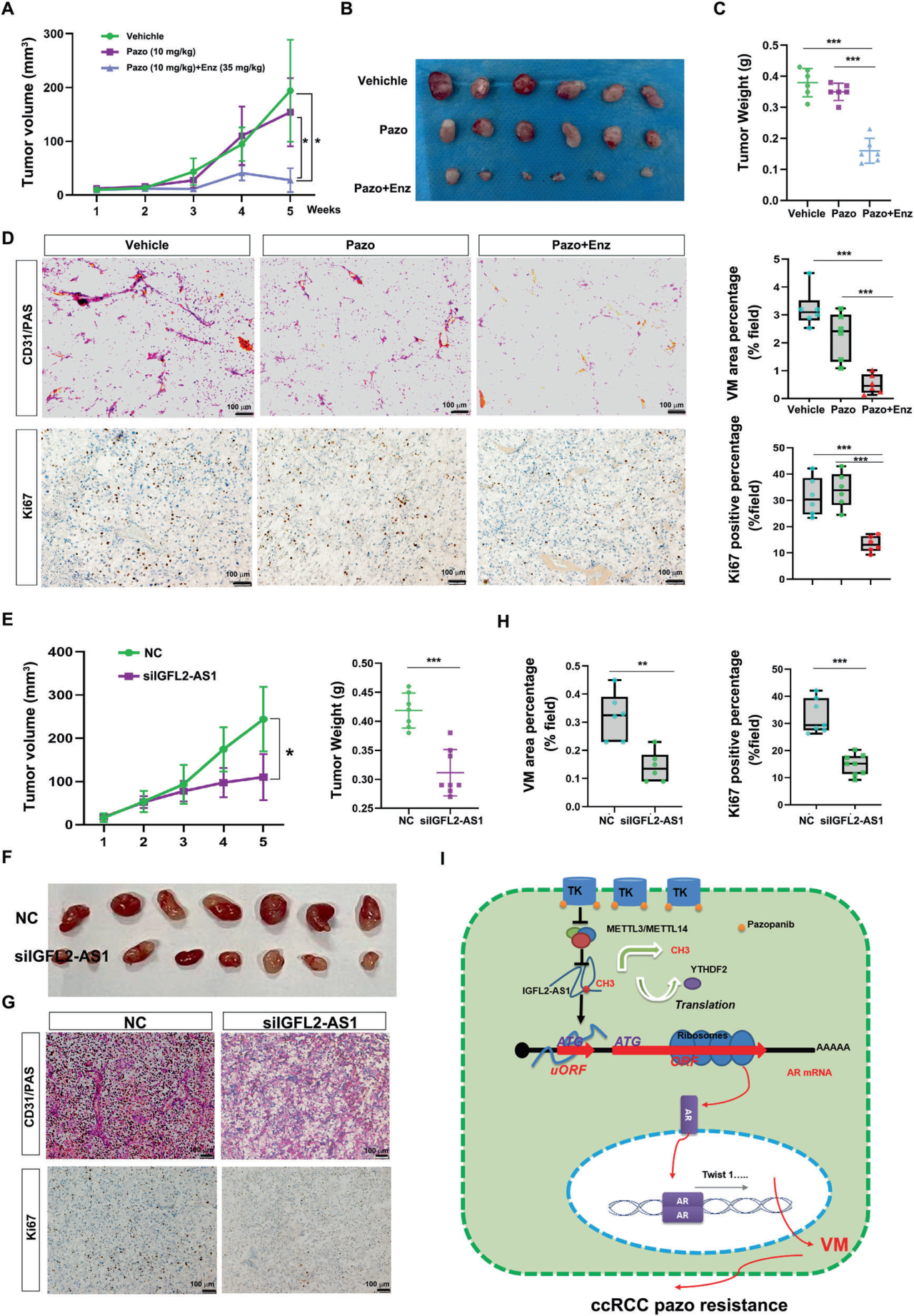
A. 肿瘤生长曲线:
接受指定治疗的帕唑帕尼耐药OSRC-2肿瘤的生长曲线。每两天腹腔注射10 mg/kg帕唑帕尼和35 mg/kg恩杂鲁胺。
B. 肿瘤图像:
从接受治疗的牺牲小鼠中获取的肿瘤图像。
C. 肿瘤重量:
接受治疗的牺牲小鼠的肿瘤重量。
D. CD31/PAS和Ki67染色分析:
指定肿瘤切片的CD31/PAS和Ki67染色分析。左侧为代表性图像;右侧为统计分析。标尺:100 μm。
E. 肿瘤生长曲线和肿瘤重量:
接受siNC(8 mg/kg)或siIGFL2-AS1(8 mg/kg)处理的帕唑帕尼耐药OSRC-2肿瘤的生长曲线(左)和肿瘤重量(右)。
F. 肿瘤图像:
接受siNC或siIGFL2-AS1处理的牺牲小鼠的肿瘤图像。
G. CD31/PAS和Ki67染色分析:
siNC或siIGFL2-AS1处理的肿瘤切片的CD31/PAS和Ki67染色分析。标尺:100 μm。
H. 统计分析:
G中CD31/PAS和Ki67染色分析的统计分析。
I. m6A介导的IGFL2-AS1/AR轴如何控制ccRCC中的VM发展和帕唑帕尼耐药性的示意图:
描述m6A介导的IGFL2-AS1/AR轴如何控制ccRCC中的血管拟态(VM)发展和帕唑帕尼耐药性的示意图。
要点:
研究评估了使用恩杂鲁胺或siRNA靶向IGFL2-AS1来抑制帕唑帕尼耐药的ccRCC进展。
使用恩杂鲁胺和siIGFL2-AS1处理可以抑制帕唑帕尼耐药的OSRC-2肿瘤的生长。
肿瘤的血管生成和增殖减少,这表明了治疗的疗效。
图中的示意图说明了m6A修饰如何通过IGFL2-AS1/AR轴影响ccRCC的VM发展和耐药性。
这些结果支持了在临床前研究中使用恩杂鲁胺或siRNA靶向IGFL2-AS1作为ccRCC治疗策略。
IGFL2-AS1是一种带有m6A修饰的长编码RNA。
IGFL2-AS1通过METTL3/METTL14复合体去甲基化。
在慢性帕唑帕尼治疗过程中,由于YTHDF2的识别失败,IGFL2-AS1变得稳定。
IGFL2-AS1与雄激素受体(AR)mRNA的5'-UTR区域物理相互作用。
IGFL2-AS1中和了5'-uORF对AR翻译的负向调控。
使用恩杂鲁胺抑制AR活性或使用siRNA沉默IGFL2-AS1,都导致了帕唑帕尼耐药的透明细胞肾细胞癌(ccRCC)肿瘤生长的减缓。
体内异种移植小鼠模型验证了上述实验结果。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:HBV细胞感染模型丨筛选易感HBV的HepG2-NTCP细胞亚型
下一篇:gHgL-gp42复合物上的非重叠表位用于合理设计抗EBV感染的三抗体组合