常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-03-16 09:00:00 细胞资源库平台 访问量:335
英文标题:Overcoming the compensatory increase in NRF2 induced by NPL4 inhibition enhances disulfiram/copper-induced oxidative stress and ferroptosis in renal cell carcinoma.
中文标题:克服NPL4抑制引起的NRF2代偿性增加可增强双硫仑/铜诱导的肾癌氧化应激和铁死亡
发表期刊:《European Journal of Pharmacology》
影响因子:5
作者单位:武汉大学人民医院泌尿外科、武汉大学泌尿系疾病研究所等
作者信息:Xinmiao Ni, Chenglin Ye, Xi Yu (共同第一作者),Ye Zhang, Yanguang Hou, Qingyuan Zheng, Zhiyuan Chen, Lei Wang, Xiaodong Weng (通讯作者),Chuan Yang, Xiuheng Liu (共同通讯作者).
肾细胞癌(RCC)是最常见的肾癌类型,对铁死亡高度敏感。二硫化物(Disulfiram, DSF)是一种治疗酗酒的药物,已被多项研究显示具有抗癌特性,包括对RCC的作用。然而,DSF/铜对RCC的抗癌作用机制尚不清楚。
使用RCC细胞和小鼠皮下肿瘤模型研究DSF/铜对RCC治疗的影响。通过CCK-8细胞活力测定、集落形成实验、Transwell迁移实验、透射电子显微镜(TEM)、线粒体膜电位(MMP)测定、活性氧种(ROS)测定、脂质过氧化检测等方法评估DSF/铜对RCC细胞的影响。通过实时定量聚合酶链反应(RT-qPCR)、蛋白质提取和西方印迹分析等方法研究DSF/铜对NRF2和NPL4表达的影响。在小鼠异种移植模型中评估DSF/铜与索拉非尼(sorafenib)联合治疗的效果。
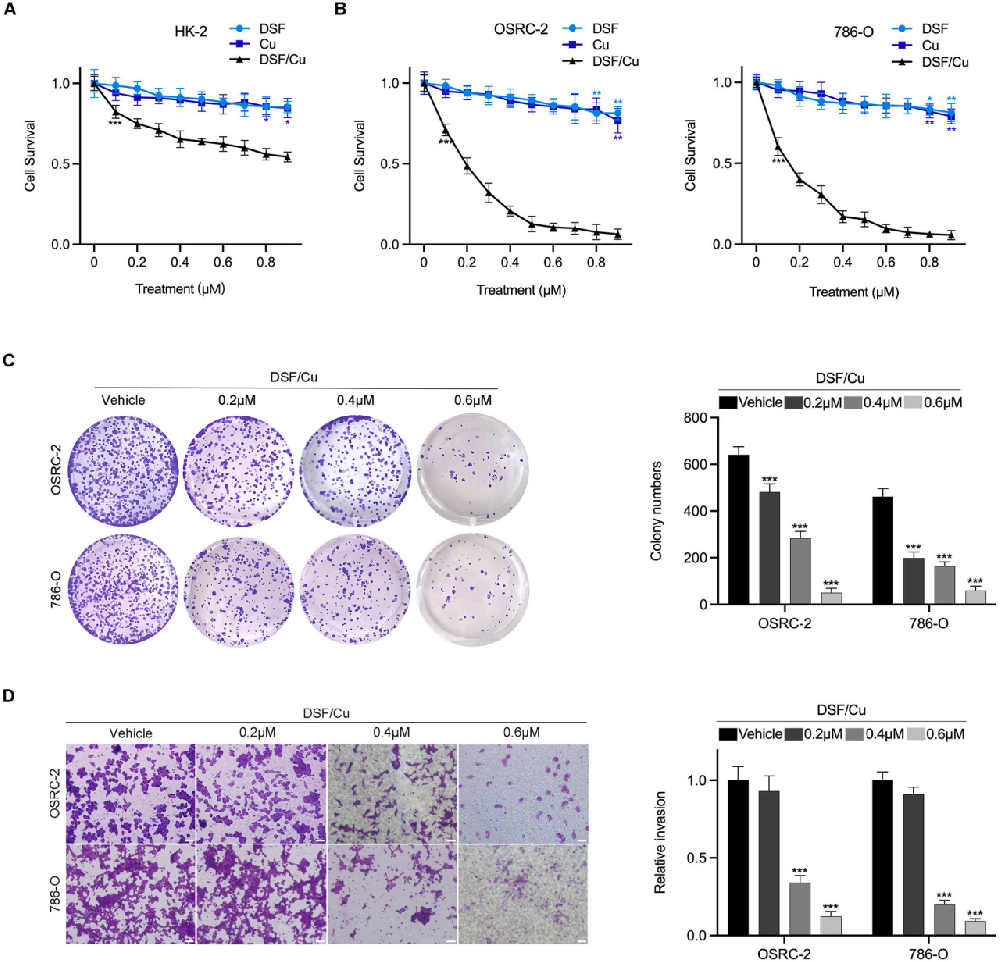
细胞活性的抑制:
图1A、1B展示了使用CCK-8法检测HK-2细胞和RCC细胞在经过不同浓度的DSF、Cu以及DSF/Cu处理24小时后的细胞活性。结果显示DSF/Cu抑制了细胞的活性。
菌落形成的抑制:
图1C展示了RCC细胞在经过不同浓度的DSF/Cu处理7天后的菌落形成情况及其定量柱状图。这说明DSF/Cu处理显著抑制了RCC细胞的菌落形成。
图1D展示了通过Transwell试验检测RCC细胞在经过不同浓度的DSF/Cu处理72小时后的侵袭能力及其定量柱状图(×200,标尺=50μm)。结果指出DSF/Cu显著降低了RCC细胞的侵袭能力。
侵袭能力的抑制:
要点:
DSF/Cu抑制了RCC细胞的活性、侵袭和迁移能力。
DSF/Cu对RCC细胞的菌落形成具有明显的抑制作用。
统计分析显示DSF/Cu处理在统计学上具有显著效果。
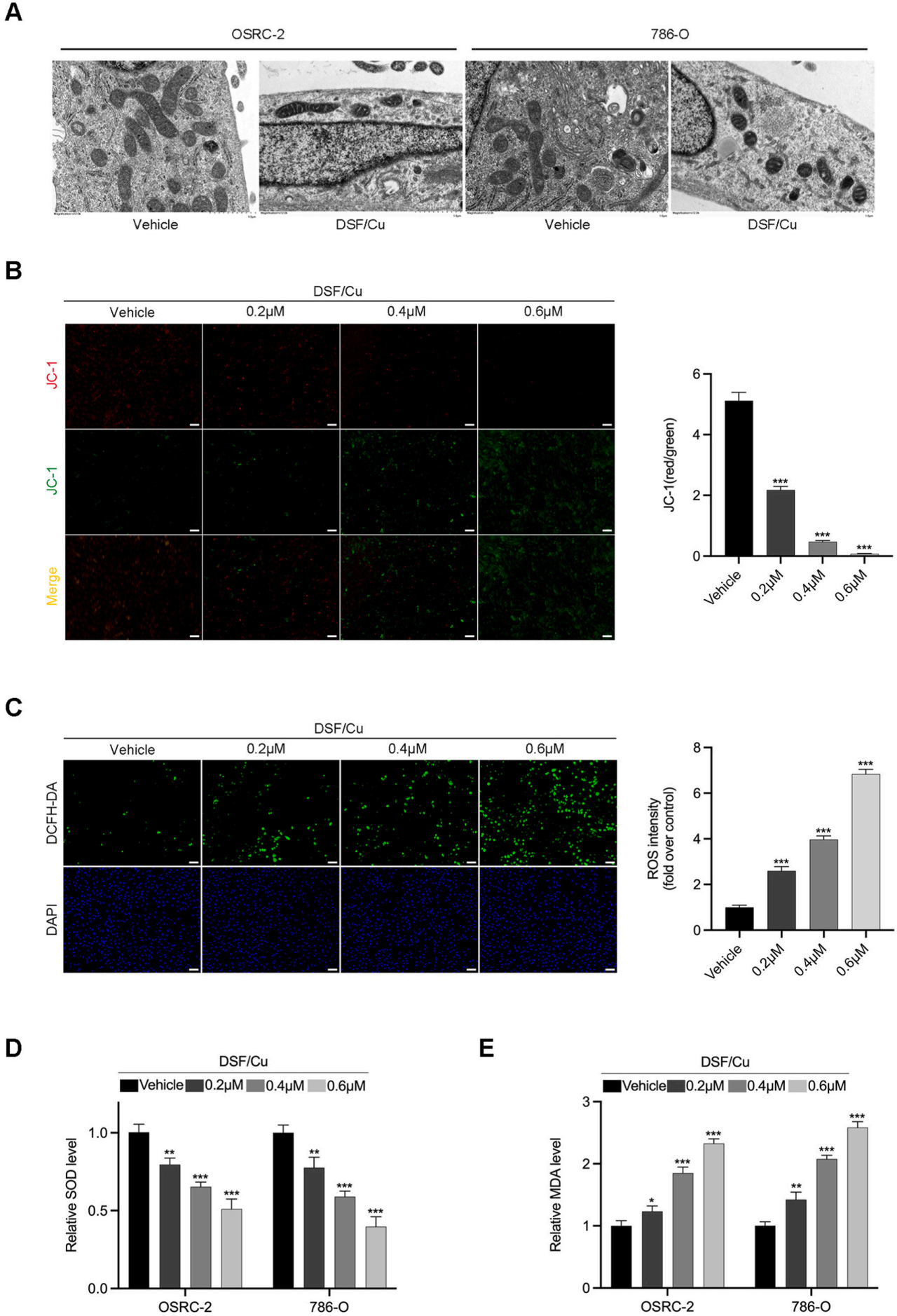
线粒体形态变化:
图2A展示了使用透射电镜(TEM)观察到的RCC细胞在经过对照处理和DSF/Cu处理24小时后线粒体形态的变化(标尺=1μm)。DSF/Cu处理导致线粒体稳态破坏。
线粒体膜电位变化:
图2B通过JC-1试验检测了786-O细胞在经过不同浓度的DSF/Cu处理后线粒体膜电位的变化(×100,标尺=100μm),并以JC-1聚集体(红色荧光)与JC-1单体(绿色荧光)的比率进行定量分析。
氧化应激的指示:
图2C展示了经过不同浓度的DSF/Cu处理的786-O细胞通过DCFH-DA染色后的图像(×100,标尺=100μm)及其定量分析。这些图像表明DSF/Cu处理增加了氧化应激。
抗氧化酶和氧化产物水平:
图2D、2E展示了RCC细胞在经过不同浓度的DSF/Cu处理后超氧化物歧化酶(SOD)水平和丙二醛(MDA)水平的变化。数据显示DSF/Cu处理影响了细胞的抗氧化能力和氧化产物水平。
要点:
DSF/Cu处理破坏了RCC细胞的线粒体稳态。
DSF/Cu处理导致RCC细胞线粒体膜电位降低。
DSF/Cu处理增加了RCC细胞的氧化应激水平。
DSF/Cu处理影响了RCC细胞内的抗氧化酶和氧化产物水平,表明氧化应激加剧。
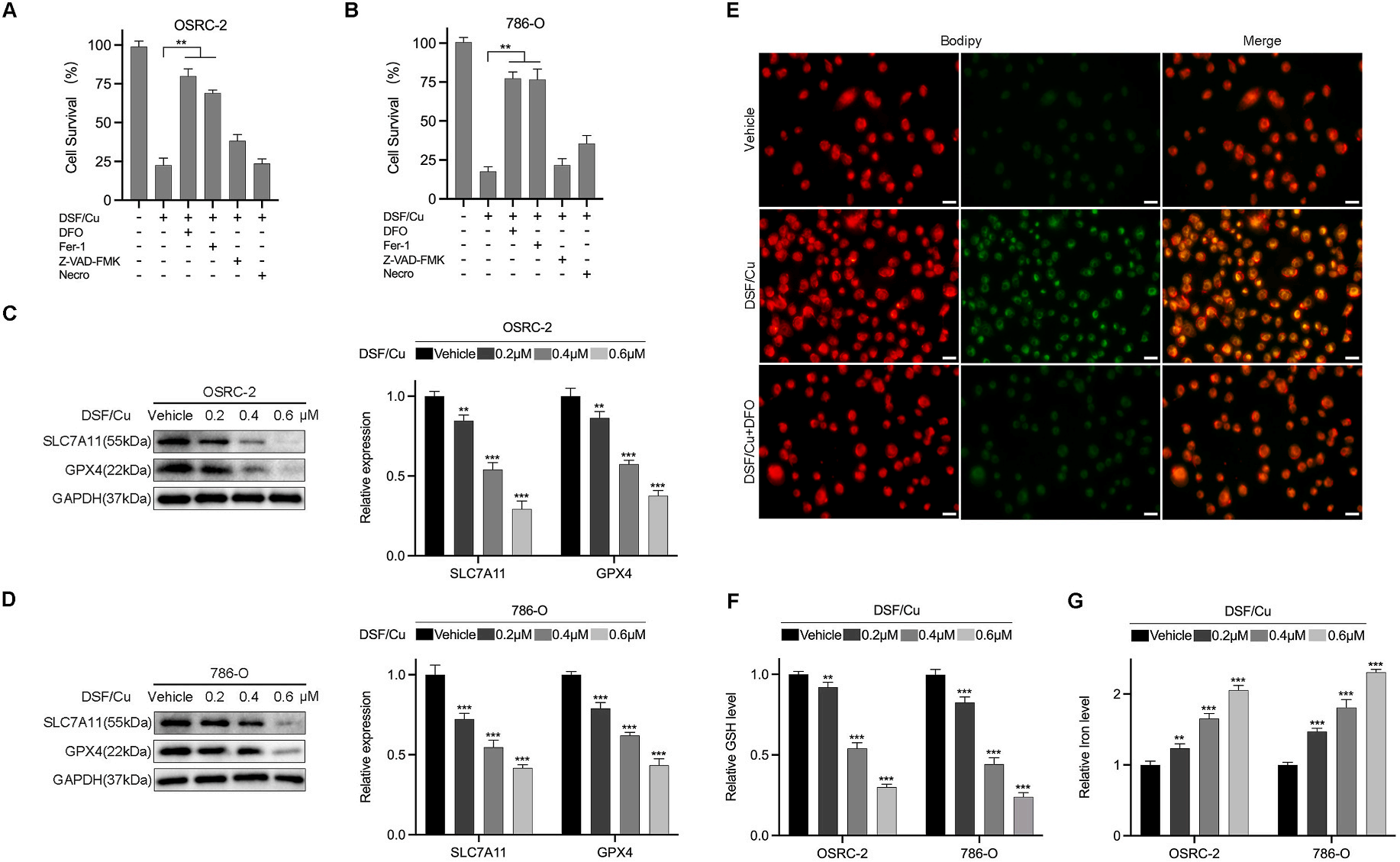
细胞死亡抑制剂的效应:
图3A、3B展示了RCC细胞在存在或不存在各种细胞死亡抑制剂的情况下,与DSF/Cu共同培养24小时后的细胞活性。
铁死亡相关蛋白的检测:
图3C、3D通过Western blot方法展示了RCC细胞在经过不同浓度的DSF/Cu处理后铁死亡相关蛋白(SLC7A11和GPX4)的表达变化。
脂质过氧化物的观察:
图3E展示了在786-O细胞中,经过DSF/Cu处理24小时并存在或不存在DFO(去铁胺)的情况下,使用亲脂性染料Bodipy染色后观察到的总细胞内脂质过氧化物的代表性图像(×200,标尺=50μm)。
GSH和铁含量的变化:图3F、3G展示了RCC细胞在经过不同浓度的DSF/Cu处理后谷胱甘肽(GSH)和铁含量的变化。
要点:
DSF/Cu诱导RCC细胞死亡,且这种效应可以被某些细胞死亡抑制剂所调节。
DSF/Cu处理影响了RCC细胞中与铁死亡相关的关键蛋白表达。
DSF/Cu处理增加了RCC细胞内脂质过氧化物的形成,表明铁死亡的发生。
DSF/Cu处理改变了RCC细胞内的GSH和铁含量,这些变化与铁死亡机制相关。
统计分析显示DSF/Cu处理在统计学上具有显著效果,特别是在铁死亡相关指标上。
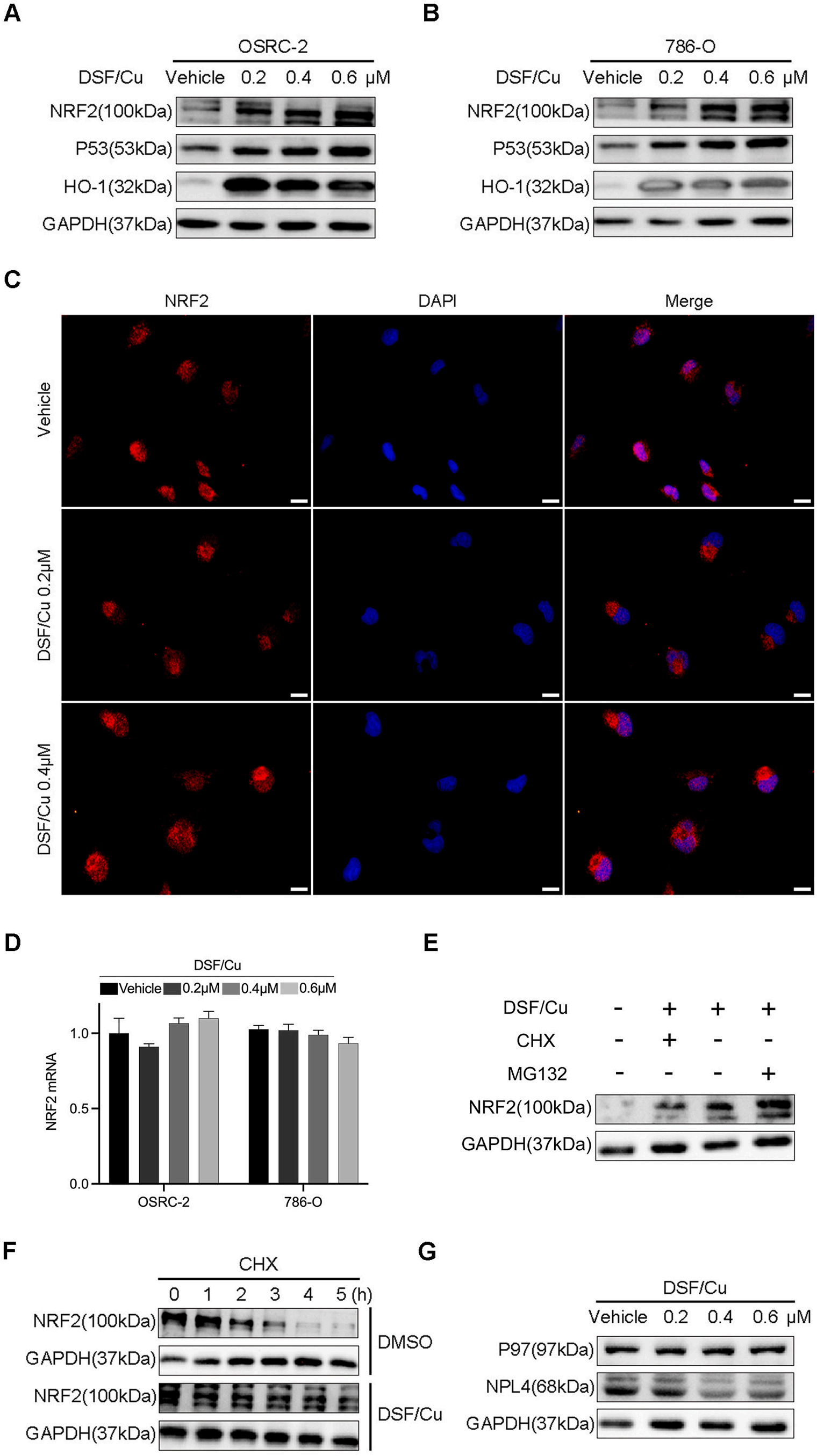
NRF2及相关蛋白的表达:
图4A、4B通过Western blot展示了RCC细胞在经过不同浓度的DSF/Cu处理后NRF2及其相关蛋白(P53和HO-1)的表达变化。
NRF2免疫染色:
图4C展示了786-O细胞在经过不同浓度的DSF/Cu处理24小时后NRF2免疫染色的代表性图像(×400,标尺=20μm)。
NRF2 mRNA水平:
图4D通过定量聚合酶链反应(qPCR)展示了RCC细胞中相对的NRF2 mRNA水平。
NRF2蛋白稳定性:
图4E展示了786-O细胞在单独使用DSF/Cu处理或与CHX(环己亚胺)或MG132(一种蛋白酶体抑制剂)联合处理后NRF2的Western blot。
图4F展示了在存在CHX的情况下,786-O细胞经过对照处理或DSF/Cu处理不同时间后NRF2的半衰期。
P97和NPL4的表达:
图4G通过Western blot展示了RCC细胞在经过不同浓度的DSF/Cu处理后P97和NPL4蛋白的表达变化。
要点:
DSF/Cu处理增加了RCC细胞中NRF2及其相关蛋白(P53和HO-1)的表达。
DSF/Cu处理导致NRF2在RCC细胞中的免疫染色增强。
DSF/Cu处理上调了RCC细胞中NRF2的mRNA水平。
DSF/Cu处理可能影响了NRF2蛋白的稳定性,通过CHX和MG132的实验进一步支持了这一点。
DSF/Cu处理改变了RCC细胞中P97和NPL4的表达,可能与NRF2的调控机制有关。
所有数据均以平均值±标准差表示。
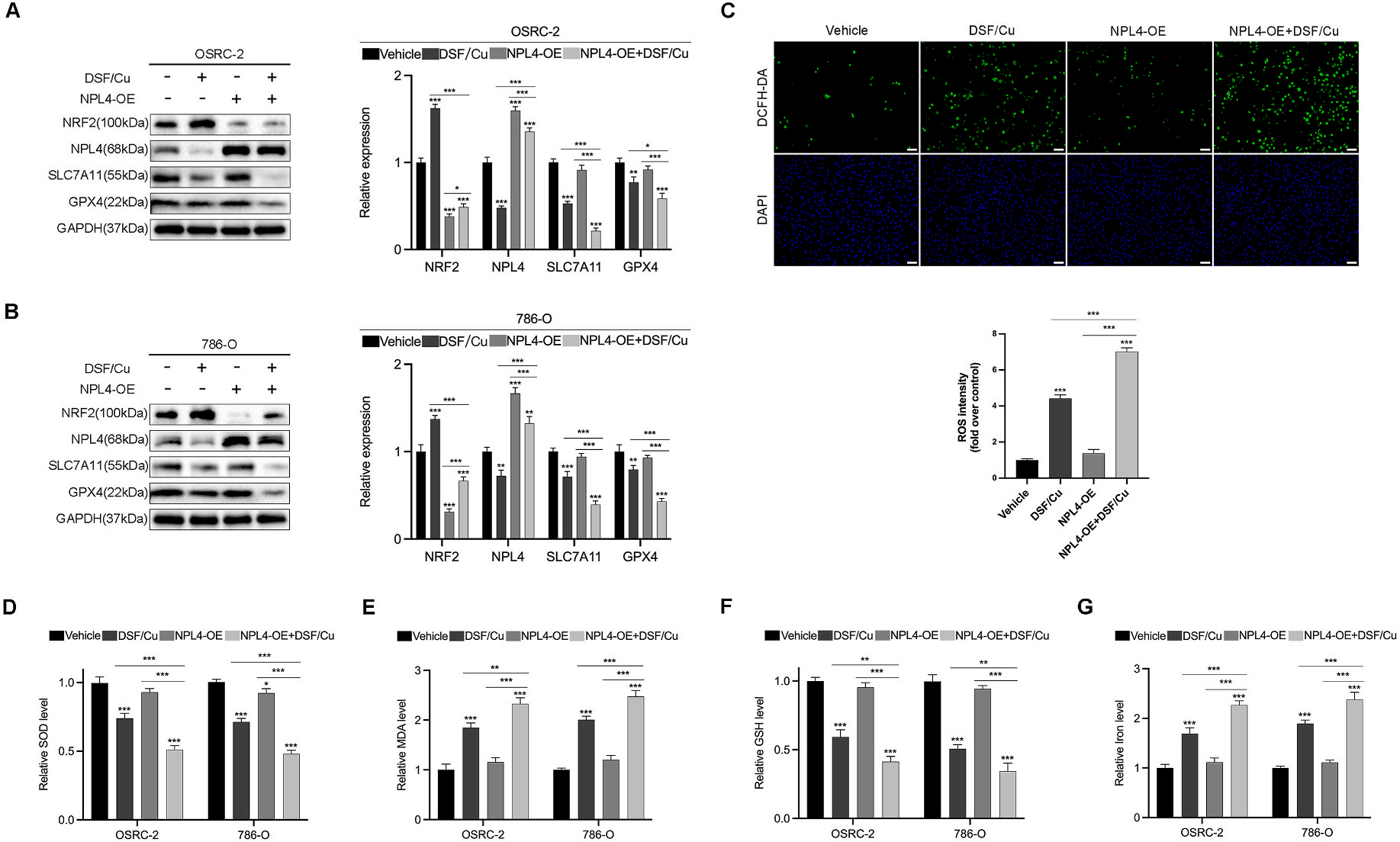
NRF2和铁死亡相关蛋白的表达:
图5A、5B通过Western blot展示了在NPL4过表达或不过表达的情况下,RCC细胞在经过DSF/Cu处理或未处理时NRF2、NPL4以及铁死亡相关蛋白(SLC7A11和GPX4)的表达变化。
氧化应激的指示:
图5C展示了经过不同处理后786-O细胞通过DCFH-DA染色后的图像(×100,标尺=100μm)及其定量分析。这些图像反映了细胞内氧化应激水平的变化。
抗氧化和氧化产物水平:
图5D至5G展示了RCC细胞在经过不同处理后超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽(GSH)和铁含量的变化。
要点:
过表达NPL4可以逆转DSF/Cu处理引起的NRF2水平下降。
过表达NPL4增强了DSF/Cu诱导的氧化应激和铁死亡。
DCFH-DA染色结果表明过表达NPL4的细胞显示出更高的氧化应激水平。
实验数据显示过表达NPL4影响了RCC细胞内的SOD、MDA、GSH和铁含量,这些指标与氧化应激和铁死亡机制相关。
统计分析显示,与对照相比,不同处理的组别在统计学上具有显著差异(*P < 0.05,**P < 0.01,***P < 0.001)。
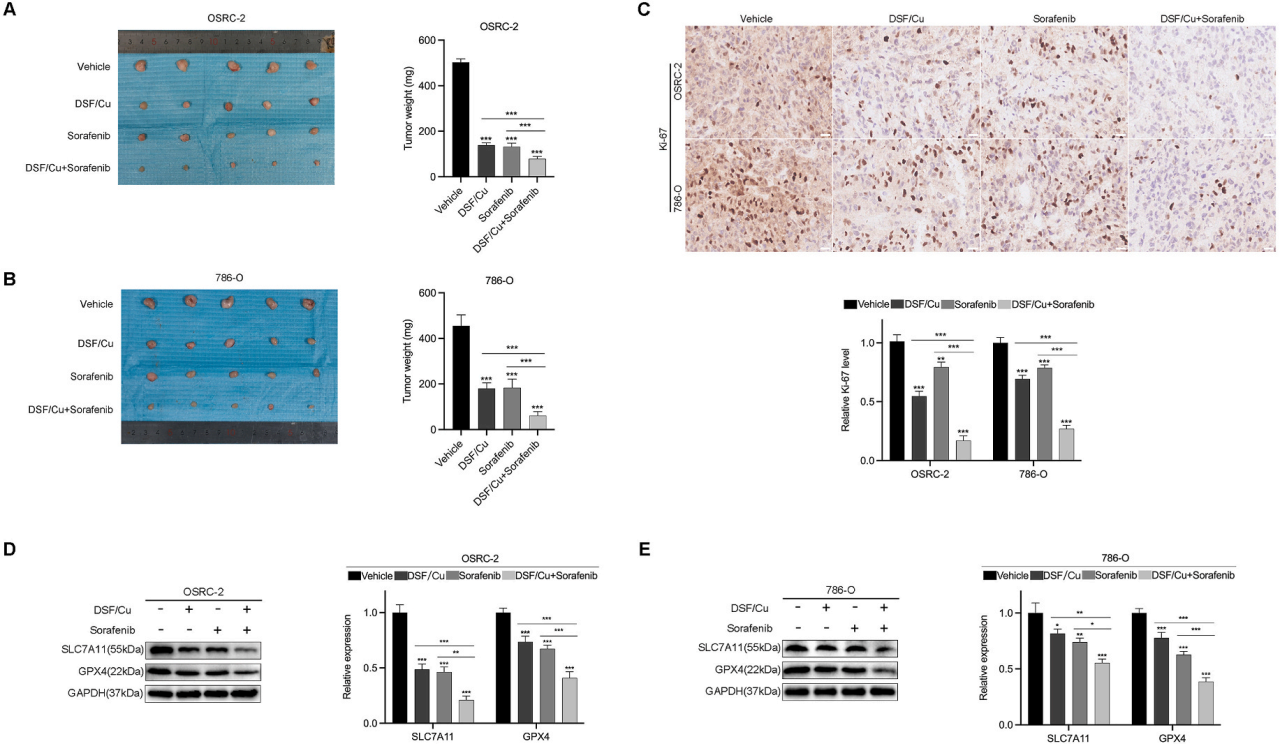
荷瘤小鼠的肿瘤大小和重量:
图6A、6B展示了经过DSF/Cu处理、索拉非尼处理或两者联合处理后,荷瘤小鼠的移植瘤大小和重量。
Ki-67免疫组化分析:
图6C展示了不同处理组移植瘤标本的Ki-67免疫组化分析及其统计表达(×200,标尺=50μm)。Ki-67是一种与细胞增殖相关的标志物。
铁死亡相关蛋白的表达:
图6D、6E通过Western blot展示了不同处理组移植瘤标本中铁死亡相关蛋白(SLC7A11和GPX4)的表达变化。
要点:
DSF/Cu与索拉非尼在体内协同作用,抑制了RCC细胞的生长。
DSF/Cu和索拉非尼的联合处理显著减小了移植瘤的大小和重量。
免疫组化分析显示,联合处理显著降低了移植瘤标本中的Ki-67表达,表明细胞增殖受到抑制。
Western blot分析表明,联合处理增加了铁死亡相关蛋白的表达,表明铁死亡机制被激活。
统计分析显示,与单独处理相比,联合处理在统计学上具有显著差异(*P < 0.05,**P < 0.01,***P < 0.001)。
抑制增殖和迁移:
DSF/铜通过促进氧化应激和铁死亡来抑制肾细胞癌(RCC)的增殖和迁移。
增强氧化应激和铁死亡:
DSF/铜通过克服NPL4抑制引起的NRF2代偿性增加,进一步增强了其诱导的氧化应激和铁死亡效果。
与索拉非尼的协同作用:
在体内,DSF/铜与索拉非尼协同作用,增强了治疗效果。
治疗选择:
DSF/铜有望成为一种新的治疗选择,用于克服索拉非尼耐药性,为肾细胞癌治疗提供新的策略。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:协同施用HIV-1 Gag编码质粒提升癌症DNA疫苗效能的新策略
下一篇:HBV细胞感染模型丨筛选易感HBV的HepG2-NTCP细胞亚型