常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-03-15 18:30:00 细胞资源库平台 访问量:244
同源异体小鼠肿瘤模型是免疫肿瘤学(I/O)研究中不可或缺的临床前模型,但它们对免疫检查点抑制剂(ICIs)的反应有限,这可能是由于它们的固有低免疫原性。为了解决这一问题,研究人员通过将鸡卵清蛋白(OVA)这一高度免疫原性的蛋白质表达到同源异体肿瘤细胞中,开发了新的免疫原性同源异体模型。这些模型,如CT26-OVA和B16-OVA,显示出比它们的亲本细胞系更慢的肿瘤生长速度,这可能是由于免疫介导的排斥反应。更重要的是,这些OVA表达的模型对ICIs,特别是抗PD-1治疗,表现出更高的敏感性,这表明它们在增强T细胞介导的免疫反应方面具有潜力。此外,通过过继T细胞转移实验,研究人员验证了这些模型中存在肿瘤特异性记忆T细胞。这些结果表明,OVA工具细胞不仅增强了对ICIs的反应,而且为临床前免疫治疗评估提供了新的、具有更高免疫原性的同源异体模型,这对于I/O研究具有重要的意义。
英文标题:Coadministration of a Plasmid Encoding HIV-1 Gag Enhances the Efficacy of Cancer DNA Vaccines.
中文标题:共注射编码HIV-1 Gag质粒增强了癌症DNA疫苗的效果。
发表期刊:《Molecular Therapy》
影响因子:12.1
作者单位:
1. 高级药物递送和生物材料,卢万药物研究所,卢万天主教大学,布鲁塞尔,比利时
2. 生物医学分子生物学系,根特大学,根特,比利时
作者信息:Laure Lambricht,Kevin Vanvarenberg,Ans De Beuckelaer,Lien Van Hoecke.
DNA疫苗因其在预防和治疗癌症及传染病方面的潜力而受到关注,但它们在人体中的免疫反应有限,使得其临床应用存在争议。为了提高DNA疫苗的效果,研究人员探索了包括电穿孔技术和基因编码的免疫佐剂在内的多种策略。特别是,编码HIV-1 Gag蛋白的质粒共递送,已被证实能增强癌症DNA疫苗的效力,通过激活I型干扰素和调节适应性免疫反应,从而增强抗原特异性Th1免疫,延缓肿瘤生长,并提高小鼠的存活率。这些研究背景强调了通过电穿孔和HIV-1 Gag质粒刺激先天免疫的能力,为设计新型转化遗传佐剂以克服DNA疫苗在人类中的局限性提供了有趣的途径。尽管DNA疫苗在兽医领域已有应用,但在人类中的应用仍在研究中,因为其免疫原性通常低于其他常规疫苗。近年来,为了提高DNA疫苗在人类中的免疫原性,已经取得了多项进展,这些进展为开发更有效的DNA疫苗提供了科学基础。
在本研究中,首先,设计并合成了HIV-1 Gag、OVA和人类gp100的全长和密码子优化基因序列,并将它们亚克隆到pVAX2载体中。接着,通过定点突变技术获得了HIV-1 Gag编码质粒的突变版本,并利用Sanger DNA测序确认突变序列。质粒DNA通过EndoFree Plasmid Giga Kit纯化,并在Dulbecco’s PBS中稀释。其次,培养了B16F10-OVA黑色素瘤细胞系和HEK 293 T细胞,并通过Lipofectamine 2000转染pGag质粒来生产病毒样颗粒(VLPs)。VLPs通过动态光散射和透射电子显微镜成像进行表征,并通过Western blot分析其蛋白组成。在小鼠实验中,我们将质粒DNA溶液注射到C57BL/6小鼠的左胫骨肌,并使用电穿孔技术增强DNA疫苗的递送。此外,利用异质Luciferase报告小鼠进行体内生物发光成像,以评估质粒DNA注射后IFN的诱导。小鼠免疫实验中,我们注射含有OVA或GP100质粒DNA的溶液,单独或与HIV-1 Gag编码质粒共注射,并进行电穿孔。在肿瘤植入实验中,我们将B16F10-OVA细胞注射到小鼠的右侧腹部皮下,并测量肿瘤大小和体积。最后,收集小鼠血液样本,测定OVA特异性IgG、IgG1、IgG2a水平和IFN-γ水平,并通过流式细胞仪分析特异性杀伤。所有数据通过GraphPad Prism软件进行统计分析。
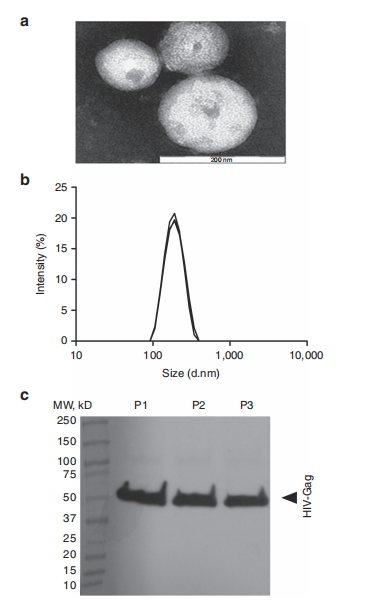
图1. HIV-1 Gag病毒样颗粒(VLPs)的表征。
(a) 通过透射电子显微镜观察了纯化后的样品,并进行了负染色。这张图片代表了三个重复实验的数据。裸尺:200纳米。
(b) 通过动态光散射(DLS)单独测量了颗粒的大小(n = 3)。颗粒大小是根据翻译扩散系数利用斯托克斯-爱因斯坦方程计算得出的。
(c) 使用针对HIV-1 Gag的兔多克隆抗体作为一抗,以及用生物素标记的多克隆山羊抗兔免疫球蛋白作为二抗,对通过超速离心纯化的三个重复生产的VLPs进行了Western blot分析(P1、P2、P3)。在约56kDa处检测到了HIV-1 Gag蛋白。
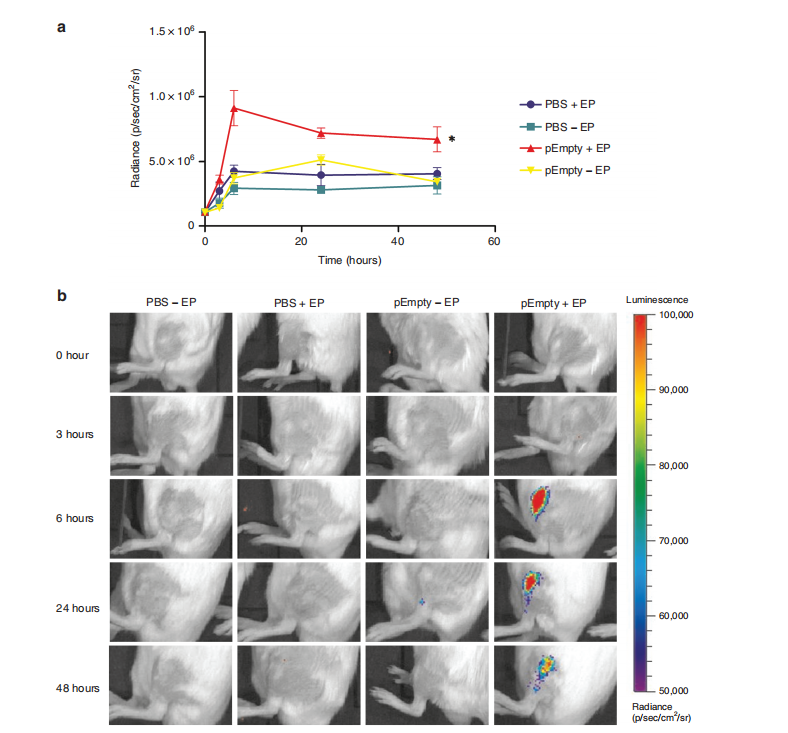
图2. 电穿孔对1型干扰素(IFN)表达的影响。
实验中,使用了异质Luciferase报告小鼠(IFN-β+/Δβ-luc)作为模型,这些小鼠可以用于活体成像以量化IFN的表达。实验组小鼠分别接受了磷酸盐缓冲液(PBS)或空质粒(pEmpty)的处理,随后施加了八个20毫秒、200V/cm的电脉冲(+EP)或不施加电脉冲(-EP)。通过腹腔注射荧光素(luciferin)后,利用活体生物发光成像技术来量化IFN的表达。结果显示,在治疗后的0、3、6、24和48小时观察到辐射强度,数据以平均值±标准误差(n=4)呈现。与未施加电脉冲的PBS对照组相比,施加电脉冲的组别显示出显著差异(*P < 0.05),使用了Friedman测试和Dunn’s事后测试进行统计分析。此外,还提供了小鼠根据不同处理和时间点的代表性成像,颜色的强度表示生物发光的强度。
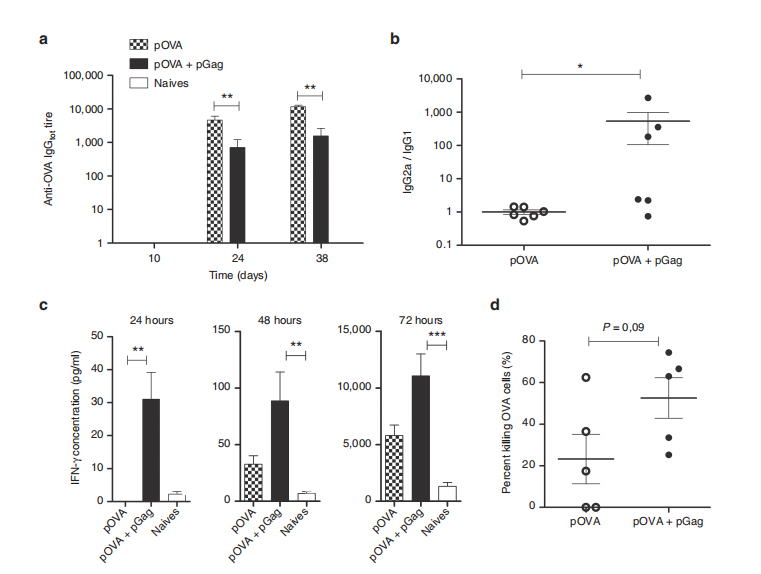
图3. pGag共递送在抗卵清蛋白(OVA)免疫期间对免疫反应的影响。
本研究评估了在抗卵清蛋白(OVA)免疫方案中,共递送HIV-1 Gag质粒对C57BL/6小鼠免疫反应的影响。免疫方案包括一次初免和两次加强免疫,每隔两周进行一次。
(a) 通过酶联免疫吸附试验(ELISAs)测定了小鼠血清中OVA特异性总IgG滴度,这些小鼠在实验的第10天、第24天和第38天(每次疫苗接种后10天,以第0天为初免日)被收集血清。误差条表示平均值±标准误差(n=6)。星号表示组间显著差异(**P < 0.01)(Mann–Whitney U检验和Bonferroni检验)。
(b) 在最后一次加强免疫后随机收集小鼠血清,分析抗体亚型。通过ELISAs测定了IgG1和IgG2a滴度,并以IgG2a/IgG1比率对每只小鼠进行表征(*P < 0.05)(Mann–Whitney U检验)。
(c) 为了分析OVA特异性IFN-γ水平,小鼠在最后一次疫苗接种后1周被处死。在用OVA蛋白重新刺激小鼠脾细胞24、48和72小时后,测量了上清液中的IFN-γ浓度。误差条表示平均值±标准误差(n=6)。星号表示组间显著差异(**P < 0.01, ***P < 0.001)(Kruskal–Wallis和Dunn’s事后检验)。
(d) 通过体内细胞毒性测定分析了抗原特异性杀伤的百分比。免疫小鼠接受了两组标记的脾细胞:MHC-I OVA肽脉冲靶细胞和MHC-I无关肽脉冲细胞。转移后两天,通过比较两组细胞的相对减少量来获得靶细胞的特异性杀伤百分比。使用Mann–Whitney U检验比较OVA靶细胞杀伤的百分比。
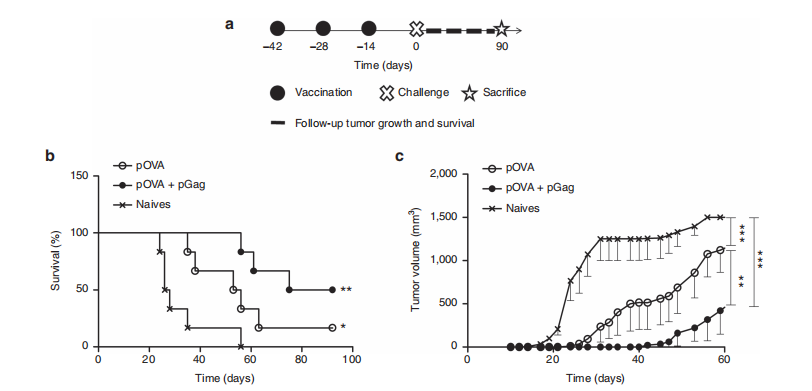
图4. pGag共递送在预防性抗卵清蛋白(OVA)免疫期间对抗癌活性的影响。
本研究探讨了在预防性抗卵清蛋白(OVA)免疫方案中,共递送pGag对C57BL/6小鼠抗癌活性的影响。免疫方案包括一次初免和两次加强免疫,每隔两周进行一次,使用的是OVA质粒单独或与pGag联合使用。
(a) 实验计划:小鼠在完成最后一次免疫后两周,被挑战性地接种B16F10-OVA细胞,随后对肿瘤生长和小鼠生存情况进行了为期3个月的评估。
(b) 挑战后生存率监测:星号表示与未免疫小鼠相比的显著差异(*P < 0.05, **P < 0.01)(生存曲线比较,Mantel–Cox检验)。
(c) 挑战后接种pOVA和pOVA联合pGag的小鼠肿瘤生长跟踪:结果表示为平均值 ± 标准误差(n = 6)。星号显示组间的显著差异(**P < 0.01, ***P < 0.001)(方差分析,Dunnett’s事后检验)。
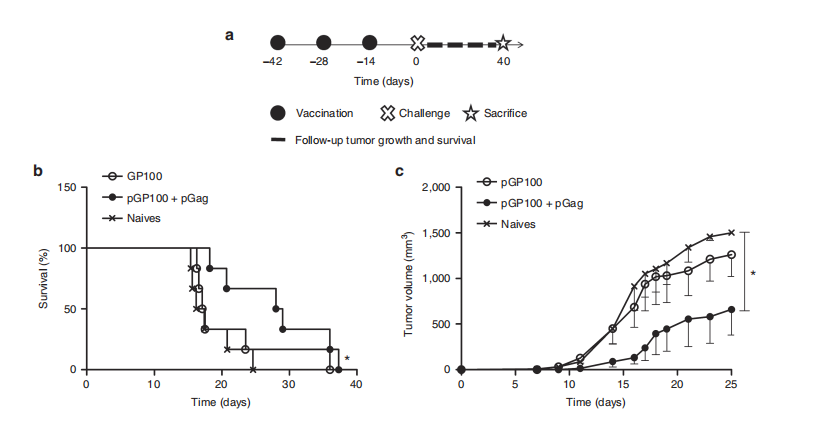
图5. pGag共递送在预防性抗GP100免疫期间对抗癌活性的影响。
(a) 实验计划:小鼠接受了包含GP100质粒与或不包含pGag的免疫方案,之后被挑战性地接种B16F10-OVA细胞,以评估肿瘤生长和存活情况。
(b) 挑战后生存率监测:与未免疫小鼠相比,共递送pGag的免疫组别显示出显著差异(*P < 0.05),使用Mantel–Cox检验比较生存曲线。
(c) 挑战后肿瘤生长跟踪:免疫小鼠接种pGP100和pGP100联合pGag后,结果显示为平均值 ± 标准误差(n = 6)。星号表示组间显著差异(*P < 0.05),使用方差分析和Dunnett’s事后检验。
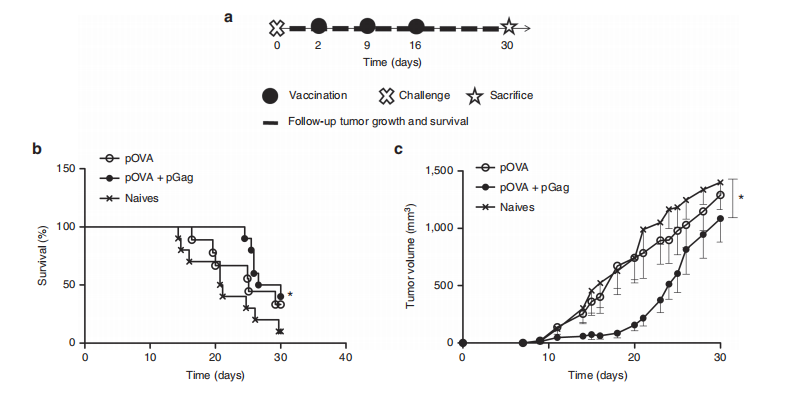
图6.pGag共递送在治疗性抗OVA免疫期间对抗癌活性的影响。
(a) 实验计划:小鼠接受了包含OVA质粒与或不包含pGag的免疫方案,之后被挑战性地接种B16F10-OVA细胞,以评估肿瘤生长和存活情况。
(b) 挑战后生存率监测:与未免疫小鼠相比,共递送pGag的免疫组别显示出显著差异(*P < 0.05),使用Mantel–Cox检验比较生存曲线。
(c) 挑战后肿瘤生长跟踪:免疫小鼠接种pOVA和pOVA联合pGag后,结果显示为平均值 ± 标准误差(n = 10)。星号表示组间显著差异(*P < 0.05),使用方差分析和Dunnett’s事后检验。
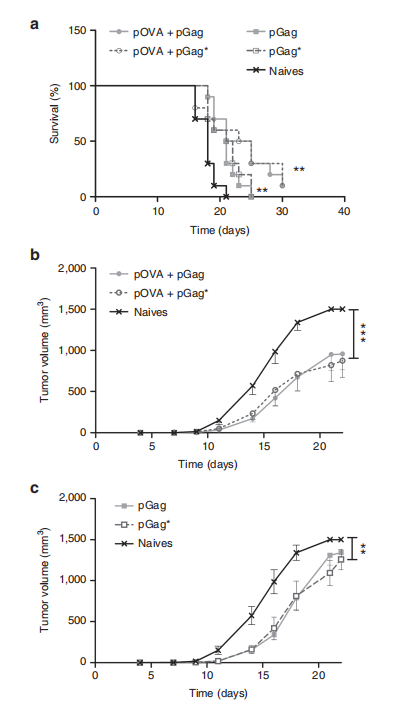
图7.pGag与pGag*共递送在治疗性抗OVA免疫中对抗癌活性的比较效果。
本研究比较了在治疗性抗卵清蛋白(OVA)免疫中,共递送pGag和pGag*对C57BL/6小鼠抗癌活性的影响。实验计划如下:小鼠首先被挑战性地接种B16F10-OVA细胞,两天后开始按照一剂初免和两剂加强的免疫方案进行免疫,每隔一周进行一次,使用的是OVA质粒单独或与pGag或pGag*联合使用。在挑战后评估了肿瘤生长和存活率。
(a) 挑战后生存率监测显示,与未免疫小鼠相比,共递送pGag和pGag*的免疫组别显示出显著差异(**P < 0.01),使用Mantel–Cox检验比较生存曲线。
(b) 和 (c) 挑战后肿瘤生长跟踪显示,免疫小鼠接种pOVA联合pGag或pGag*后,结果显示为平均值 ± 标准误差(n = 10)。星号表示组间显著差异(**P < 0.01, ***P < 0.001),使用方差分析和Dunnett’s事后检验。
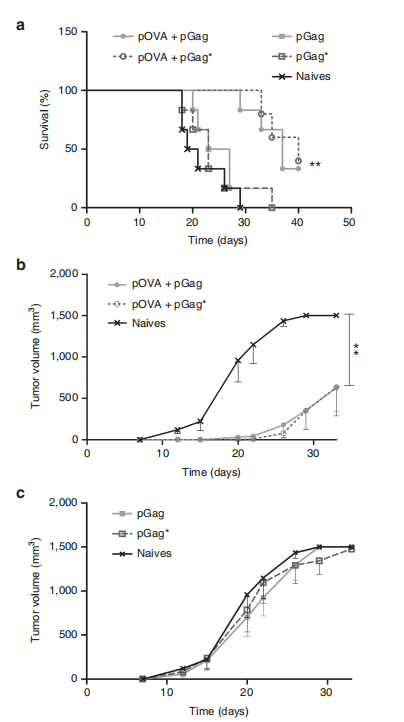
图8.pGag与pGag*共递送在预防性抗OVA免疫中对抗癌活性的比较效果。
(a) 挑战后生存率监测显示,与未免疫小鼠相比,共递送pGag和pGag*的免疫组别显示出显著差异(**P < 0.01),使用Mantel–Cox检验比较生存曲线。
(b) 和 (c) 挑战后肿瘤生长跟踪显示,免疫小鼠接种pOVA联合pGag或pGag*后,结果显示为平均值 ± 标准误差(n = 6)。星号表示组间显著差异(**P < 0.01),使用方差分析和Dunnett’s事后检验。这些结果表明,pGag和pGag*共递送能够显著提高预防性抗OVA免疫的抗癌活性。
在体外实验中,将编码完整长度和未修饰的HIV-1 Gag蛋白的质粒转染到细胞中能够诱导病毒样颗粒(VLP)的形成。在体内,通过电穿孔技术递送质粒DNA能够激活I型干扰素(IFN)反应。此外,共递送HIV-1 Gag质粒能够促进Th1极化的免疫反应。在预防性抗OVA和抗gp100的DNA免疫接种中,共递送HIV-1 Gag质粒均能有效延迟B16F10-OVA黑色素瘤肿瘤的生长。同样,在治疗性抗OVA DNA免疫接种中,共递送HIV-1 Gag质粒也能延迟肿瘤生长。重要的是,HIV-1 Gag VLP的形成并不是其佐剂免疫调节效应所必需的,这表明Gag质粒的免疫增强作用可能通过其他机制实现。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:南大学医学院等联合发表:东Semaphorin 3C(Sema3C)重塑肿瘤基质微环境,促进肝细胞癌进展
下一篇:克服NPL4抑制引起的NRF2代偿性增加可增强双硫仑/铜诱导的肾癌氧化应激和铁死亡