常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-03-15 09:05:24 细胞资源库平台 访问量:438
英文标题:Semaphorin 3C (Sema3C) reshapes stromal microenvironment to promote hepatocellular carcinoma progression
中文标题:Semaphorin 3C(Sema3C)重塑肿瘤基质微环境,促进肝细胞癌进展
发表期刊:《Signal transduction and targeted therapy》
影响因子:40.8
作者单位:东南大学医学院
作者信息:Hao Peng;Meng Yang;Kun Feng;Qingpeng Lv;Yewei Zhang
1. 背景
HCC特点:90%以上HCC病例发生在纤维化或肝硬化背景下,肿瘤微环境(TME)涉及CAFs和CSCs的相互作用。
研究问题:CSCs如何调控HCC基质动态的机制尚不明确。
2. 主要发现
Sema3C作用:
在纤维化肝脏、HCC组织、患者外周血及索拉非尼耐药组织中显著上调,与HCC干性特性相关。
通过NRP1和ITGB1受体激活AKT/Gli1/c-Myc通路,增强HCC自我更新和肿瘤起始。
促进ECM收缩、胶原沉积及HSCs增殖和活化。
通过NF-kB通路刺激IL-6释放和HMGCR表达,增强HSCs胆固醇合成。
CAFs作用:
CAF分泌的TGF-β1激活AP1信号,增强HCC细胞中Sema3C表达,形成正反馈环路。
CAFs通过促进肿瘤细胞增殖、血管生成和重塑微环境支持肿瘤发生,并通过破坏药物传递和信号传导促进化疗耐药。
3. 机制
Sema3C与HSCs:通过NRP1和ITGB1激活NF-kB通路,促进IL-6释放和胆固醇合成。
CAF与HCC细胞:通过TGF-β1/AP1信号增强Sema3C表达,加速HCC进展。
4. 治疗潜力
Sema3C阻断:抑制肿瘤生长,增强HCC细胞对索拉非尼的敏感性。
治疗策略:Sema3C作为CSCs与基质相互作用的新靶点,为HCC治疗提供新方向。
1. 细胞系与细胞培养
细胞系来源:肝癌细胞系(Hep3B、Huh7、MHCC-97L、HepG2、SMMC7721)和人肝星状细胞系(LX-2)均从商业公司购买。
CAF(癌相关成纤维细胞)分离:从新鲜肝癌组织中分离CAF,通过胶原酶和透明质酸酶消化组织,过滤后离心,使用含10% FBS的培养基培养,最终获得CAF。
条件培养基(CM)收集:将CAF或肝癌细胞接种于6孔板,替换为无血清培养基,培养48小时后收集上清液,离心去除细胞碎片。
2. 临床样本与公共数据库
血清样本:从肝癌患者术前外周血和健康个体中分离血清。
肝癌组织样本:从南京医科大学第二附属医院收集肝癌切除患者的组织样本,所有患者均未接受化疗或放疗。
公共数据库:从TCGA、HCCDB和GEO数据库获取肝癌基因表达数据和临床数据,用于分析Sema3C的表达。
3. 病毒构建与RNA干扰
慢病毒构建:构建过表达Sema3C的慢病毒,合成针对Sema3C和ITGB1的shRNA载体。
siRNA设计:设计并合成针对Sema3C、NRP1、c-Jun、c-Fos和ITGB1的siRNA,使用Lipofectamine 2000转染细胞。
4. RNA提取与qRT-PCR
RNA提取:使用TRIZOL试剂提取细胞RNA,合成cDNA后进行qRT-PCR,使用SYBR Green检测基因表达,以GAPDH为内参。
5. 蛋白质分析
Western Blot:使用RIPA缓冲液裂解细胞,离心后测定蛋白浓度,进行SDS-PAGE电泳,转膜后使用一抗和二抗检测目标蛋白。
ELISA:使用ELISA试剂盒检测细胞上清液中Sema3C、TGF-β1和IL-6的浓度。
6. 细胞功能实验
细胞增殖与凋亡:通过CCK-8实验检测细胞活力,使用Annexin-V/PI染色检测细胞凋亡。
球体形成实验:将肝癌细胞接种于超低附着板,培养7-10天后计数球体数量。
Transwell迁移与侵袭实验:将细胞接种于Transwell小室,分别进行迁移和侵袭实验,固定染色后计数迁移或侵袭的细胞数。
7. 胶原凝胶收缩实验
凝胶制备:将细胞悬液与胶原I混合,调整pH后转移至24孔板,待凝胶凝固后处理,测量凝胶收缩面积。
8. 免疫组织化学(IHC)与免疫荧光(IF)
IHC染色:将组织切片进行抗原修复,使用一抗和二抗染色,检测Ki67、p-AKT、Gli1、c-Myc、Sema3C等蛋白表达。
IF染色:固定细胞或组织切片,使用一抗和荧光标记的二抗染色,观察α-SMA和Collagen I的表达。
9. 染色质免疫共沉淀(ChIP)
ChIP实验:使用Simple ChIP试剂盒,将细胞交联后超声破碎DNA,使用抗体免疫沉淀,通过qRT-PCR分析Sema3C启动子区域的DNA富集。
10. 免疫共沉淀(Co-IP)与质谱分析
Co-IP实验:使用rProtein A/G磁珠,将细胞裂解后与抗体孵育,进行免疫沉淀,通过Western Blot分析目标蛋白。
质谱分析:将凝胶样品酶解后进行质谱检测,数据上传至ProteomeXchange数据库。
11. RNA测序分析
RNA提取与测序:使用TRIzol试剂提取LX-2细胞的RNA,通过illumina Novaseq平台进行RNA测序,使用Cufflinks进行差异基因表达分析。
12. 肝癌小鼠模型
模型建立:通过DEN和CCl4诱导C57BL/6小鼠肝癌模型,观察肿瘤形成。
联合治疗实验:使用rAAV8-shSema3C或rAAV8-shNC病毒注射小鼠,联合索拉非尼治疗,评估肿瘤生长抑制效果。
13. 体内致瘤性实验
实验流程:按照东南大学医学院动物伦理委员会指南进行实验,评估Sema3C对肝癌生长的体内影响。
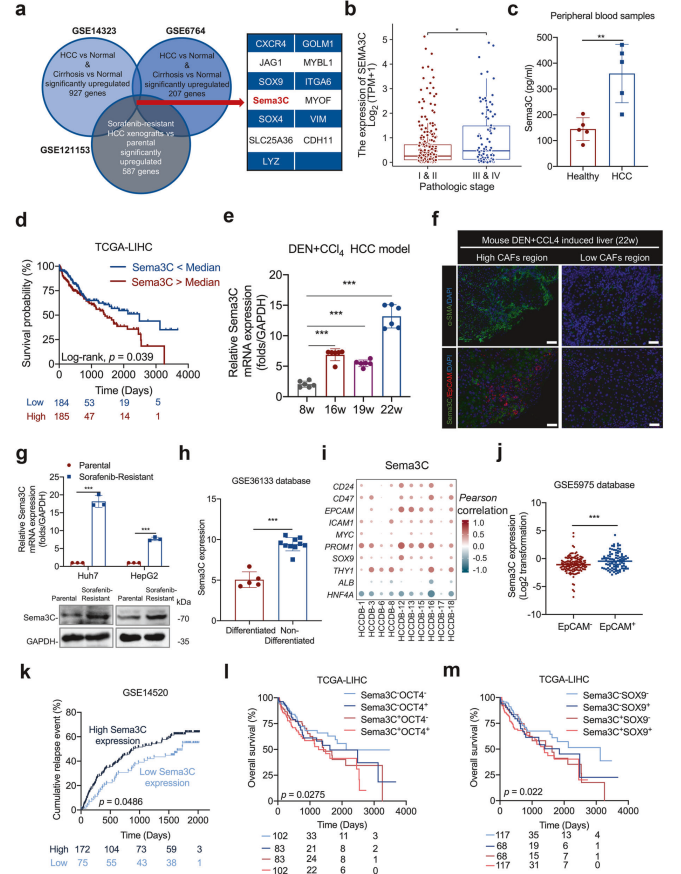
1. Sema3C的识别与表达分析
数据整合:通过整合公共数据集(GSE14323、GSE6764、GSE121153)识别出Sema3C在肝硬化和HCC中均上调,并与索拉非尼耐药相关。
病理分期相关性:Sema3C表达与HCC病理分期呈正相关。
外周血检测:ELISA检测显示HCC患者外周血中Sema3C表达显著高于健康个体(n=5)。
2. Sema3C与HCC预后的关系
生存分析:基于TCGA-LIHC数据集的Kaplan-Meier分析显示,高表达Sema3C的HCC患者总体生存率显著降低。
复发预测:基于GSE14520数据集的累积复发事件分析表明,高表达Sema3C与HCC复发风险增加相关。
3. Sema3C在HCC发展中的动态表达
qRT-PCR分析:在DEN+CCl4诱导的HCC模型中,Sema3C表达在正常肝脏(8周)、纤维化肝脏(16-19周)和HCC(22周)中逐渐上调。
免疫荧光染色:HCC组织(22周)中Sema3C与EpCAM共定位,表明其与HCC干细胞特性相关。
4. Sema3C与索拉非尼耐药的关系
耐药细胞表达:索拉非尼耐药的Huh7和HepG2细胞中,Sema3C的mRNA和蛋白表达显著高于敏感细胞。
非分化细胞表达:与非分化HCC细胞系相比,分化HCC细胞系中Sema3C表达显著上调(GSE36133数据库)。
5. Sema3C与干细胞相关基因的相关性
相关性分析:HCCDB数据集分析显示,Sema3C表达与HCC中多个干细胞相关基因(如OCT4、SOX9)显著正相关。
EpCAM+细胞表达:GSE5975数据库中,EpCAM+细胞的Sema3C表达显著高于EpCAM-细胞。
6. Sema3C与干细胞标志物的生存分析
OCT4+和SOX9+表达:基于TCGA-LIHC数据集的Kaplan-Meier分析显示,高表达Sema3C且OCT4+或SOX9+的HCC患者总体生存率显著降低。
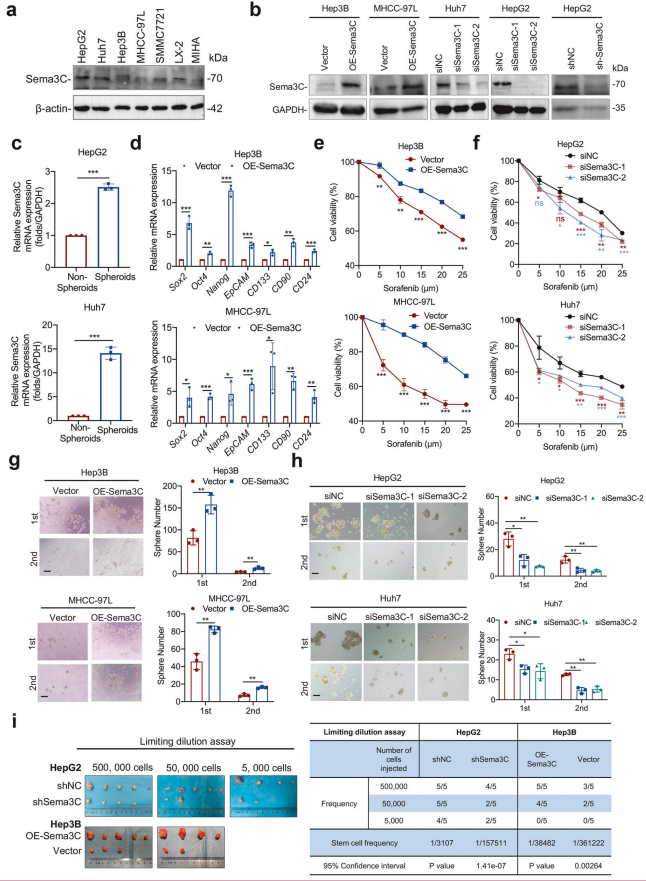
1. Sema3C的表达分析
细胞系表达:通过Western印迹法检测多种肝细胞癌细胞系、肝星状细胞(LX-2)和正常肝细胞(MIHA)中Sema3C的蛋白表达水平。
过表达与敲低:通过Western印迹法验证Sema3C过表达和敲低的肝细胞癌细胞中Sema3C的蛋白表达水平。
2. Sema3C与干细胞特性的关系
球状体表达:通过qRT-PCR分析,HepG2和Huh7细胞球状体中Sema3C的mRNA表达显著高于非球状体细胞。
干细胞相关基因:Sema3C过表达的肝细胞癌细胞中,与干细胞特性相关的基因(如OCT4、SOX2、NANOG)mRNA表达显著上调。
3. Sema3C对化疗耐药的影响
MTT试验:Sema3C过表达增强肝细胞癌细胞的化疗耐药性,而Sema3C敲低则降低耐药性。
4. Sema3C对自我更新的影响
球体形成试验:Sema3C过表达显著促进肝细胞癌细胞的自我更新能力,而Sema3C敲低则抑制自我更新。
5. Sema3C对肿瘤起始的影响
限制稀释试验:在BALB/c裸鼠中,Sema3C敲低的HepG2细胞(shSema3C)肿瘤起始能力显著降低,而Sema3C过表达的Hep3B细胞(OE-Sema3C)肿瘤起始能力显著增强(每组n=5)。
统计分析:使用Student's t检验比较两组,并通过极端限制稀释分析(ELDA)进行限制稀释试验。
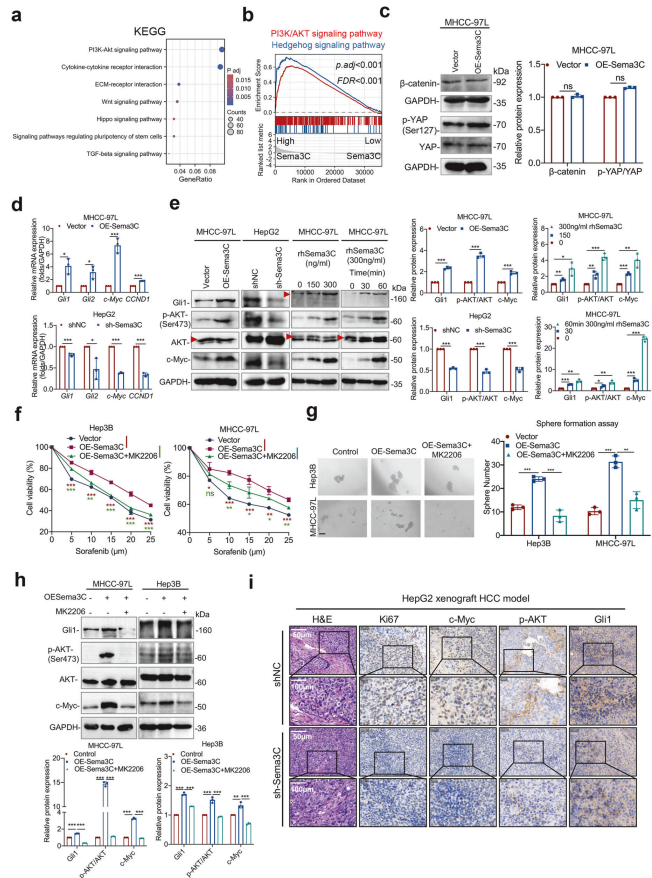
1. Sema3C与信号通路的关联
KEGG通路分析:基于TCGA-LIHC数据库,Sema3C与肝细胞癌患者中的PI3K-AKT信号通路高度相关。
GSEA分析:在高表达Sema3C的肝细胞癌组中,PI3K/AKT和Hedgehog信号通路相关基因显著富集。
2. Sema3C对信号分子的影响
β-catenin和YAP水平:Sema3C过表达的MHCC-97L细胞中,β-catenin和磷酸化YAP水平显著上调(Western blot分析)。
mRNA表达:Sema3C过表达的MHCC-97L细胞中,Gli1、Gli2、c-Myc和CCND1的mRNA表达显著上调;Sema3C敲低的HepG2细胞中,这些基因的表达显著下调。
蛋白表达:Sema3C过表达的MHCC-97L和HepG2细胞中,总AKT、p-AKT、Gli1和c-Myc的蛋白表达水平显著上调。
3. AKT抑制剂的作用
细胞活力:用AKT抑制剂MK2206处理的Sema3C过表达的Hep3B和MHCC-97L细胞,细胞活力显著降低(MTT实验)。
自我更新能力:MK2206处理显著抑制Sema3C过表达细胞的球状体形成能力(球状体形成实验)。
信号分子水平:MK2206处理显著降低Sema3C过表达细胞中Gli1、p-AKT和c-Myc的蛋白水平(Western blot分析)。
4. 体内实验验证
异种移植肿瘤染色:HepG2异种移植肿瘤的H&E和IHC染色显示,Sema3C敲低显著降低Ki67、c-Myc、p-AKT(Ser473)和Gli1的表达。
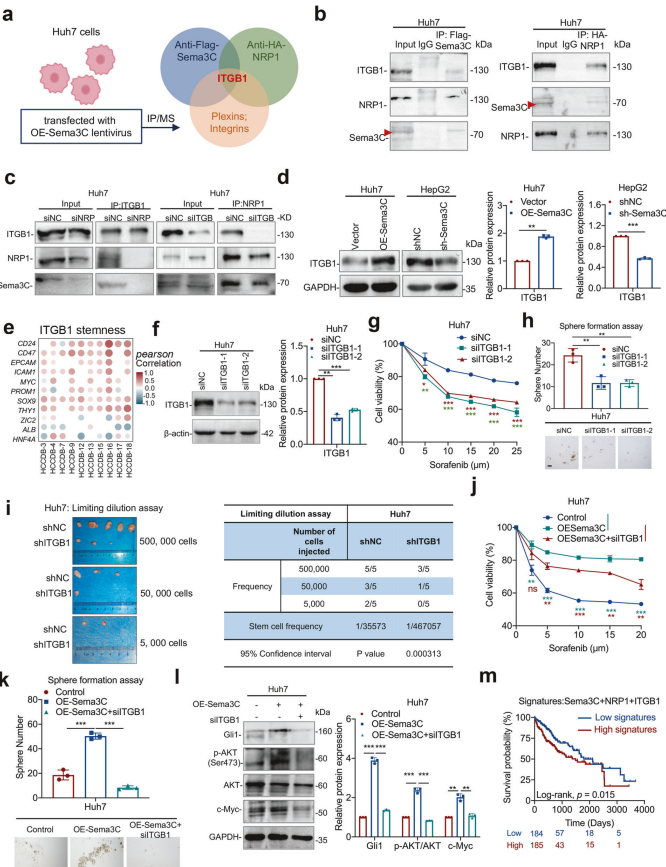
1. Sema3C与NRP1和ITGB1的相互作用
受体识别方案:通过实验方案识别出Sema3C和NRP1的潜在结合受体。
共免疫沉淀分析:在Huh7细胞中验证ITGB1是Sema3C或NRP1的结合蛋白。
敲低实验:在Huh7细胞中敲低NRP1和ITGB1后,通过共免疫沉淀检测Sema3C、NRP1和ITGB1之间的相互作用。
2. ITGB1的表达与干细胞特性
表达检测:在Sema3C过表达或敲低的HCC细胞中检测ITGB1的表达。
相关性分析:HCCDB数据集分析显示,ITGB1表达与HCC中多个干细胞相关基因显著正相关。
3. ITGB1敲低的功能验证
蛋白表达:通过蛋白质印迹法验证ITGB1敲低的Huh7细胞中ITGB1的表达水平。
化疗耐药性:ITGB1敲低显著降低Huh7细胞的化疗耐药性(MTT试验)。
自我更新能力:ITGB1敲低显著抑制Huh7细胞的自我更新能力(球形成试验)。
4. Sema3C过表达与ITGB1敲低的联合效应
化疗耐药性:Sema3C过表达增强Huh7细胞的化疗耐药性,而ITGB1敲低逆转这一效应(MTT试验)。
自我更新能力:Sema3C过表达促进Huh7细胞的自我更新能力,而ITGB1敲低抑制这一能力(球形成试验)。
信号分子水平:Sema3C过表达上调Gli1、p-AKT和c-Myc的蛋白表达,而ITGB1敲低逆转这一效应(蛋白质印迹法)。
5. 体内实验验证
限制稀释试验:在BALB/c裸鼠中,ITGB1敲低的Huh7细胞(shITGB1)肿瘤起始能力显著降低(每组n=5)。
6. 临床相关性
生存分析:基于Sema3C+NRP1+ITGB1高或低基因特征的Kaplan-Meier生存分析显示,高表达组HCC患者的总体生存率显著降低。
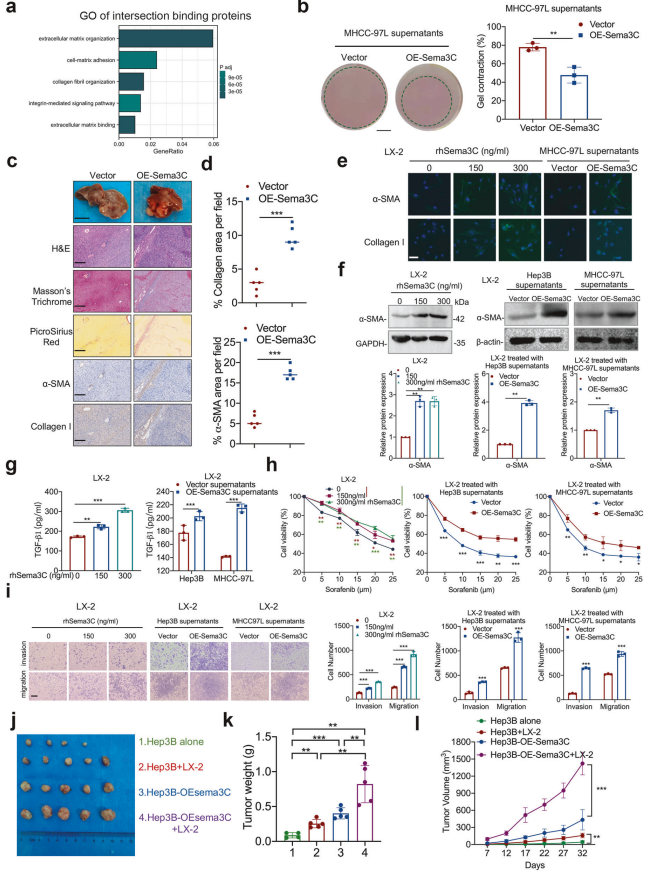
1. Sema3C与ECM重塑和HSCs激活的关联
GO分析:基于与Sema3C和NRP1结合的交集蛋白进行GO分析,揭示Sema3C在ECM重塑和HSCs激活中的潜在功能。
2. Sema3C对胶原凝胶收缩的影响
凝胶收缩试验:过表达Sema3C的MHCC-97L细胞上清液显著促进胶原凝胶收缩,表明Sema3C参与ECM重塑。
3. Sema3C对原位肝异种移植肿瘤的影响
组织染色:注射MHCC-97L-OE-Sema3C细胞的裸鼠原位肝异种移植肿瘤中,H&E染色、Masson三色染色、Picrosirius红染色及α-SMA和I型胶原的免疫组化染色显示,Sema3C过表达显著增加胶原纤维和α-SMA的比例(n=5)。
4. Sema3C对HSCs的激活作用
免疫荧光染色:HSCs用rhSema3C或过表达Sema3C的上清液处理后,α-SMA和I型胶原的表达显著上调。
Western blot分析:LX-2细胞用rhSema3C或过表达Sema3C的上清液处理后,α-SMA表达水平显著增加。
TGF-β1分泌:ELISA测定显示,Sema3C处理显著增加HSCs中TGF-β1的分泌。
5. Sema3C对HSCs功能的影响
化疗耐药性:MTT试验显示,Sema3C处理显著增强HSCs的化疗耐药性。
迁移和侵袭能力:Transwell试验表明,Sema3C处理显著促进HSCs的迁移和侵袭能力。
6. Sema3C对肿瘤生长的影响
异种移植肿瘤实验:将Hep3B细胞或过表达Sema3C的Hep3B细胞单独或与LX-2细胞混合注射到裸鼠体内,32天后Sema3C过表达组肿瘤重量和体积显著增加(每组n=5)。
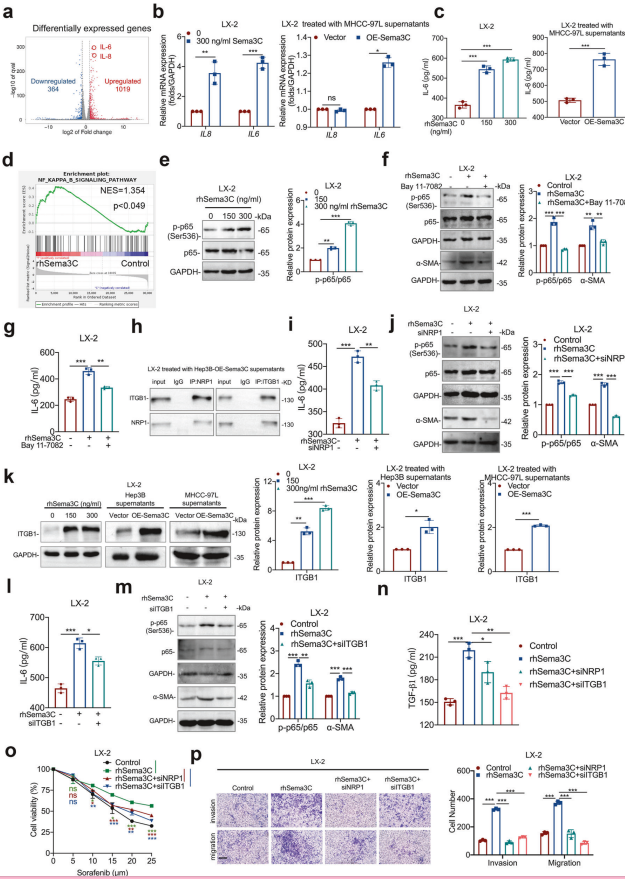
1. Sema3C对HSCs基因表达的影响
火山图分析:LX-2细胞用rhSema3C处理后,差异表达基因显著变化,揭示了Sema3C对HSCs的广泛调控作用。
2. Sema3C对IL-6和IL-8的调控
mRNA水平:rhSema3C或Sema3C过表达的MHCC-97L细胞上清液处理HSCs后,IL6和IL8的mRNA水平显著上调(qRT-PCR检测)。
分泌水平:ELISA检测显示,rhSema3C处理显著增加HSCs中IL6的分泌。
3. Sema3C与NF-κB信号通路的关联
GSEA分析:在rhSema3C处理的LX-2细胞中,NF-κB通路相关基因显著富集。
蛋白表达:Western blotting显示,rhSema3C处理显著增加LX-2细胞中磷酸化p65和总p65的蛋白表达水平。
4. NF-κB抑制剂的作用
蛋白表达:用NF-κB抑制剂Bay 11-7082预处理的LX-2细胞,rhSema3C刺激后磷酸化p65、总p65和α-SMA的表达水平显著降低(Western blotting)。
IL6分泌:Bay 11-7082预处理显著抑制rhSema3C诱导的IL6分泌(ELISA检测)。
5. Sema3C与NRP1和ITGB1的相互作用
共免疫沉淀:LX-2细胞用OE-Sema3C-Hep3B细胞上清液处理后,ITGB1和NRP1之间的相互作用显著增强(Co-IP检测)。
IL6分泌:转染siNRP1的LX-2细胞,rhSema3C刺激后IL6分泌显著减少(ELISA检测)。
蛋白表达:转染siNRP1的LX-2细胞,rhSema3C刺激后磷酸化p65、总p65、α-SMA和HMGCR的表达水平显著降低(Western blotting)。
6. ITGB1的作用
蛋白表达:LX-2细胞用rhSema3C或Sema3C过表达的HCC细胞上清液处理后,ITGB1蛋白表达水平显著上调(Western blotting)。
IL6分泌:转染siITGB1的LX-2细胞,rhSema3C刺激后IL6分泌显著减少(ELISA检测)。
蛋白表达:转染siITGB1的LX-2细胞,rhSema3C刺激后磷酸化p65、总p65和α-SMA的表达水平显著降低(Western blotting)。
7. Sema3C对HSCs功能的影响
TGF-β1分泌:LX-2细胞分别用siNRP1、siITGB1或rhSema3C处理后,TGF-β1的分泌水平显著变化(ELISA检测)。
化疗耐药性:MTT测定显示,rhSema3C处理显著增强LX-2细胞的化疗耐药性。
迁移和侵袭能力:Transwell测定表明,rhSema3C处理显著促进LX-2细胞的迁移和侵袭能力。
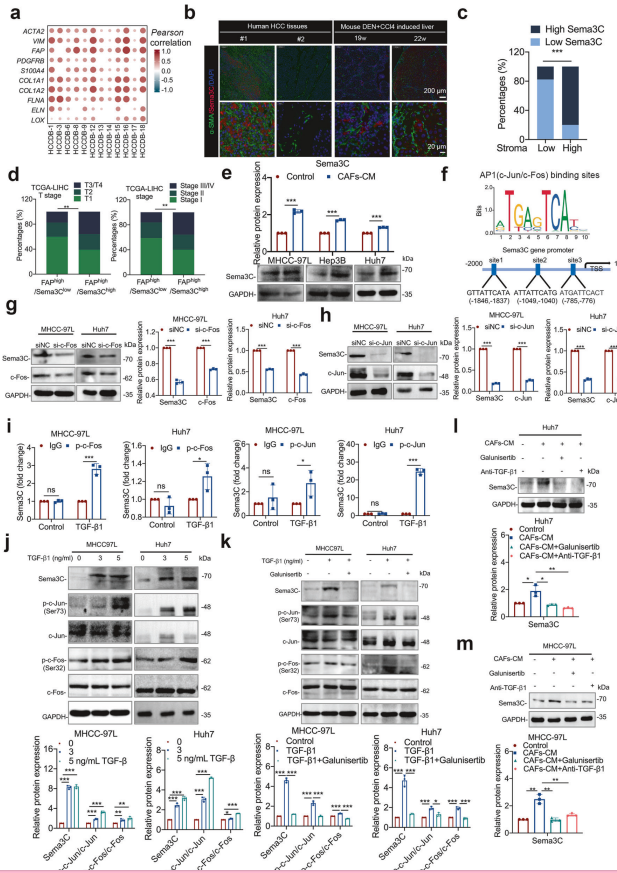
1. Sema3C与CAF相关基因的关联
相关性分析:基于HCCDB数据集,Sema3C表达与CAF相关基因(如ACTA2、VIM、FAP、PDGFRB、S100A4)及胶原相关基因(如COL1A1、COL1A2、FLNA、ELN、LOX)显著正相关。
2. Sema3C与间质浸润的关系
免疫荧光染色:在HCC组织或DEN+CCl4诱导的小鼠肝组织中,高Sema3C表达与高程度间质浸润(α-SMA标记)显著相关。
临床相关性:HCC患者中,高Sema3C表达与间质百分比呈正相关(总n=27)。
3. Sema3C与HCC分期的关系
TCGA-LIHC分析:FAP高/Sema3C高的HCC患者与更晚期的T分期和疾病阶段显著相关。
4. CAF条件培养基对Sema3C表达的影响
Western blotting:CAF条件培养基(CAFs-CM)处理显著增加HCC细胞中Sema3C的表达。
5. Sema3C基因启动子的调控机制
AP1结合位点:Sema3C基因启动子中包含AP1(c-Jun/c-Fos)转录结合位点。
siRNA敲低:转染si-c-Fos或si-c-Jun的MHCC-97L和Huh7细胞中,Sema3C表达显著降低(Western blotting验证)。
ChIP-qPCR分析:TGF-β1刺激促进磷酸化c-Jun(p-c-Jun)和磷酸化c-Fos(p-c-Fos)与Sema3C基因启动子的结合。
6. TGF-β1对Sema3C表达的调控
Western blotting:不同浓度TGF-β1处理的MHCC-97L和Huh7细胞中,Sema3C、p-c-Jun、总c-Jun、p-c-Fos和总c-Fos的表达水平显著上调。
抑制剂作用:galunisertib(TGF-β1受体I抑制剂)和TGF-β1中和抗体(anti-TGF-β1)显著抑制TGF-β1诱导的Sema3C表达和AP1信号激活。
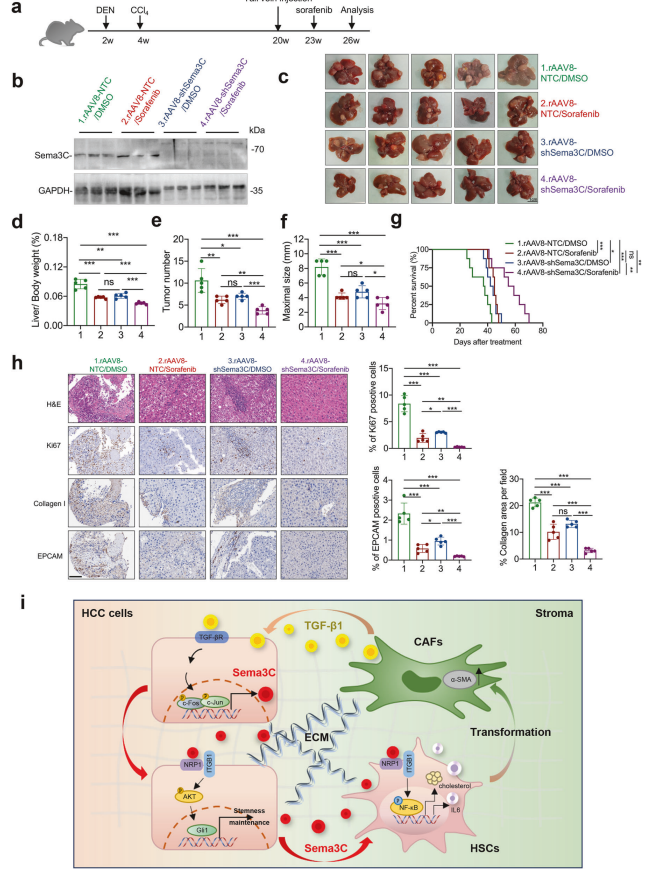
1. 实验设计与模型
HCC模型:采用DEN+CCl4诱导的小鼠HCC模型,并设计了治疗模式的时间点。
2. Sema3C表达检测
Western blotting:在26周后,从小鼠各组中取出肝脏,检测Sema3C的蛋白表达水平。
3. 肝脏表型分析
肝脏图像:26周时各组小鼠肝组织的代表性图像(每组n=5)。
肝/体重比:计算并比较各组小鼠的肝/体重比。
肿瘤数量:统计各组小鼠肝脏中的肿瘤数量。
肿瘤最大尺寸:测量并比较各组小鼠肝脏中肿瘤的最大尺寸。
4. 生存分析
Kaplan-Meier生存曲线:分析并展示各组小鼠的整体存活率百分比(n=8)。
5. 组织学与免疫组化分析
H&E染色:对4个治疗组收获的HCC肿瘤进行H&E染色。
IHC染色:对HCC肿瘤中的Ki67、Collagen I和EpCAM进行免疫组化染色,并进行统计分析(每组n=5)。
6. 机制示意图
Sema3C介导的相互作用:示意图展示了Sema3C在HCC中CSCs与基质之间的相互作用。
Sema3C的作用:
1.在纤维化肝脏、HCC组织、HCC患者外周血以及索拉非尼耐药组织和细胞中显著上调。
2.过表达与HCC干性特性的获得相关。
3.通过NRP1和ITGB1受体激活AKT/Gli1/c-Myc信号通路,增强HCC自我更新和肿瘤起始。
4.促进细胞外基质(ECM)收缩和胶原沉积,刺激肝星状细胞(HSCs)的增殖和激活。
5.通过激活NF-kB信号通路,刺激IL-6释放和HMGCR表达,增强HSCs中的胆固醇合成。
CAFs的作用:
1.CAF分泌的TGF-β1激活AP1信号,增强
HCC细胞中Sema3C的表达,形成正反馈环路,加速HCC进展。
2.CAFs通过直接刺激肿瘤细胞增殖、促进血管生成和重塑微环境支持肿瘤发生。
3.CAFs通过破坏药物传递和生化信号促进化疗耐药。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:LncRNA fam13a-AS1通过靶向miR-141-3p上调NEK6表达促进肾癌发生
下一篇:协同施用HIV-1 Gag编码质粒提升癌症DNA疫苗效能的新策略