常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-03-14 18:31:07 细胞资源库平台 访问量:247
英文标题:LncRNA fam13a-AS1 promotes renal carcinoma tumorigenesis through sponging miR-141-3p to upregulate NEK6 expression.
中文标题:LncRNA fam13a-AS1通过靶向miR-141-3p上调NEK6表达促进肾癌发生
发表期刊:《Frontiers in Molecular Biosciences》
影响因子:5
作者单位:厦门大学医学院附属中山医院泌尿外科、福建医科大学第三临床医学院
作者信息:Xin Jun Wang,Si Li,Jiang Fang,Zhi Jian Yan,Guang Cheng Luo.
肾细胞癌(RCC)是最常见且致死率高的泌尿生殖系统癌症之一。尽管局部RCC可以通过手术切除、放疗或局部消融治疗,但超过30%的患者最终会发展为转移性癌症,需要更复杂的治疗且预后不佳。因此,开发更好的风险评估、诊断和预后模型对于管理RCC变得迫切,这需要对疾病的分子机制有基本的理解。
通过分析TCGA队列中539名RCC患者的基因表达资料和40名独立队列中的RCC患者,识别出FAM13A-AS1这一在RCC患者中上调的长非编码RNA。
利用敲除实验揭示FAM13A-AS1通过与miR-141-3p相互作用促进细胞增殖、迁移和侵袭。
通过克隆、转染、RNA提取、逆转录、实时定量PCR、西方印迹、MTT实验、侵袭和迁移实验、荧光素酶报告基因检测、细胞周期分析、荧光原位杂交(FISH)、动物模型建立和TCGA数据处理等方法进行研究。
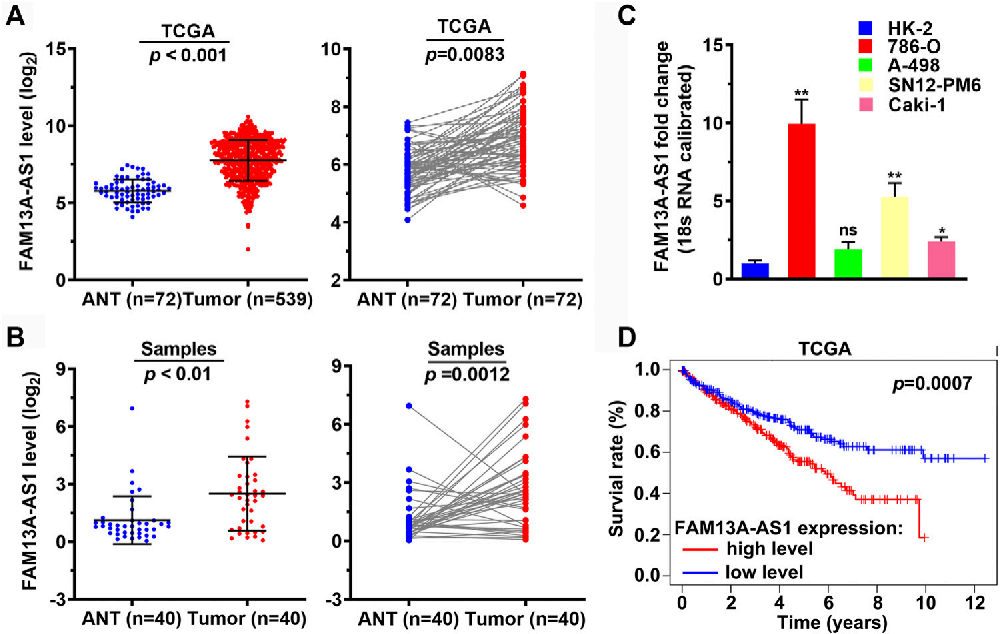
图1. FAM13A-AS1在肾细胞癌(RCC)中上调,并与不良临床结局相关。
(A) 点状图展示了来自TCGA队列的肾细胞癌(n = 539)和正常组织(n = 72)中FAM13A-AS1的表达水平。
(B) 点状图展示了来自我们队列的肾细胞癌(n = 40)和正常组织(n = 40)中FAM13A-AS1的表达水平。
(C) 条形图显示了在人类肾脏上皮细胞和癌细胞系中FAM13A-AS1表达的倍数变化。
(D) 通过Kaplan-Meier分析,展示了根据TCGA-KIRC队列中515名肾细胞癌患者FAM13A-AS1高表达和低表达分组后的总生存率。
要点:
FAM13A-AS1在肾细胞癌中的表达水平上调。
FAM13A-AS1的表达水平与肾细胞癌患者的临床结局不良相关。
研究使用了来自TCGA队列和我们队列的数据进行分析。
通过Kaplan-Meier曲线展示了FAM13A-AS1表达水平与患者生存率之间的关系。
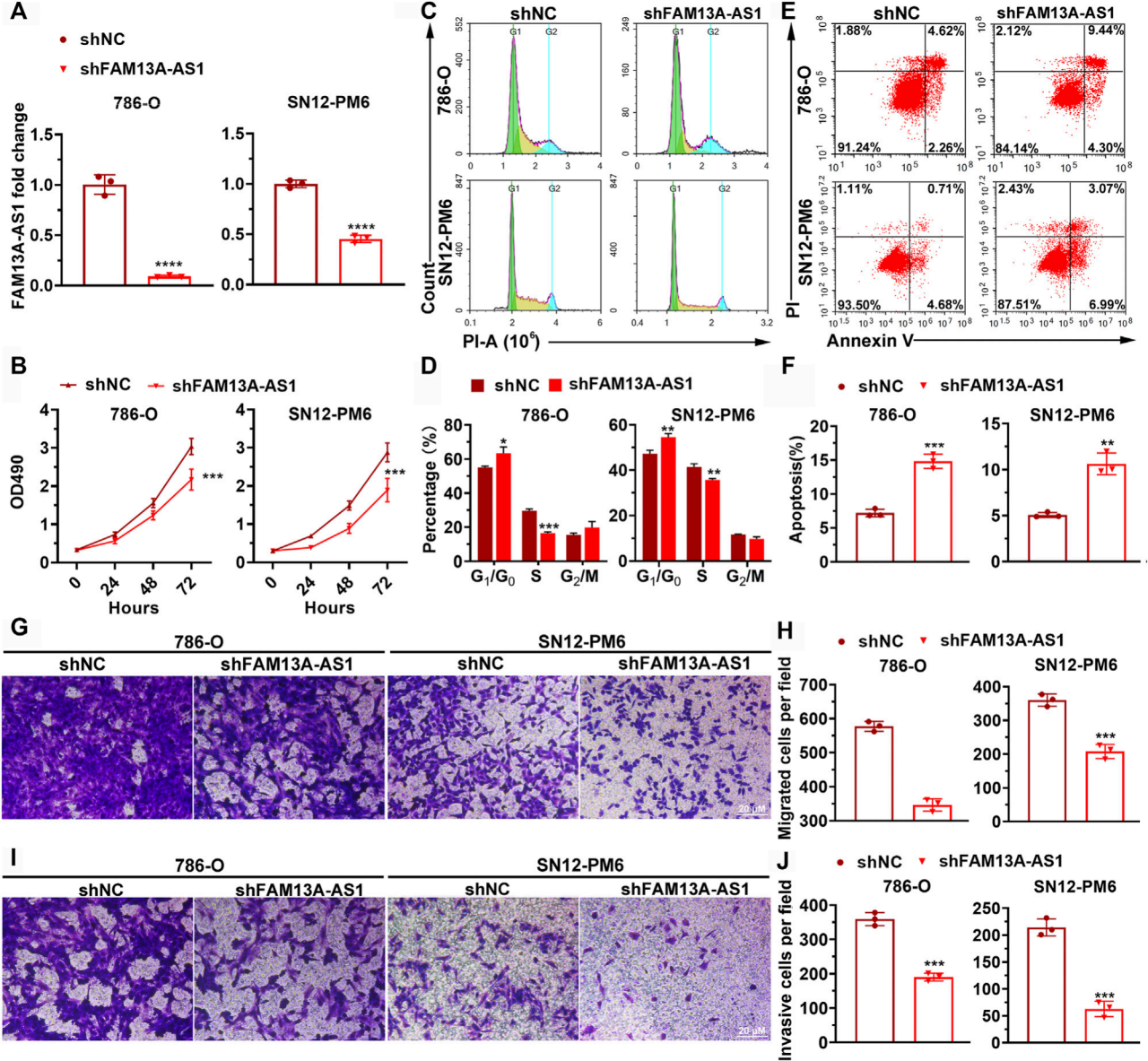
图2. FAM13A-AS1促进肾细胞癌(RCC)细胞增殖、迁移和侵袭。
(A) 条形图显示了针对FAM13A-AS1的shRNA敲低效率。表达水平通过RT-qPCR测量,并以18S rRNA的表达水平为基准进行校准。表达水平的变化与对照序列进行比较计算。
(B) 经过shFAM13A-AS1转染或对照序列处理的RCC细胞的MTT实验。(C,D) 经过shFAM13A-AS1或对照序列处理的RCC细胞周期分布的代表性行星图(C)和量化(D)。(C)中的X轴和Y轴分别代表DNA含量和细胞数量。
(E,F) 经过shFAM13A-AS1或对照序列处理的RCC细胞的Annexin V/PI双参数流式细胞术分析的点图(E)和条形图(F)。条形图(F)显示了发生凋亡的细胞百分比。
(G,H) 经过shFAM13A-AS1或对照序列处理的RCC细胞Transwell迁移实验的代表图像(G)和量化(H)。
(I,J) 经过shFAM13A-AS1或对照序列处理的RCC细胞Matrigel侵袭实验的代表图像(I)和量化(J)。
数据代表平均值 ± 标准差。**:p < 0.01; ***:p < 0.001; ****:p < 0.0001。
要点:
FAM13A-AS1能够促进肾细胞癌细胞的增殖、迁移和侵袭。
通过shRNA敲低FAM13A-AS1,并使用RT-qPCR方法评估了敲低效率。
MTT实验用于评估增殖情况。
流式细胞术和Annexin V/PI染色用于分析细胞凋亡。
Transwell迁移实验用于评估细胞迁移能力。
Matrigel侵袭实验用于评估细胞侵袭能力。
所有实验数据均以平均值 ± 标准差表示,并进行了统计学显著性分析。
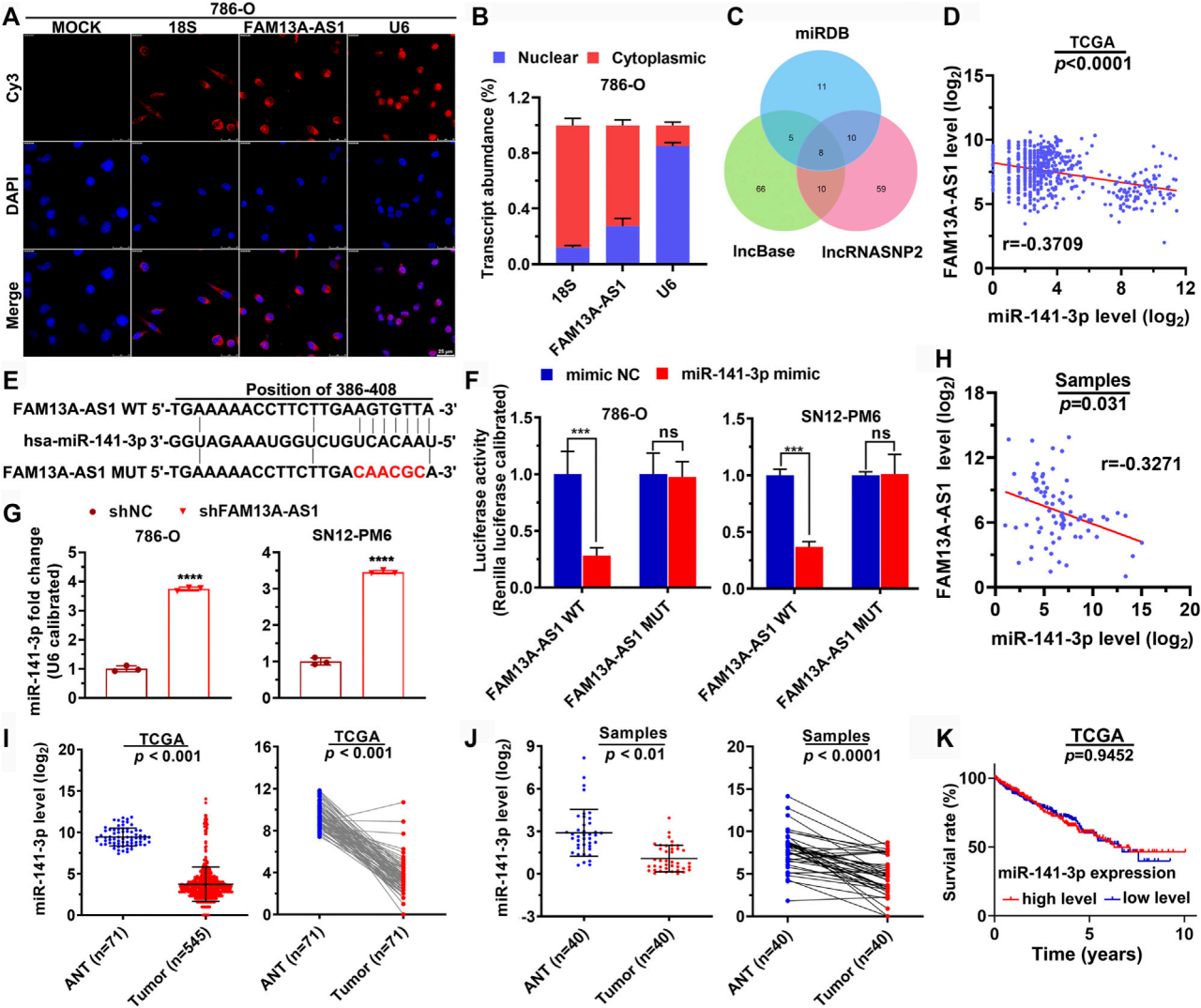
图3. FAM13A-AS1作为竞争性内源RNA(ceRNA)与miR-141-3p竞争结合。
(A,B) FISH实验(A)和RT-qPCR(B)显示了RCC细胞中FAM13A-AS1的亚细胞表达(核和细胞质),以18S和U6作为内源对照。
(C) 韦恩图显示了计算机预测的FAM13A-AS1相互作用的miRNAs之间的交集。
(D) 点状图显示了miR-141-3p(Y轴)与TCGA队列中FAM13A-AS1(X轴)之间的共表达模式。
(E) 示意图显示了预测的miR-141-3p在FAM13A-AS1野生型转录本中的结合位点,以及FAM13A-AS1突变体逃避miR-141-3p结合的情况。红色核苷酸代表目标位点的突变。
(F) 条形图显示了RCC细胞共转染野生型(WT)或突变型(MUT) FAM13A-AS1质粒与miR-141-3p模拟物或阴性对照(ND)后的荧光素酶活性。
(G) 条形图显示了转染shFAM13A-AS1或阴性对照(ND)的RCC细胞中miR-141-3p的表达。表达水平通过RT-qPCR测量。
(H) 点状图显示了我们的队列中miR-141-3p(Y轴)与FAM13A-AS1(X轴)之间的共表达模式。
(I,J) 点状图显示了来自TCGA队列(H)和我们自己的队列(I)的RCC患者的正常和肿瘤组织中miR-141-3p的表达。
(K) 通过TCGA队列中的miR-141-3p表达对RCC患者总生存率的Kaplan-Meier分析。
数据代表平均值 ± 标准差。***:p < 0.001; ****:p < 0.0001。
要点:
FAM13A-AS1在RCC细胞中作为ceRNA,与miR-141-3p竞争结合。
使用FISH和RT-qPCR方法研究了FAM13A-AS1在细胞核和细胞质中的表达。
通过计算方法确定了与FAM13A-AS1相互作用的miRNAs。
在TCGA队列中研究了miR-141-3p与FAM13A-AS1的共表达模式。
预测了miR-141-3p在FAM13A-AS1野生型转录本中的结合位点,并研究了突变体对结合的影响。
通过荧光素酶报告实验验证了FAM13A-AS1与miR-141-3p的相互作用。
在我们的队列中验证了FAM13A-AS1和miR-141-3p之间的共表达关系。
分析了miR-141-3p在RCC患者正常和肿瘤组织中的表达。
通过aplan-Meier分析,研究了miR-141-3p表达水平与RCC患者总生存率的关系。
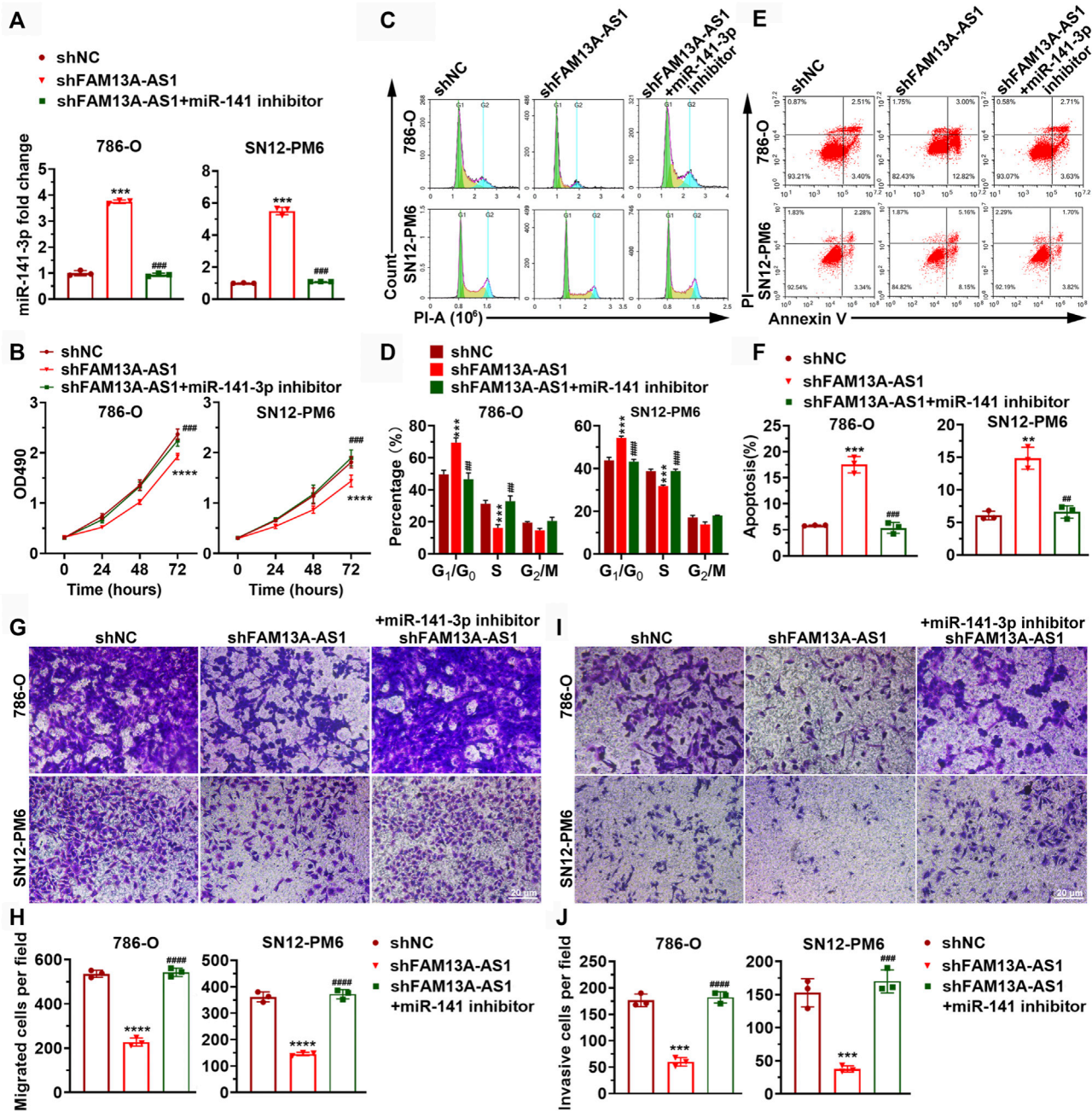
图4. miR-141-3p抑制肾癌细胞增殖、迁移和侵袭。
(A) 条形图显示了RCC细胞共转染shFAM13A-AS1或对照序列后,经miR-141-3p处理的miR-141-3p表达水平。
(B) RCC细胞转染shFAM13A-AS1后,分别用miR-141-3p抑制剂或阴性对照处理的MTT实验。
(C,D) RCC细胞增殖实验的代表图像(C)和量化(D)。EdU阳性细胞:绿色。细胞核:蓝色。(C,D) RCC细胞周期分布的代表性行星图(C)和量化(D)。(C)中的X轴和Y轴分别代表DNA含量和细胞数量。条形图(D)显示了不同细胞周期阶段细胞的百分比。
(E,F) RCC细胞的Annexin V/PI双参数流式细胞术分析的代表点图(E)和量化(F)。下方条形图显示了发生凋亡的细胞百分比。RCC细胞系转染了shFAM13A-AS1或对照序列,并经miR-141-3p抑制剂处理。
(G,H) RCC细胞转染或经miR-141-3p抑制剂处理后Transwell迁移实验的代表图像(G)和量化(H)。
(I,J) 上述细胞的Matrigel侵袭实验的代表图像(I)和量化(J)。
数据代表平均值 ± 标准差。***:p < 0.001; ****:p < 0.0001。
要点:
miR-141-3p能够抑制肾癌细胞的增殖、迁移和侵袭。
通过共转染实验评估了miR-141-3p在RCC细胞中的表达水平。
使用MTT实验来评估细胞的增殖情况。
通过细胞增殖实验和细胞周期分析来研究细胞增殖和周期分布。
使用流式细胞术和Annexin V/PI染色来分析细胞凋亡。
通过Transwell迁移实验来评估细胞迁移能力。
通过Matrigel侵袭实验来评估细胞侵袭能力。
所有实验数据均以平均值 ± 标准差表示,并通过统计学分析确定了显著性差异。

图5. FAM13A-AS1通过吸附miR-141-3p来上调其靶标NEK6。
(A) 集合图显示了五组计算机预测的miR-141-3p靶基因之间的交集。
(B) 在TCGA队列和我们的队列中,NEK6与miR-141-3p或FAM13A-AS1表达之间的相关性。
(C) 示意图显示了预测的miR-141-3p在NEK6野生型3'UTR中的结合位点,以及突变型逃避miR-141-3p结合的情况。红色核苷酸代表目标位点的突变。
(D) 条形图显示了786-O和SN2-PM6细胞共转染野生型(WT)或突变型(MUT) NEK6质粒与miR-141-3p模拟物或阴性对照(ND)后的荧光素酶活性。
(E,F) 条形图(E)和印迹图像(F)显示了786-O和SN2-PM6细胞转染miR-141-3p模拟物或阴性对照(ND)后,通过RT-qPCR和西方印迹分析得到的NEK6的mRNA和蛋白质水平。
数据代表平均值 ± 标准差。**: p < 0.01; ***: p < 0.001; ****: p < 0.0001。
要点:
FAM13A-AS1能够吸附miR-141-3p,从而上调其靶基因NEK6的表达。
通过计算机分析确定了miR-141-3p的多个预测靶基因,并找到了它们之间的交集。
在TCGA队列和我们的队列中分析了NEK6与miR-141-3p或FAM13A-AS1表达的相关性。
预测了miR-141-3p在NEK6的3'UTR中的结合位点,并研究了突变型对结合的影响。
通过荧光素酶报告实验验证了NEK6与miR-141-3p的相互作用。
通过RT-qPCR和西方印迹分析研究了NEK6在转染miR-141-3p模拟物后的mRNA和蛋白质表达水平。
实验数据以平均值 ± 标准差表示,并通过统计学分析确定了显著性差异。
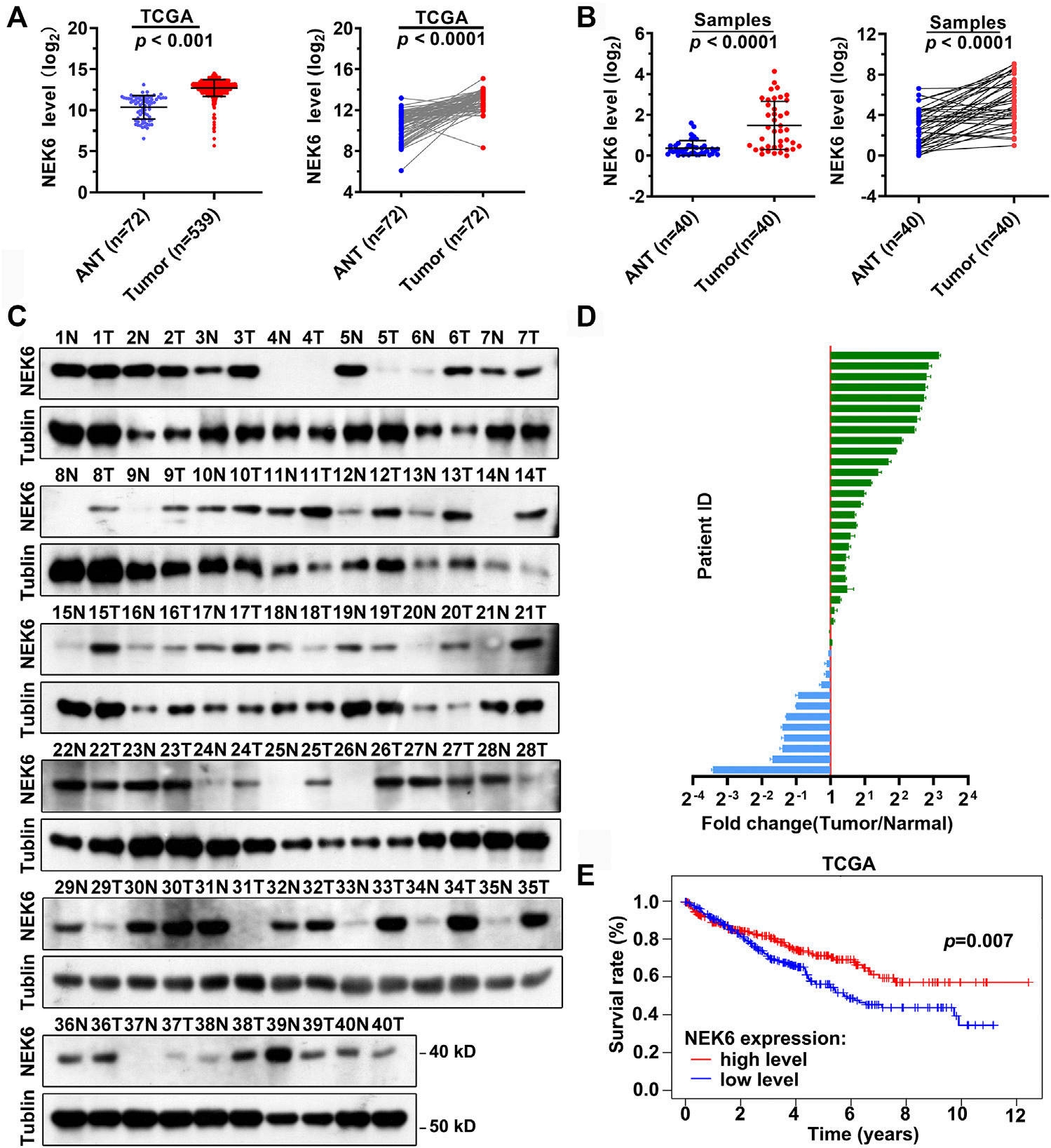
图6. RCC中NEK6表达水平的升高。
(A) 点状图显示了来自TCGA队列的肾细胞癌(n = 539)和正常组织(n = 72)中NEK6的表达。
(B) 点状图显示了来自我们队列的肾细胞癌(n = 40)和正常组织(n = 40)中NEK6的表达水平。
(C,D) 印迹图像(C)和量化(D)展示了我们队列中的肾细胞癌和正常组织中NEK6的蛋白质水平。
(E) 通过TCGA队列中的NEK6表达对肾细胞癌患者总生存率的Kaplan-Meier分析。
要点:
在肾细胞癌中NEK6的表达水平升高。
使用TCGA队列的数据,比较了肾细胞癌和正常组织中NEK6的表达水平。
使用我们自己的队列数据,进一步验证了肾细胞癌和正常组织中NEK6的表达水平。
通过蛋白质印迹分析,研究了NEK6在我们队列的肾细胞癌和正常组织中的蛋白质水平。
通过Kaplan-Meier分析,研究了NEK6表达水平与肾细胞癌患者总生存率之间的关系。
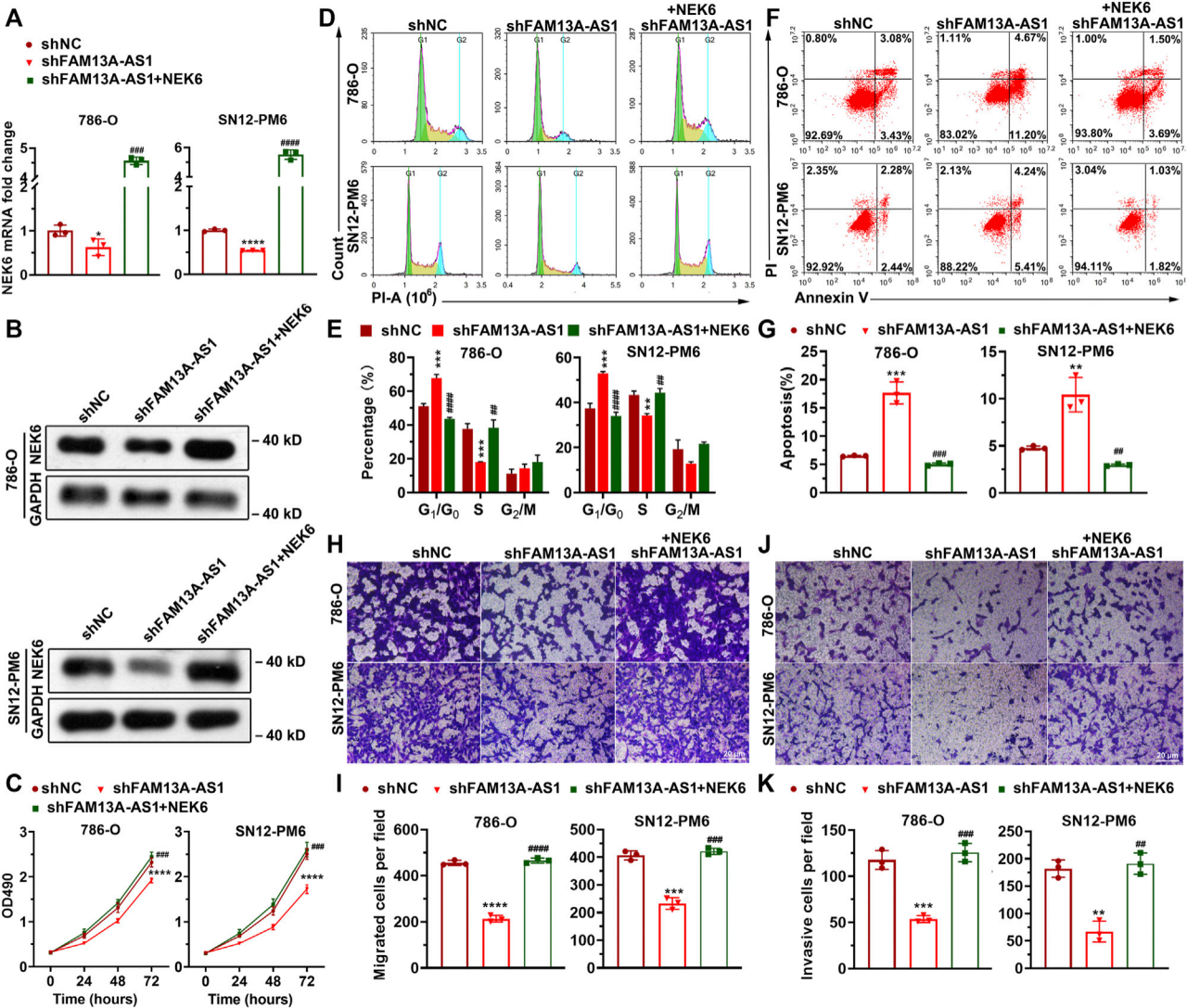
图7. NEK6负责FAM13A-AS1介导的细胞增殖、迁移和侵袭。
(A) 条形图显示了在786-O和SN12-PM6细胞中转染shFAM13A-AS1或阴性对照(shNC),同时转染空载体或NEK6过表达质粒后NEK6的表达。表达水平通过RT-qPCR测量,表达变化倍数以对照序列为基准计算。
(B) 印迹图像显示了上述细胞中NEK6的蛋白质水平。
(C) 786-O和SN12-PM6细胞转染shFAM13A-AS1或阴性对照(shNC),同时转染空载体或NEK6过表达质粒后的MTT实验。
(D–K) 代表性图像和量化数据展示了786-O和SN12-PM6细胞转染shFAM13A-AS1或阴性对照(shNC),同时转染空载体或NEK6过表达质粒后的细胞周期分布流式细胞术分析(D,E)、Annexin V/PI双参数流式细胞分析(F,G)、Transwell迁移实验(H,I)和Matrigel侵袭实验(G,K)。
数据代表平均值 ± 标准差。*: p < 0.05; **: p < 0.01; ***: p < 0.001; ****: p < 0.0001。
要点:
NEK6是FAM13A-AS1介导的细胞增殖、迁移和侵袭的关键因子。
通过RT-qPCR和蛋白质印迹分析了NEK6在转染FAM13A-AS1干扰序列和NEK6过表达质粒后的表达水平。
使用MTT实验评估了细胞增殖情况。
通过流式细胞术分析了细胞周期分布和细胞凋亡情况。
通过Transwell迁移实验和Matrigel侵袭实验评估了细胞迁移和侵袭能力。
实验结果通过统计学分析确定了显著性差异。
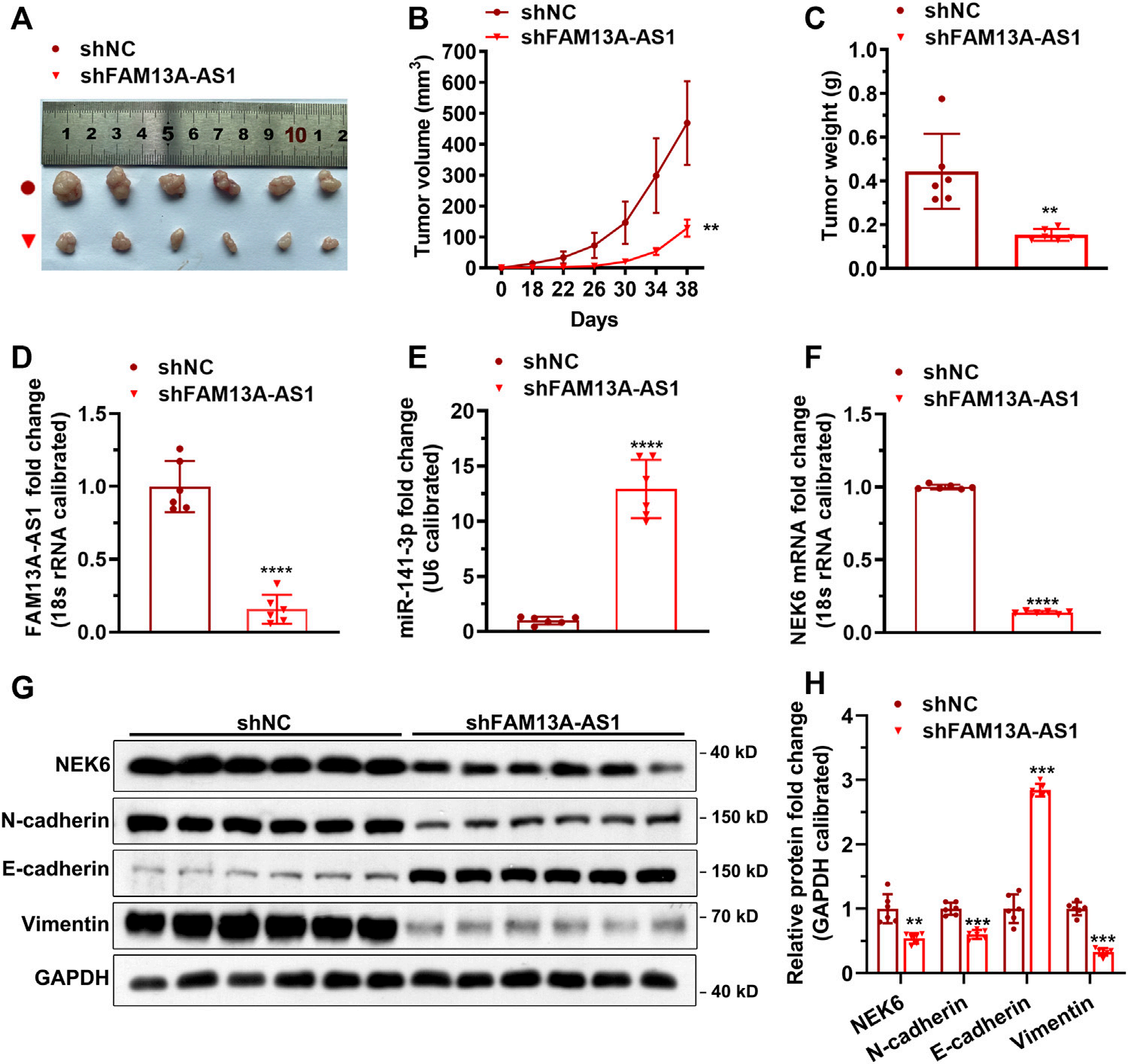
图8. FAM13A-AS1在体内促进肿瘤生成。
(A-C) 通过将上述786-O细胞移植到裸鼠中构建了异种移植肿瘤模型,展示了代表性图像(A)、肿瘤体积的测量(B)和肿瘤重量(C)。
(D-F) 通过RT-qPCR,以18S rRNA或U6的表达水平为基准,展示了肿瘤中FAM13A-AS1(D)、miR-141-3p(E)和NEK6(F)的表达。表达变化倍数以对照序列为基准计算。
(G,H) 肿瘤组织蛋白质水平的印迹图像(G)和量化(H)(n = 6)。
数据代表平均值 ± 标准差。**: p < 0.01; ***: p < 0.001; ****: p < 0.0001。
要点:
FAM13A-AS1在体内实验中促进了肿瘤的生成。
使用786-O细胞在裸鼠中建立了异种移植肿瘤模型,并通过图像、体积测量和重量测量来评估肿瘤的生长情况。
通过RT-qPCR方法,研究了肿瘤组织中FAM13A-AS1、miR-141-3p和NEK6的表达水平。
通过蛋白质印迹分析,研究了肿瘤组织中蛋白质水平的变化。
实验数据以平均值 ± 标准差表示,并通过统计学分析确定了显著性差异。
长非编码RNA在肿瘤发生中具有重要作用,但其在肾细胞癌中的具体作用和机制尚不清楚。
通过对TCGA队列和独立队列的RCC患者基因表达数据分析,发现FAM13A-AS1在RCC中表达上调。
FAM13A-AS1通过与miR-141-3p相互作用,促进RCC细胞的增殖、迁移和侵袭。
FAM13A-AS1通过诱骗miR-141-3p来调节NEK6的表达,与NEK6表达呈正相关。
研究揭示了FAM13A-AS1在RCC中的致癌作用,及其通过竞争性结合miR-141-3p促进肿瘤生成的机制。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
下一篇:南大学医学院等联合发表:东Semaphorin 3C(Sema3C)重塑肿瘤基质微环境,促进肝细胞癌进展