常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-03-14 13:44:47 细胞资源库平台 访问量:469
同源异体小鼠肿瘤模型是免疫肿瘤学(I/O)研究中不可或缺的临床前模型,但它们对免疫检查点抑制剂(ICIs)的反应有限,这可能是由于它们的固有低免疫原性。为了解决这一问题,研究人员通过将鸡卵清蛋白(OVA)这一高度免疫原性的蛋白质表达到同源异体肿瘤细胞中,开发了新的免疫原性同源异体模型。这些模型,如CT26-OVA和B16-OVA,显示出比它们的亲本细胞系更慢的肿瘤生长速度,这可能是由于免疫介导的排斥反应。更重要的是,这些OVA表达的模型对ICIs,特别是抗PD-1治疗,表现出更高的敏感性,这表明它们在增强T细胞介导的免疫反应方面具有潜力。此外,通过过继T细胞转移实验,研究人员验证了这些模型中存在肿瘤特异性记忆T细胞。这些结果表明,OVA工具细胞不仅增强了对ICIs的反应,而且为临床前免疫治疗评估提供了新的、具有更高免疫原性的同源异体模型,这对于I/O研究具有重要的意义。
英文标题:Stereotactic Radiation Therapy Augments Antigen-Specific PD-1-Mediated Antitumor Immune Responses via Cross-Presentation of Tumor Antigen.
中文标题:立体定向放射治疗通过肿瘤抗原的交叉呈递增强抗原特异性PD-1介导的抗肿瘤免疫反应。
发表期刊:《Cancer Immunology Research》
影响因子:8.2
作者单位:
1. 放射肿瘤学和分子辐射科学系,约翰霍普金斯大学医学院,马里兰州巴尔的摩。
2. 肿瘤学系,约翰霍普金斯大学医学院,马里兰州巴尔的摩。
3. 布雷迪泌尿学研究所,约翰霍普金斯大学医学院,马里兰州巴尔的摩。
4. 分子生物学和遗传学系,约翰霍普金斯大学医学院,马里兰州巴尔的摩。
作者信息:Andrew B, Sharabi,Christopher J.Nirsch,Christina M. Koche,Thomas R. Nirsch.
近年来,放射治疗(XRT)的免疫调节效应引起了广泛关注,尤其是其与免疫治疗的协同作用。尽管已有研究指出这种协同作用,但临床前研究仍需进一步证实放疗诱导的免疫反应的抗原特异性,并阐明其与免疫治疗的潜在协同机制。利用小动物放射研究平台(SARRP),研究人员探究了立体定向放射治疗(SRT)与抗PD-1检查点阻断免疫疗法结合时,对内源性抗原特异性免疫反应的诱导能力。通过对B16-OVA黑色素瘤和4T1-HA乳腺癌肿瘤进行影像引导的SRT,研究发现这种联合疗法能够促进抗原特异性T细胞和B细胞介导的免疫反应。当放疗与抗PD-1治疗或调节性T细胞(Treg)耗竭相结合时,其免疫刺激效果显著增强,改善了局部肿瘤控制。研究还发现放疗能够上调肿瘤相关抗原-MHC复合物,增强肿瘤引流淋巴结中的抗原交叉呈递,并促进T细胞向肿瘤的浸润。这些结果不仅证明了放疗能够启动内源性抗原特异性免疫反应,而且为临床上将放射治疗与PD-1阻断结合提供了额外的机制理论基础。该研究成果发表在《Cancer Immunology Research》杂志上,是2014年美国癌症研究协会(AACR)的重要成果之一。
在本研究中,作者使用了包括C57BL/6、BALB/cJ和MHC class I knockout在内的多种小鼠品系进行实验,其中OT1-Rag knockout小鼠在室内繁殖。所有动物实验均在特定病原体自由设施中进行,并获得了约翰霍普金斯大学医学院动物护理和使用委员会的批准。实验涉及的细胞系包括MC38-OVA、B16-OVA黑色素瘤细胞、4T1-HA乳腺癌细胞和B3Z T细胞杂交瘤,这些肿瘤细胞系在使用前均经过了Mycoplasma检测和模型抗原表达的确认。我们采用了流式细胞术、细胞内细胞因子染色和细胞因子分析等技术,使用特定克隆的荧光标记抗体对来自脾脏、腹股沟淋巴结和肿瘤的单细胞悬液进行染色和分析。此外,通过B3Z实验评估了交叉呈递能力,将不同剂量辐射处理后的B16-OVA细胞与B3Z细胞或整个脾细胞共培养,并利用ELISA测定IL2浓度。我们还进行了细胞过继转移实验和CFSE标记,将OT1-Rag knockout小鼠的T细胞标记后注入小鼠体内,并通过流式细胞术进行分析。小鼠血清中的抗体通过Anti-Ovalbumin IgG1 Mouse EIA Kit进行分析。B16-OVA黑色素瘤和4T1-HA乳腺癌模型用于进行肿瘤生长实验,并制备肿瘤浸润性淋巴细胞(TIL)。体内实验使用SARRP进行,对已形成可触及肿瘤的小鼠进行CT成像引导的定位和放射治疗。最后,使用Prism 5软件进行统计分析,采用未配对的双尾t检验,以P值小于0.05、0.01和0.001作为统计学显著性的标准。
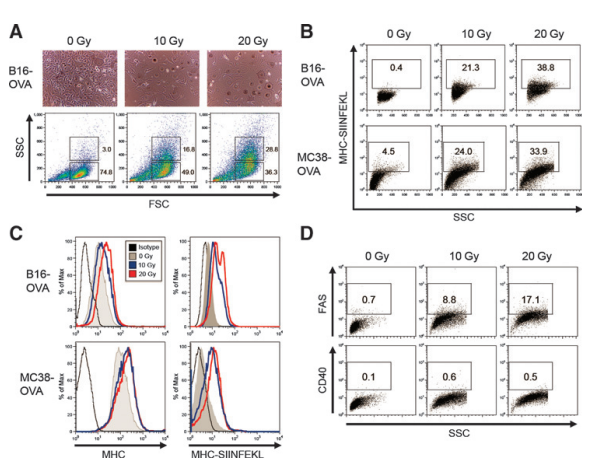
图1. 放射治疗增强B16-OVA黑色素瘤和MC38-OVA结直肠癌中肿瘤相关抗原的MHC呈递。
实验中,B16-OVA黑色素瘤细胞在辐射后48小时通过光学显微镜和流式细胞术(前向散射和侧向散射图)进行了观察。此外,通过流式细胞术分析了辐射后48小时的B16-OVA和MC38-OVA细胞培养物,使用特定的抗小鼠SIINFEKL/H-2Kb抗体进行染色,并记录了相应的流式细胞图和百分比数据。实验还包括了辐射细胞与同型对照、H-2Kb或SIINFEKL/H-2Kb抗体染色的直方图分析,以及辐射细胞使用抗小鼠FAS或CD40抗体染色的流式细胞图。这些实验重复了三次,每次都得到了相似的结果。
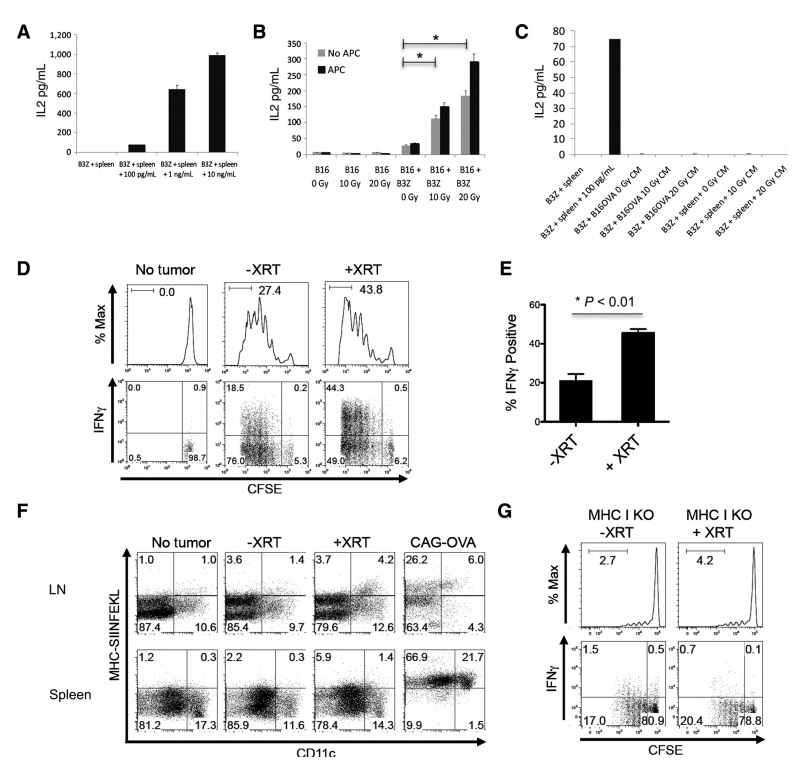
图2.放射治疗促进肿瘤抗原呈递和引流淋巴结中抗原特异性T细胞的增殖与激活。
放射治疗(XRT)增强了肿瘤抗原的细胞介导呈递,并导致引流淋巴结(DLN)中抗原特异性T细胞的增殖和激活增加。具体实验包括:A. B3Z细胞与脾细胞共培养16小时后,上清液中IL2的ELISA浓度,有无OVA肽段的不同浓度。B. 未处理(0 Gy)或辐射处理(10或20 Gy)的B16-OVA黑色素瘤细胞单独或与B3Z细胞或整个脾细胞作为APC共培养的上清液中IL2浓度;实验重复三次,结果相似(P < 0.05)。C. B3Z细胞有无脾细胞共培养,加入不同浓度的OVA肽段,或与未处理或辐射处理的B16-OVA细胞的无细胞条件培养基(CM)共培养后的上清液中IL2浓度。D. 从DLNs中采集的体外CFSE标记的OT1 T细胞的流式直方图和点图;三个独立实验的代表结果(每组n = 4)。E. OT1 T细胞中IFNg阳性率的变化(Student t test; P < 0.01)。F. 从非肿瘤携带或B16-OVA肿瘤携带小鼠,或CAG-OVA小鼠(通过β-actin启动子持续表达OVA)中分离的体外CD11b+CD11c+ DCs的点图;三个独立实验的代表结果。G. 从未处理或辐射处理的MHC Class I knockout小鼠(携带B16-OVA肿瘤)中采集的体外CFSE标记的OT1 T细胞的流式直方图和点图;实验重复两次,结果相似。
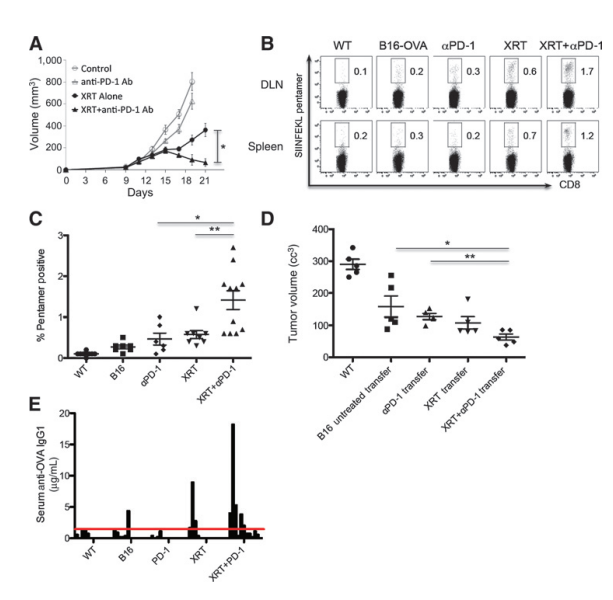
图3. 立体定向放射治疗联合抗PD-1免疫疗法显著提高肿瘤控制并增强抗原特异性T细胞和B细胞介导的抗肿瘤免疫反应。
本研究探讨了立体定向放射治疗(Stereotactic XRT)与抗PD-1免疫疗法联合应用对肿瘤控制和抗原特异性T细胞及B细胞介导的抗肿瘤免疫反应的影响。A部分研究了接种3×10^5 B16-OVA肿瘤细胞的小鼠(每组n=8),在第12天接受12 Gy的单次放射治疗和/或在放射治疗前1天开始接受200毫克抗PD-1抗体的腹腔注射,之后每3天一次,共三次注射;实验重复三次,结果相似。B部分分析了在第10天从野生型(非肿瘤携带)或B16-OVA肿瘤携带小鼠中分离出的CD8+ SIINFEKL Pentamer+ T细胞的百分比,这些小鼠接受了指定的治疗;代表了三个独立实验的结果。C部分的散点图显示了接受XRT加抗PD-1抗体治疗的小鼠中SIINFEKL Pentamer+ T细胞显著增加(P < 0.05;P < 0.01)。D部分测量了在第18天接受12×10^6静脉转移脾细胞的野生型小鼠的肿瘤体积,这些脾细胞来自接受了指定治疗的小鼠(在第14天采集),随后在第15天接受2×10^5 B16-OVA细胞的肿瘤挑战。E部分通过OVA抗体ELISA测量了接受指定治疗的小鼠(每组n=8-11只,放射治疗后第14天采集)血清中抗OVA IgG1的浓度。
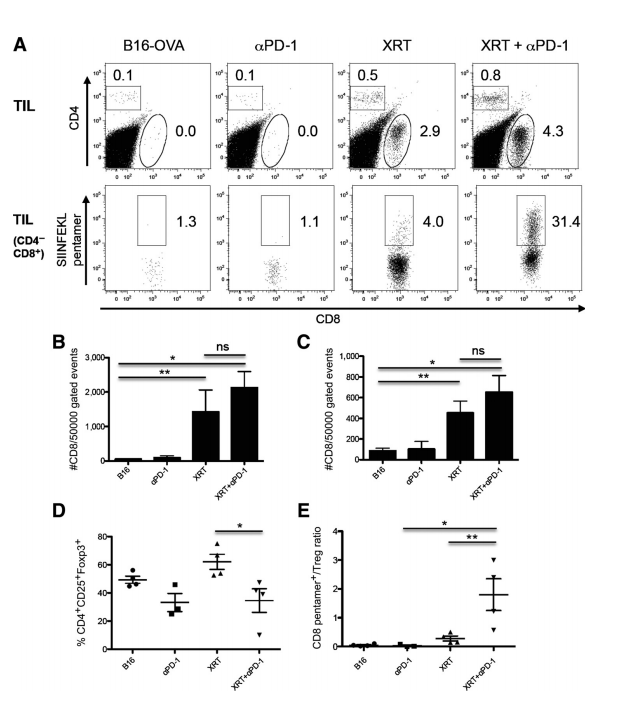
图4. 单剂量立体定向放射治疗(XRT)诱导肿瘤浸润性淋巴细胞(TILs)并与抗PD-1检查点阻断协同作用。
本研究评估了单剂量立体定向放射治疗(XRT)对肿瘤浸润性淋巴细胞(TILs)的影响以及其与抗PD-1检查点阻断的协同效应。A部分展示了从接受指定治疗的肿瘤携带小鼠中在第14天分离出的TILs的点图,分别显示了CD4与CD8(上部)以及SIINFEKL Pentamer+与CD8(下部)的分布,这些结果代表了三个独立实验的典型结果。B和C部分,对接受XRT和抗PD-1抗体治疗的小鼠中CD8和CD4 TILs的绝对数量显著增加进行了量化分析。D部分描述了在治疗组中TILs中CD4+ CD25+ Foxp3+调节性T细胞(Tregs)的百分比变化。E部分显示了在接受XRT加抗PD-1抗体治疗的小鼠的TILs中,CD8+ Pentamer+效应T细胞与CD4+ CD25+ Foxp3+ Tregs的比率显著增加(P < 0.01;P < 0.05;ns,无统计学意义)。这些结果表明,单剂量XRT能够诱导TILs,并与抗PD-1检查点阻断治疗产生协同效应,增强抗肿瘤免疫反应。
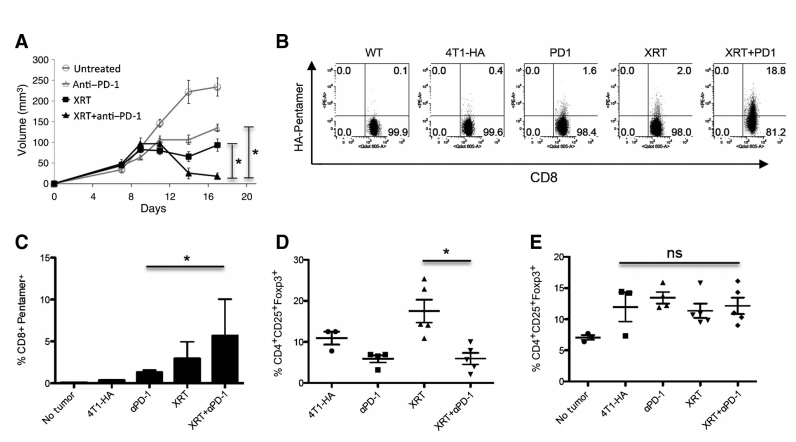
图5. 立体定向放射治疗联合抗PD-1免疫疗法显著改善4T1-HA肿瘤控制并增强抗原特异性T细胞的发展。
本研究探讨了立体定向放射治疗(Stereotactic XRT)与抗PD-1免疫疗法联合应用对4T1-HA肿瘤控制的影响及其对抗原特异性T细胞发展的促进作用。A部分观察了接种1×10^6 4T1-HA细胞的小鼠在第9天接受放射治疗(12 Gy一次)和/或从放射治疗前1天开始接受200毫克抗PD-1抗体的腹腔注射,之后每3天一次,共三次注射的肿瘤体积变化;代表了两个独立实验的结果。B部分分析了在第14天从野生型或4T1-HA肿瘤携带小鼠的引流淋巴结(DLNs)中分离出的CD8+ HA Pentamer+ (H2-Kd IYSTVASSL)细胞的百分比;代表了两个独立实验的结果。C部分量化了接受XRT和抗PD-1免疫疗法的小鼠中CD8+ Pentamer+细胞数量的增加。D部分描述了在接受指定治疗的4T1-HA肿瘤携带小鼠的肿瘤浸润性淋巴细胞(TILs)中CD4+ CD25+ Foxp3+调节性T细胞(Tregs)的变化。E部分显示了在DLNs中CD4+ CD25+ Foxp3+ Tregs没有显著变化;代表了两个独立实验的结果。
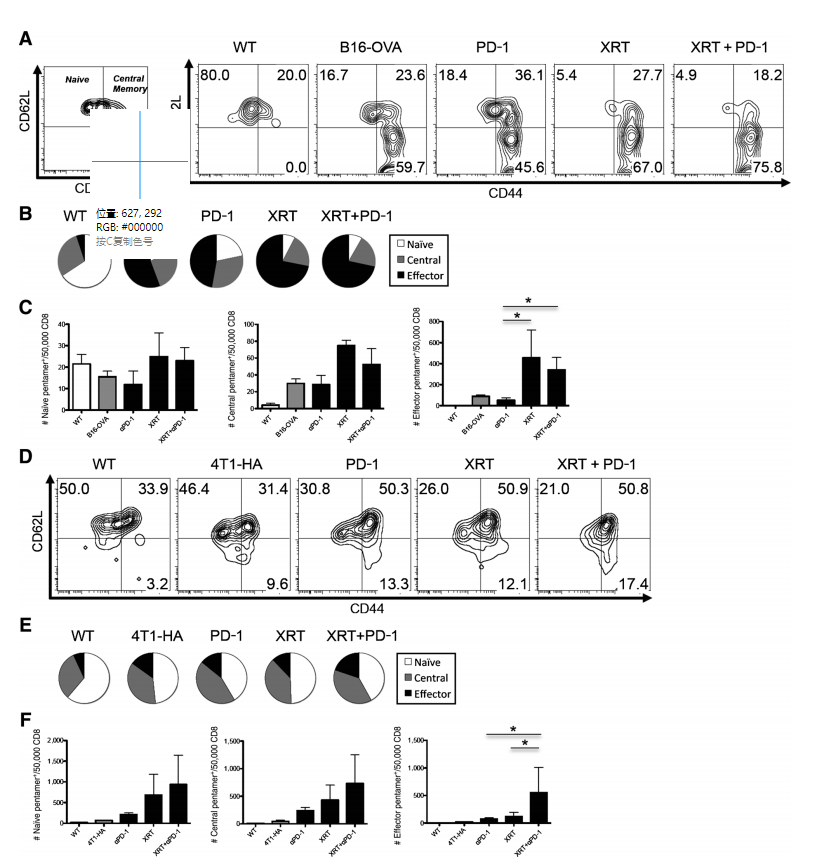
图6.单剂量立体定向放射治疗(XRT)减少淋巴结中抗原特异性T细胞的初始比例并增加效应记忆T细胞。
本研究探讨了单剂量立体定向放射治疗(XRT)对肿瘤特异性T细胞的影响,特别是在淋巴结中的分布变化。A部分展示了从野生型或B16-OVA肿瘤携带小鼠的淋巴结中分离出的CD4- CD8+ SIINFEKL Pentamer+内源性T细胞的流式细胞图,这些小鼠在第14天接受了指定的治疗,结果代表了三个独立实验。B部分的饼图显示了治疗组中记忆细胞群体的相对百分比。C部分量化了野生型或B16-OVA治疗组淋巴结中初始、中心记忆和效应记忆T细胞的绝对数量。D至F部分分别展示了从4T1-HA肿瘤携带小鼠中分离出的CD4- CD8+ IYSTVASSL Pentamer+ T细胞的记忆图表,代表了两个独立实验的结果。这些数据表明,XRT能够减少淋巴结中初始抗原特异性T细胞的比例,并增加抗原特异性效应记忆T细胞的数量。
放射治疗(XRT)通过多种机制增强了肿瘤抗原的呈递和特异性T细胞反应,从而提升了抗肿瘤免疫效果。具体来说,XRT处理显著增加了B16黑色素瘤和MC38结直肠癌细胞系对模型抗原(OVA或HA)的呈递。体外实验中,XRT增强了肿瘤细胞的直接抗原呈递能力,使得B3Z杂交瘤细胞能更有效识别这些细胞。在体内环境中,XRT通过交叉呈递进一步增强了肿瘤抗原的T细胞识别,导致B16-OVA肿瘤处理后引流淋巴结中抗原特异性T细胞显著增殖。此外,无论是单独使用XRT还是与抗PD-1治疗结合,都能增强抗原特异性CD8 T细胞和B细胞的启动,尤其在肿瘤引流淋巴结和脾脏中OVA特异性T细胞的数量显著增加。XRT与PD-1阻断的联合治疗还增加了已建立的B16和4T1肿瘤中内源性T细胞的浸润,以及肿瘤特异性CD8 T细胞记忆表型的产生。这些结果共同表明,XRT与免疫治疗(如PD-1阻断)的结合可以有效地增强抗原特异性免疫反应,包括增加抗原呈递、T细胞浸润和记忆T细胞的产生,从而为肿瘤治疗提供了一种新的策略。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:五环三萜缀合物作为HBV聚合酶/NTCP双靶点抑制剂的发现及其抗乙肝病毒活性研究
下一篇:LncRNA fam13a-AS1通过靶向miR-141-3p上调NEK6表达促进肾癌发生