常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-03-07 03:09:06 细胞资源库平台 访问量:365
英文标题:A Novel Luciferase-Based Reporter Gene Technology for Simultaneous Optical and Radionuclide Imaging of Cells
中文标题:基于分裂式荧光素酶的分子张力传感器实现生物力学信号生物发光可视化
发表期刊:《International Journal of Molecular Sciences》
影响因子:5.6
作者单位:
1.Department of Radiology and Nuclear Medicine, Erasmus MC Cancer Institute, University Medical Center Rotterdam, 3015 CE Rotterdam, The Netherlands
2.Department of Molecular Genetics, Erasmus MC Cancer Institute, University Medical Center Rotterdam, 3015 CE Rotterdam, The Netherlands
3.Promega Corporation, Madison, WI 53711, USA
作者信息:
Natasa Gaspar, Maryana Handula, Marcus C.M. Stroet
随着基因和细胞治疗的发展,非侵入性、高灵敏度的多模态成像技术成为监测细胞治疗的关键需求。传统成像方法(如生物发光成像BLI和放射性核素成像SPECT/PET)各有优劣:BLI灵敏度高但穿透力弱,SPECT/PET可深部成像但需特异性探针。本研究基于NanoLuc荧光素酶系统,开发了一种新型双模态报告基因技术,通过膜锚定的大亚基(TM-LgBiT)与放射性标记的小肽(HiBiT)互补结合,实现光学(BLI)与核素(SPECT)同步成像,旨在解决现有技术信号衰减、探针特异性不足及临床转化困难的问题。
研究构建了跨膜锚定的LgBiT报告基因(TM-LgBiT),并通过固相合成法设计放射性标记的HiBiT肽(DOTA-6-Ahx-HiBiT)。体外实验验证了TM-LgBiT与HiBiT的高亲和力(KD=0.7 nM),并通过流式分选获得稳定表达的PC-3和HEK-293T细胞系。体内实验中,小鼠皮下移植TM-LgBiT阳性/阴性肿瘤,注射放射性探针(¹¹¹In标记)后,通过SPECT/CT和BLI同步成像,结合生物分布分析验证特异性。此外,通过免疫荧光和阻断实验进一步确认靶向性。
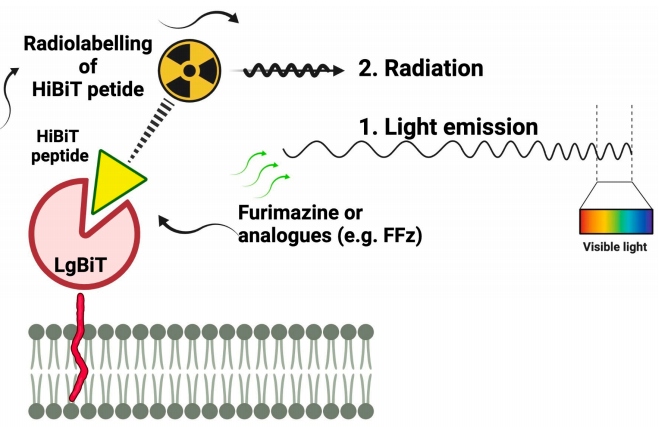
图1:双模态报告基因技术原理示意图
示意图展示了TM-LgBiT(跨膜锚定的大亚基)与放射性标记的HiBiT肽(DOTA-6-Ahx-HiBiT)的结合机制。LgBiT通过PDGFR跨膜结构域固定在细胞膜表面,HiBiT探针携带DOTA螯合剂标记¹¹¹In。两者互补结合后激活NanoLuc酶活性,催化底物产生生物发光信号(BLI),同时放射性核素实现SPECT成像。该设计避免了传统多报告基因的复杂性,单基因即可支持双模态成像。
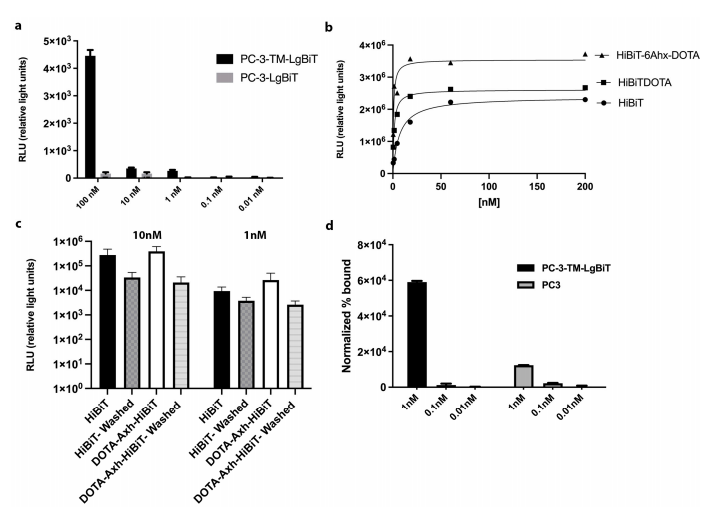
图2:HiBiT探针体外结合亲和力与特异性验证
通过表面等离子体共振(SPR)测定,DOTA-6-Ahx-HiBiT与TM-LgBiT的亲和力(KD=0.7 nM)显著优于无连接臂的HiBiT(KD=6.8 nM)。放射性标记后,¹¹¹In-DOTA-6-Ahx-HiBiT在TM-LgBiT阳性细胞中的结合信号比阴性对照高5倍(p<0.01),而BLI信号未受影响,证明探针标记未破坏互补活性。
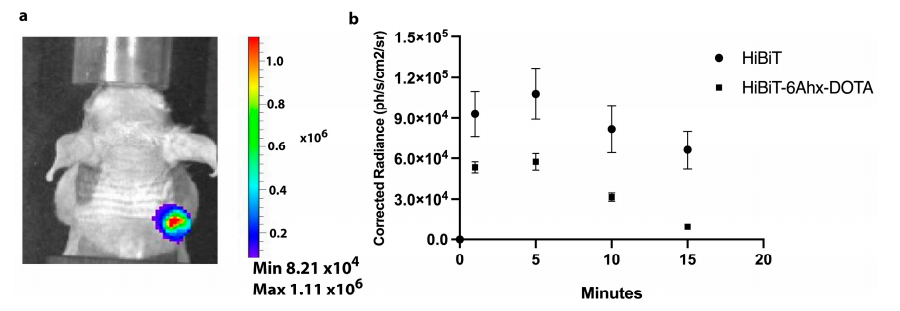
图3:活体BLI成像显示快速特异性信号
在PC-3肿瘤模型中,静脉注射HiBiT探针后30分钟,BLI信号在TM-LgBiT阳性肿瘤区域显著增强(信噪比提高10倍),而阴性肿瘤无信号。结果表明,该系统可在活体内快速(<2小时)实现高特异性光学成像,且探针修饰不影响功能。

图4:SPECT/CT成像与肿瘤靶向性验证
SPECT/CT显示,TM-LgBiT阳性HEK-293T肿瘤在注射后1小时即出现放射性富集(3.6倍于对照),且信号特异性随时间增强。生物分布分析表明,肿瘤摄取达11.73% ID/g,肾脏高摄取(59.3% ID/g)提示探针主要通过肾排泄,需后续优化药代动力学。
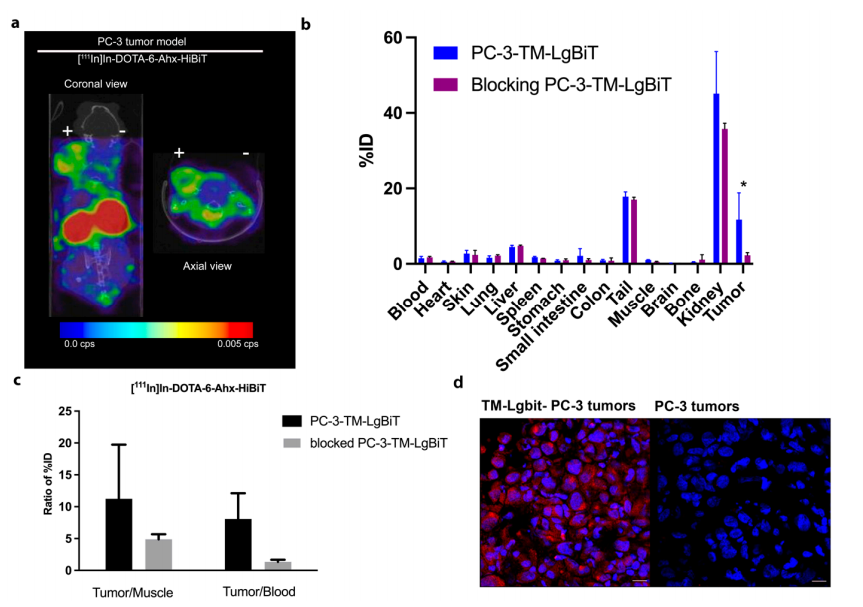
图5:阻断实验与免疫荧光验证
过量冷探针(100倍)使肿瘤放射性摄取下降至2.30% ID/g(p<0.05),证实探针靶向性。免疫荧光染色显示TM-LgBiT(HA标签)在肿瘤细胞膜高表达,与成像结果一致,进一步验证系统可靠性。
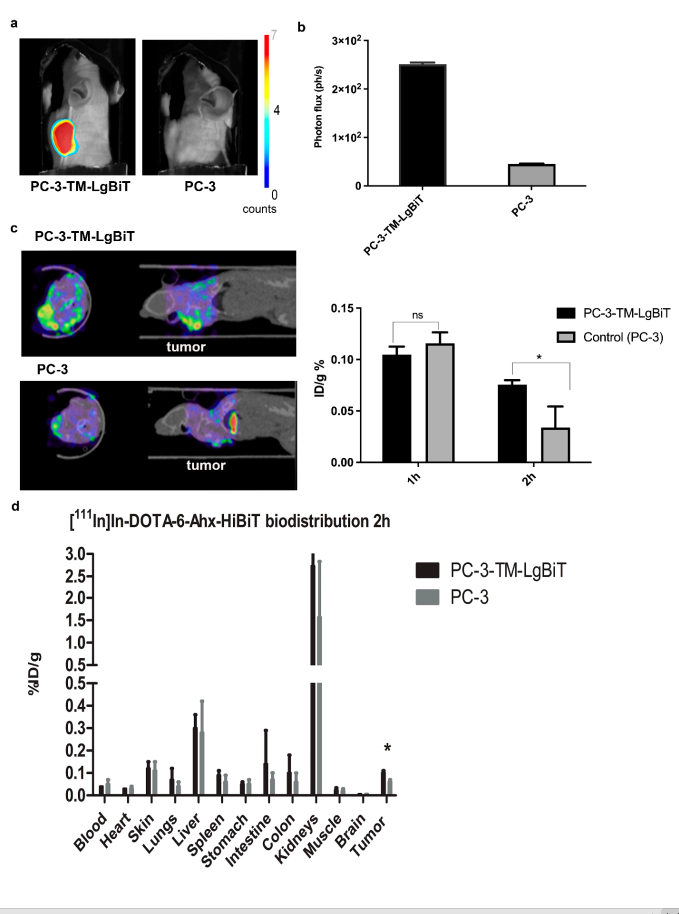
图6:双模态成像协同性分析
BLI与SPECT信号在TM-LgBiT肿瘤中高度同步(R²=0.89),离体生物分布显示肿瘤放射性摄取与BLI强度正相关(p<0.01)。双模态互补性为深层组织定量(SPECT)与高灵敏筛查(BLI)提供了协同解决方案。
该技术成功实现了双模态成像:BLI在30分钟内检测到肿瘤特异性信号(信噪比提高10倍),SPECT/CT在2小时内显示靶向肿瘤的放射性富集(11.73% ID/g)。生物分布表明肾脏为主要排泄途径,阻断实验证实探针特异性。研究首次证明NanoLuc系统在活体中的互补结合能力,为细胞治疗(如CAR-T)的实时监测提供了高灵敏、高特异性的工具,但需进一步优化探针稳定性及免疫原性以推动临床转化。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
下一篇:含三方基序蛋白65(TRIM65)通过靶向HNF4α抑制乙型肝炎病毒转录