常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-03-06 21:50:06 细胞资源库平台 访问量:273
英文标题:Design of Selective PARP-1 Inhibitors and Antitumor Studies
中文标题:选择性PARP-1抑制剂的设计与抗肿瘤研究
发表期刊:《JOURNAL OF MEDICINAL CHEMISTRY》
影响因子:6.9
作者单位:山东大学微生物技术国家重点实验室
作者信息:Zhang Yiting;Li Xiangqian;Liu Fang;Bai Xiaoyi;Liu Xiaochun;Sun Hao;Gao Chenxia;Lin Yuxi;Xing Pan;Zhu Jiqiang;Liu Ruihua;Wang Zemin;Dai Jiajia;Shi Dayong
PARPs参与DNA损伤修复等细胞过程,PARP-1是PARP家族中最丰富的成员。
抑制PARP-1可以增加DNA损伤积累,导致双链断裂,通过同源重组修复。
PARP-1抑制剂已用于抗癌治疗,但血液系统毒性限制了其应用,可能因为同时抑制了PARP-2。
设计高度选择性的PARP-1抑制剂可以减少毒性副作用,满足肿瘤治疗需求。
已开发出少量选择性PARP-1抑制剂,但目前市场上尚无此类产品。
溴酚天然产物及其衍生物具有广泛的生物活性,包括抗肿瘤作用。
研究团队合成了B4衍生物的六个系列,并鉴定出具有高活性和选择性的化合物I16。
新型化合物通过影响特定氨基酸残基提供高度的选择性。
对PARP-1抑制谱的理解有助于设计选择性PARP-1抑制剂。
所有商业试剂购入后未经进一步提纯或蒸馏直接使用。
测定熔点使用Griffin装置,结果未经校正。
NMR(1H, 13C)数据使用Bruker AV-600光谱仪获得,化学位移以ppm表示(TMS作为内标)。
NMR信号的多重性缩写:s = 单峰,d = 双峰,t = 三重峰,q = 四重峰,m = 多重峰。
柱色谱使用200-300目硅胶。
高分辨率质谱(HRMS)使用HPLC-Q-Tof MS (Micro)光谱仪获得。
所有最终产品的纯度通过分析HPLC确定为>95%。
提供了D1-D13化合物的通用合成步骤。
合成过程中使用了N,N-二甲基甲酰胺(DMF)、碳酸钾和乙醇等试剂。
使用DNA点突变技术对PARP-1质粒进行三次点突变。
将突变后的质粒和未突变的质粒转染到HEK-293 T细胞中。
细胞裂解后,使用抗-FLAG M2磁珠纯化PARP-1蛋白质。
使用PARP-1和PARP-2的化学发光检测试剂盒进行酶抑制实验。
通过96孔板酶联免疫吸附试验(ELISA)检测化合物对提取的PARP1和突变PARP-1的抑制效果。
使用CDOCKER模块进行分子对接研究,分析了受体-配体相互作用。
使用SPR技术检测化合物I16与PARP-1和突变PARP-1的相互作用。
列出了用于实验的各种人类癌细胞系和正常细胞系的来源和培养条件。
使用SRB或CCK-8法测定化合物的细胞活力抑制效果。
通过观察Hela和SK-OV-3细胞在不同浓度I16处理下的集落形成情况来评估其抗肿瘤效果。
使用Hoechst 33258染色观察SK-OV-3细胞核形态。
通过细胞热位移实验分析I16或奥拉帕利对SK-OV-3细胞的热稳定性影响。
使用西部印迹技术分析SK-OV-3细胞中蛋白质的表达水平。
通过流式细胞仪检测I16处理后的SK-OV-3细胞中的活性氧物种。
在BALB/c-nude小鼠体内评估了I16的抗肿瘤活性。
进行了I16的急性毒性和亚急性毒性实验。
在Sprague-Dawley大鼠体内进行I16的药代动力学分析。
所有数据以平均值±标准误(SEM)表示,使用Student's t-test进行统计分析。
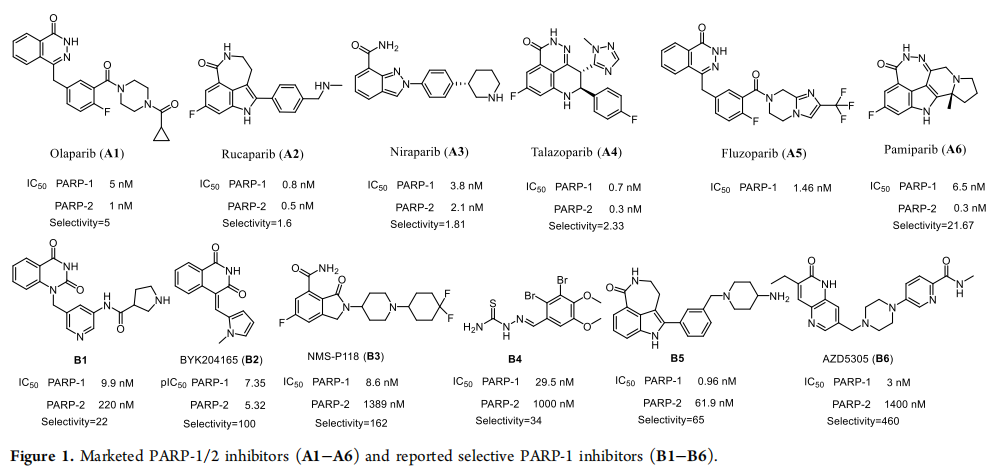
图1:市售的PARP-1/2抑制剂(A1-A6)和报道的选择性PARP-1抑制剂(B1-B6)
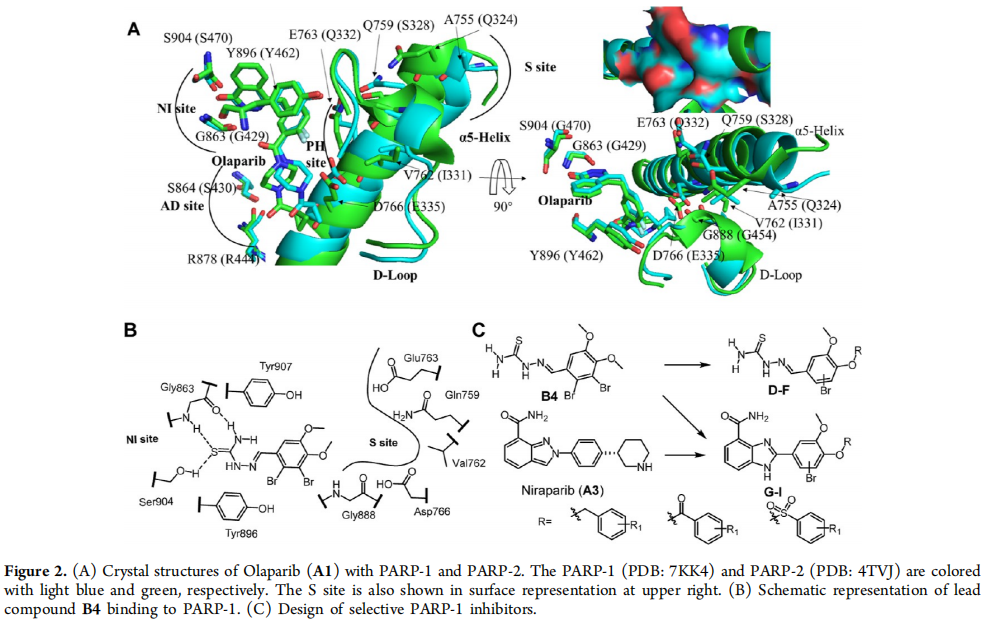
(A) Olaparib (A1) 与PARP-1和PARP-2的晶体结构。PARP-1(PDB: 7KK4)和PARP-2(PDB: 4TVJ)分别以浅蓝色和绿色表示。S位点也在右上角的表面表示中显示。
(B) 铅化合物B4与PARP-1结合的示意图。
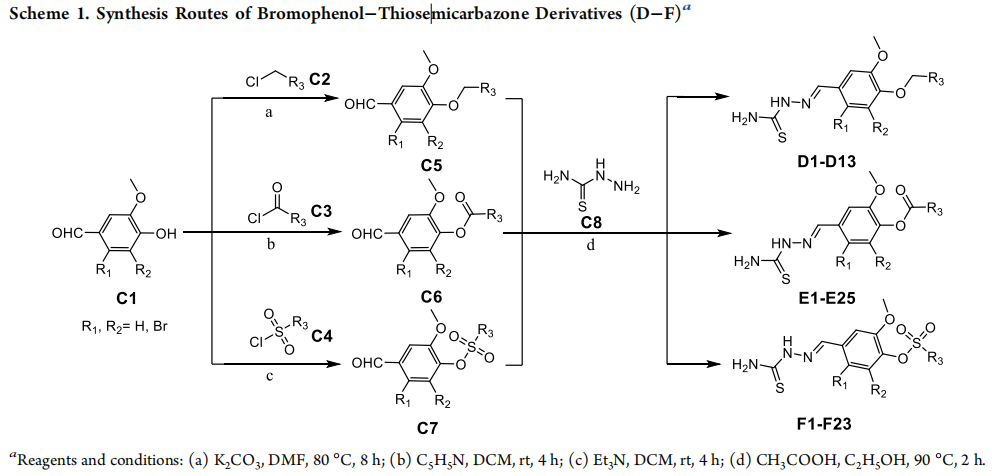
(C) 选择性PARP-1抑制剂的设计。
反应条件和试剂:
(a) K2CO3, DMF, 80°C, 8小时;
(b) C5H5N, DCM, 室温, 4小时;
(c) Et3N, DCM, 室温, 4小时;
(d) CH3COOH, C2H5OH, 90°C, 2小时。
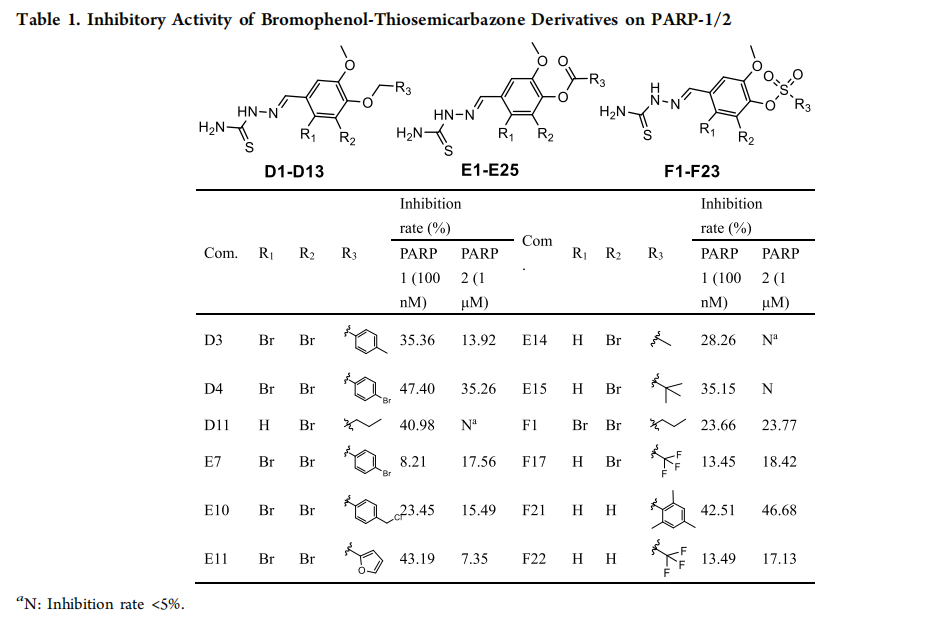
表1. 溴酚硫代半缩氨酸衍生物对PARP-1的抑制活性。
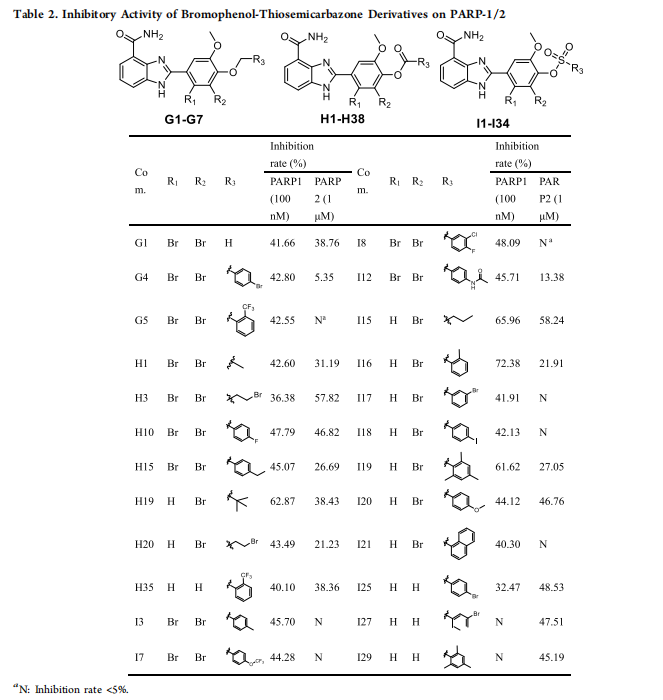
表2. 溴酚硫代半缩氨酸衍生物对PARP-1/2的抑制活性。
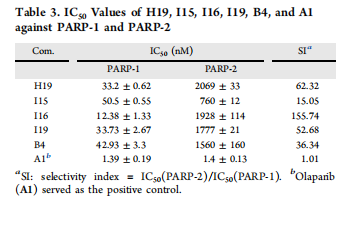
表3. H19, I15, I16, I19, B4 和 A1 对PARP-1和PARP-2的IC50值。
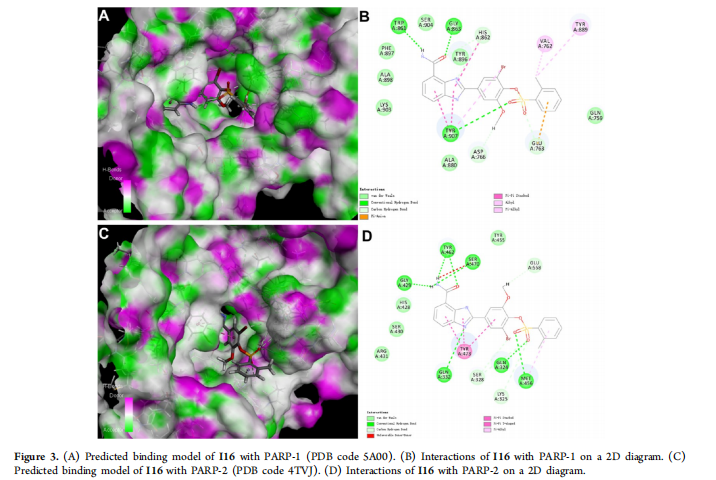
(A) I16与PARP-1(PDB代码5A00)的预测结合模型。
(B) I16与PARP-1在2D图上的相互作用。
(C) I16与PARP-2(PDB代码4TVJ)的预测结合模型。
(D) I16与PARP-2在2D图上的相互作用。

(A) 使用SPR评估I16对PARP-1蛋白的亲和力。
(B) 使用SPR评估I16对突变PARP-1蛋白的亲和力。

表4. 化合物I16对PARP-1和突变PARP-1的IC50值。
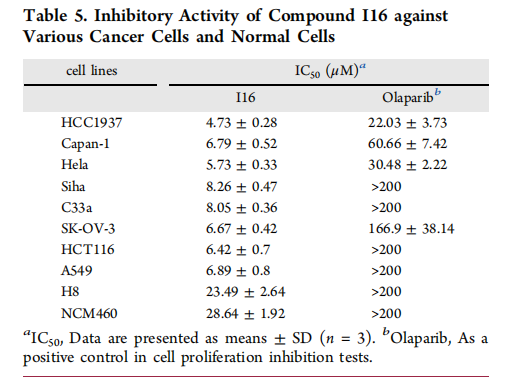
表5. 化合物I16对各种癌细胞和正常细胞的抑制活性。
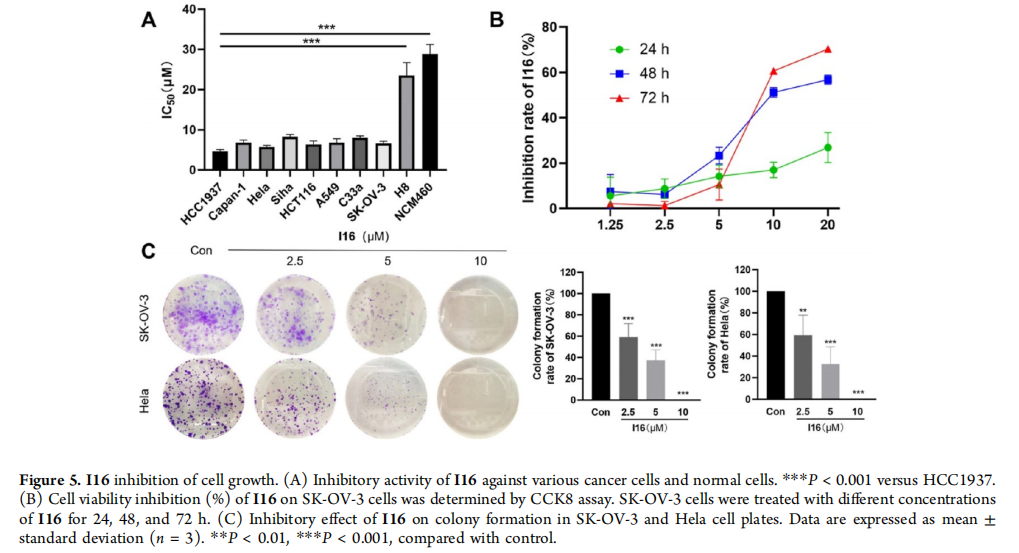
(A) I16对不同癌细胞和正常细胞的生长抑制活性。***P < 0.001 与HCC1937相比。
(B) 通过CCK8试验确定I16对SK-OV-3细胞的抑制活性。SK-OV-3细胞用不同浓度的I16处理24、48和72小时。
(C) I16对SK-OV-3和Hela细胞板的克隆形成抑制效应。数据以平均值±标准差(n = 3)表示。**P < 0.01, ***P < 0.001,与对照组相比。
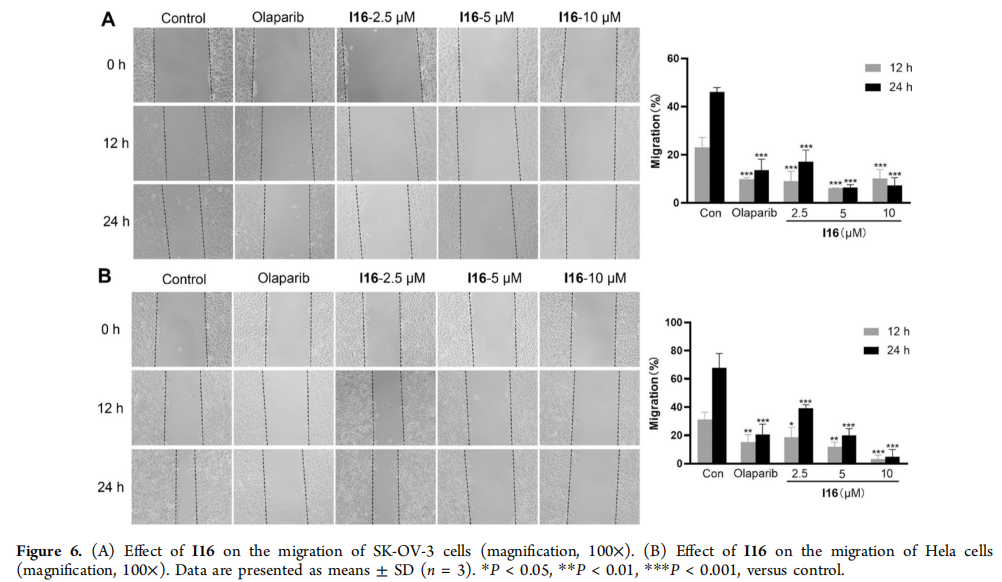
(A) I16对SK-OV-3细胞迁移的影响(放大倍数,100×)。
(B) I16对Hela细胞迁移的影响(放大倍数,100×)。数据以平均值±标准差(n = 3)表示。*P < 0.05, **P < 0.01, ***P < 0.001,与对照组相比。
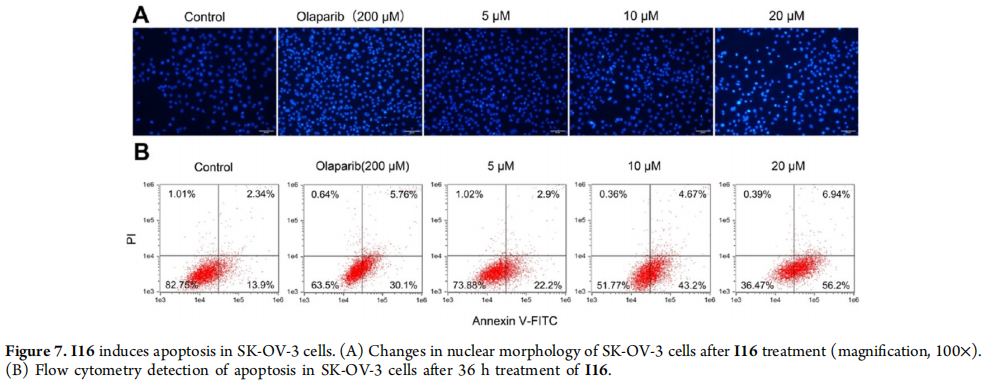
I16诱导SK-OV-3细胞凋亡。
(A) I16处理后SK-OV-3细胞核形态的变化(放大倍数,100×)。
(B) 经过36小时I16处理后SK-OV-3细胞的凋亡流式细胞仪检测。
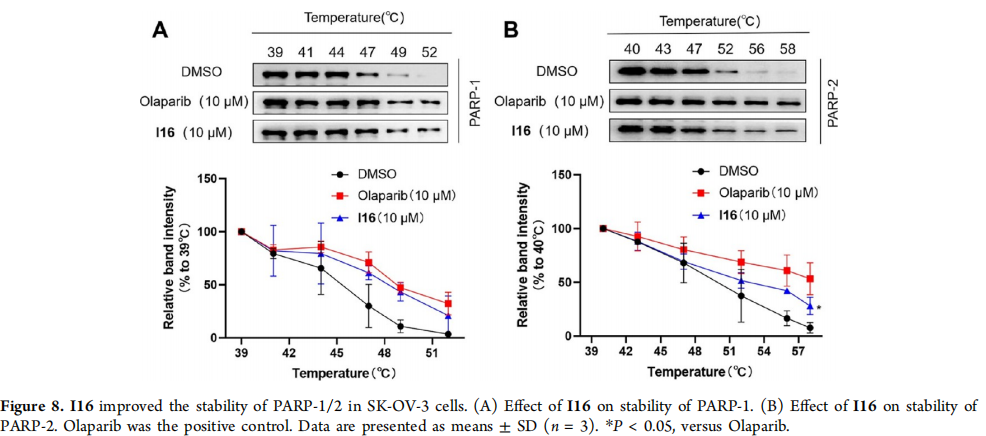
图8:I16提高了SK-OV-3细胞中PARP-1/2的稳定性
(A) I16对PARP-1稳定性的影响。
(B) I16对PARP-2稳定性的影响。Olaparib作为阳性对照。数据以平均值±标准差(n = 3)表示。*P < 0.05,与Olaparib相比。

(A) γ-H2AX的免疫荧光分析。
(B) γ-H2AX的蛋白质印迹分析。
(C) I16诱导SK-OV-3细胞中ROS积累,通过流式细胞仪分析。
(D) I16抑制MCM复合物。数据以平均值±标准差(n = 3)表示。**P < 0.01, ***P < 0.001,与对照组相比。
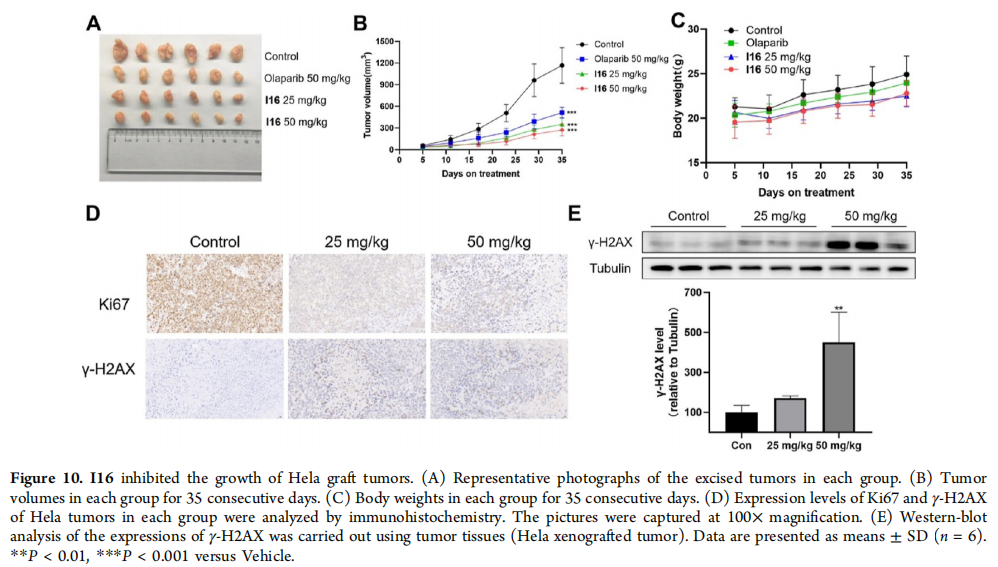
图10:I16抑制Hela移植瘤的生长
(A) 每组切除的肿瘤代表性照片。
(B) 每组连续35天的肿瘤体积。
(C) 每组连续35天的体重。
(D) Hela肿瘤中Ki67和γ-H2AX的表达水平通过免疫组化分析。图片在100×放大倍数下拍摄。
(E) 使用Hela移植瘤组织进行γ-H2AX表达的蛋白质印迹分析。数据以平均值±标准差(n = 6)表示。**P < 0.01, ***P < 0.001,与载体组相比。
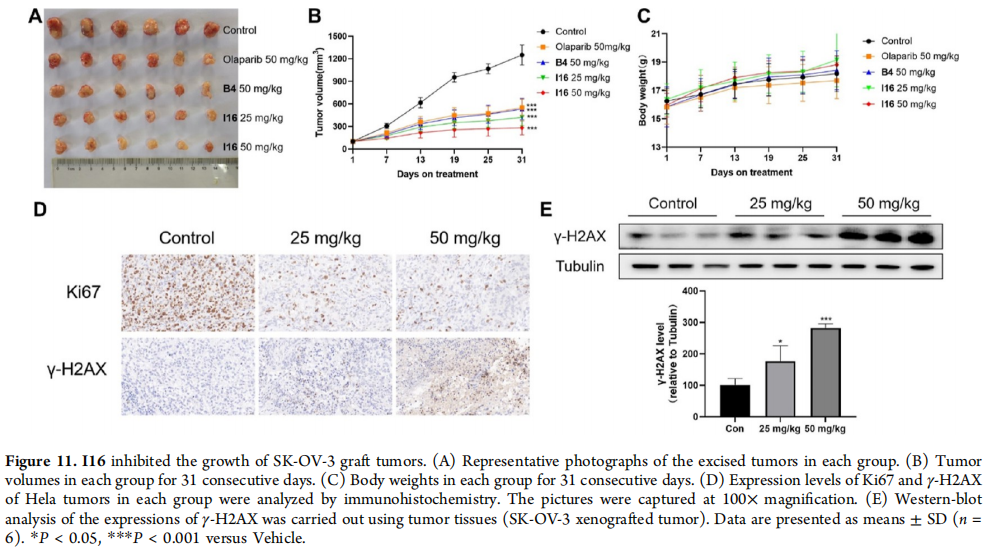
图11:I16抑制SK-OV-3移植瘤的生长
(A) 每组切除的肿瘤代表性照片。
(B) 每组连续31天的肿瘤体积。
(C) 每组连续31天的体重。
(D) Hela肿瘤中Ki67和γ-H2AX的表达水平通过免疫组化分析。图片在100×放大倍数下拍摄。
(E) 使用SK-OV-3移植瘤组织进行γ-H2AX表达的蛋白质印迹分析。数据以平均值±标准差(n = 6)表示。*P < 0.05, ***P < 0.001,与载体组相比。
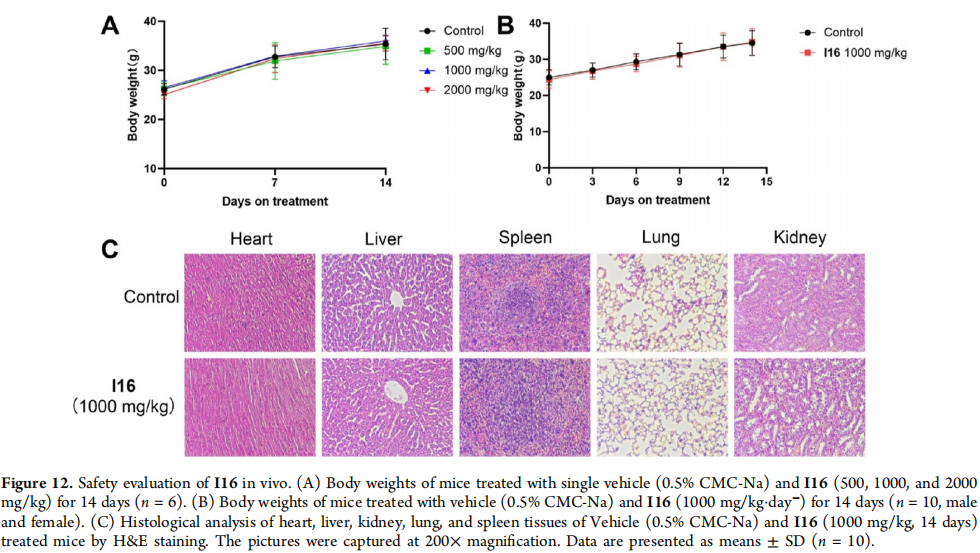
图12:I16在体内的安全性评估
(A) 处理14天的小鼠体重,单独使用载体(0.5% CMC-Na)和I16(500、1000和2000 mg/kg)。
(B) 处理14天的小鼠体重,使用载体(0.5% CMC-Na)和I16(1000 mg/kg·天−)。
(C) 对处理14天的小鼠的心、肝、肾、肺和脾组织进行H&E染色。图片在200×放大倍数下拍摄。数据以平均值±标准差(n = 10)表示。
设计并合成了一系列针对PARP-1的选择性抑制剂。
化合物I16在PARP-1抑制活性和选择性上表现出显著优势。
I16能够抑制肿瘤细胞的增殖、生长、迁移,并诱导凋亡。
I16在肿瘤细胞移植模型中的抑制效果优于阳性对照药物Olaparib。
I16在口服高剂量时表现出良好的安全性。
确定了S位点作为设计选择性PARP抑制剂的潜在位点。
S位点的关键氨基酸突变会影响化合物与PARP-1的结合。
研究成果为开发安全、高效、选择性的PARP-1抑制剂提供了新的策略和化学实体。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
下一篇:一种基于荧光素酶的新型报告基因技术用于细胞光学与放射性核素同步成像