常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-02-28 10:00:00 细胞资源库平台 访问量:328
英文标题:Closely Related Mycobacterial Strains Demonstrate Contrasting Levels of Efficacy as Antitumor Vaccines and Are Processed for Major Histocompatibility Complex Class I Presentation by Multiple Routes in Dendritic Cells.
中文标题:密切相关的分枝杆菌菌株作为抗肿瘤疫苗的效力对比显著,并在树突状细胞中通过多条途径被处理以进行主要组织相容性复合体I类呈递
发表期刊:《Infection and Immunity Infect. Immun.》
影响因子:2.9
作者单位:
应用免疫学实验室1和黑色素瘤生物学组,英国癌症研究英国临床中心,圣詹姆斯大学医院,利兹,英国
作者信息:Eleanor J. Cheadle,Dearbhaile O’Donnell,Peter J. Selby, and Andrew M. Jackson
本研究的背景集中在探索树突状细胞如何处理表达重组抗原的分枝杆菌,特别是在疫苗开发中对抗感染和肿瘤的应用。目前,已有研究将分枝杆菌改造以表达肿瘤抗原,用于疫苗研究,但对于树突状细胞如何识别和呈递这些抗原至MHC I类分子的机制尚不明确。本研究特别比较了两种分枝杆菌:快速生长的Mycobacterium smegmatis和慢速生长的M. bovis BCG,它们都被工程化以表达特定的肿瘤抗原OVA257–264。研究发现,尽管两种菌株均能诱导树突状细胞的成熟,但重组M. smegmatis引起的成熟程度更高。在抗原呈递方面,重组M. smegmatis的抗原仅能在DC2.4细胞系上以OVA257–264形式在Kb分子上呈递,而重组M. bovis BCG的抗原则能在所有类型的树突状细胞上呈递,且这种呈递依赖于蛋白酶体功能和新生MHC I类分子。这些结果首次证实了慢速生长的M. bovis BCG载体化的抗原能够被树突状细胞有效处理并在MHC I类分子上呈递,而快速生长的M. smegmatis载体化的抗原则不能,为重组微生物疫苗的开发提供了重要的启示。
本研究中,研究者首先构建了表达多表位OVApet的重组分枝杆菌,包括结核分枝杆菌BCG巴斯德株和快速生长的分枝杆菌M. smegmatis,它们在特定的培养基中生长。通过PCR技术合成OVApet,并将其克隆到分枝杆菌-大肠杆菌穿梭载体pMOD8中,该载体在HSP60启动子控制下表达。接着,通过电转化法将pMOD8-OVApet质粒DNA导入M. bovis BCG和M. smegmatis,并在含有卡那霉素的7H11琼脂上筛选重组克隆。研究者使用6至8周龄的C57BL/6雌性小鼠进行免疫实验,通过皮下注射不同剂量的重组M. bovis BCG和M. smegmatis,并在免疫后挑战B16-OVA肿瘤细胞系,以评估疫苗效力。同时,维持DC2.4树突状细胞系和B3Z杂交瘤细胞,用于后续的抗原呈递实验。通过磁珠分离法从C57BL/6和TAP1-/-小鼠的骨髓和脾细胞中分离出树突状细胞前体,并在特定培养条件下培养成骨髓源树突状细胞(BMDC)。研究者还分析了细菌感染树突状细胞的表型变化,并通过与B3Z杂交瘤细胞共培养来评估树突状细胞对OVA表位的呈递能力。此外,通过ELISA测定树突状细胞培养上清液中IL-2的浓度,以及检测细菌上清液中OVApet蛋白的浓度,以评估抗原表达和呈递效率。
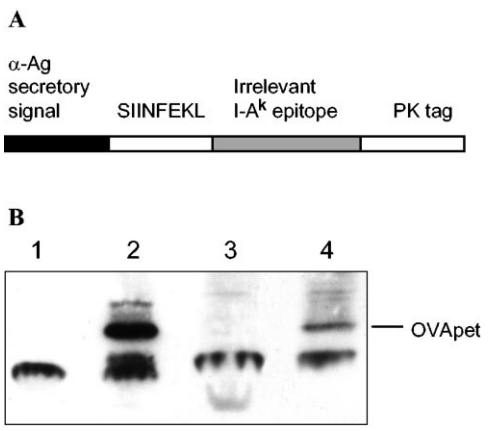
图1. 工程化分枝杆菌分泌多表位OVApet的表达与检测。
结核分枝杆菌BCG(M. bovis BCG)和快速生长的分枝杆菌(M. smegmatis)被工程化以分泌多表位蛋白OVApet。构建的多表位蛋白OVApet旨在表达OVA257-264 H2-Kb结合表位,并将其置于M. bovis BCG的α抗原分泌信号序列下游,确保其能从细菌中分泌出来(A)。野生型M. bovis BCG(1)、M. bovis BCG-OVApet(2)、M. smegmatis(3)和M. smegmatis-OVApet(4)的裂解物在十二烷基硫酸钠-16%还原聚丙烯酰胺凝胶上电泳,转移到硝酸纤维素膜上,并用抗PK单克隆抗体探测,随后使用生物素标记的二抗和链霉亲和素-辣根过氧化物酶。通过增强化学发光法检测OVApet的表达(图1B)。-Ag代表α抗原。

图2.M. bovis BCG-OVApet疫苗对B16-OVA肿瘤挑战的保护效果优于M. smegmatis-OVApet。
结核分枝杆菌BCG(M. bovis BCG)经过工程化改造后能够分泌多表位OVApet,与M. smegmatis-OVApet相比,在C57BL/6小鼠中显示出更好的抗肿瘤保护效果。实验中,C57BL/6小鼠分别在第0、14和28天通过皮下注射的方式在腹股沟区域接种了不同剂量的M. bovis BCG-OVApet或野生型M. bovis BCG。到了第42天,小鼠在对侧腹部皮下被挑战性地注射了B16-OVA肿瘤细胞,之后每两天测量一次肿瘤生长情况。结果显示,接种M. bovis BCG-OVApet的小鼠相较于接种M. smegmatis-OVApet的小鼠,肿瘤生长曲线显示了更明显的保护效果。此外,通过Kaplan-Meier曲线分析,进一步证实了M. bovis BCG-OVApet在提高小鼠生存率方面的优越性。

图3. M. bovis BCG-OVApet和M. smegmatis-OVApet诱导树突状细胞成熟表型。
M. bovis BCG-OVApet和M. smegmatis-OVApet均能诱导树突状细胞表现出成熟表型。实验中,我们将每106个树突状细胞以10的感染复数(multiplicity of infection, MOI)感染M. bovis BCG-OVApet(灰色虚线)或M. smegmatis-OVApet(粗线),或不进行感染(细线),持续2小时。之后,使用抗生素处理杀死剩余的细胞外细菌,并将树突状细胞培养16小时。树突状细胞随后与结合了藻红蛋白的抗体一起孵育,针对CD40、CD54、CD80、CD86、H2-Kb和I-Ab,并通过流式细胞仪进行分析。图A显示了DC2.4细胞表面的表达情况,图B显示了骨髓来源树突状细胞(BMDC)表面的表达情况。
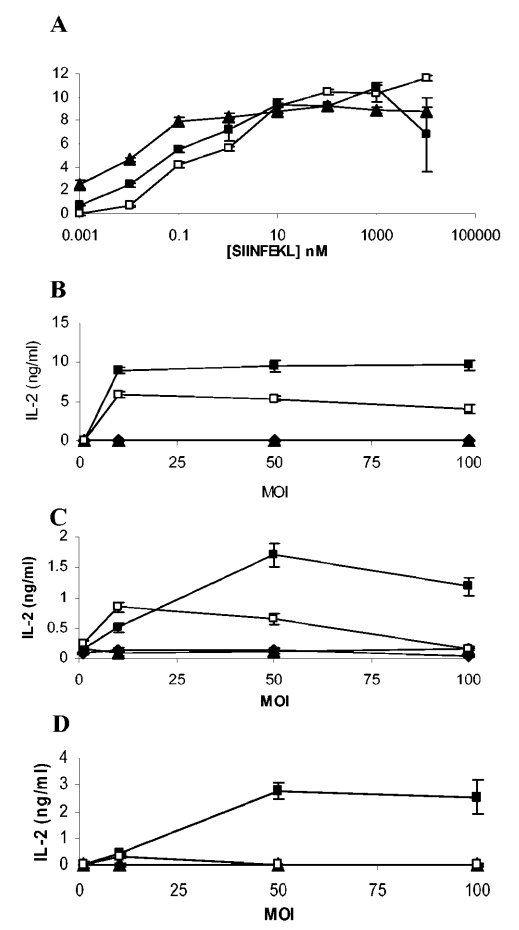
图4. 树突状细胞呈递重组分枝杆菌抗原。
树突状细胞能够从重组分枝杆菌中呈递抗原。实验中,DC2.4细胞(三角形)、骨髓来源的树突状细胞(BMDC,正方形)和脾脏树突状细胞(圆形)分别与不同浓度的SIINFEKL肽共孵育2小时,洗涤后与B3Z杂交瘤细胞共培养16小时。通过测量上清液中的IL-2产量来评估抗原呈递(图A)。不同的树突状细胞被感染以不同量的M. bovis BCG(圆形)、M. bovis BCG-OVApet(正方形)、M. smegmatis(圆形)或M. smegmatis-OVApet(三角形),并与B3Z杂交瘤细胞共培养16小时。通过测量IL-2的分泌来评估H2-Kb分子上SIINFEKL表位的呈递。图B显示了树突状细胞系DC2.4的结果,图C显示了骨髓来源的树突状细胞的结果,图D显示了CD11c阳性脾脏树突状细胞的结果。

图5. 热杀死的M. bovis BCG-OVApet和M. smegmatis-OVApet中的SIINFEKL不被呈递在MHC I类分子上。
作者发现热杀死的M. bovis BCG-OVApet和M. smegmatis-OVApet中的SIINFEKL表位不能在MHC I类分子上呈递。实验中,作者将每105个DC2.4细胞(图A和B)或BMDC(图C和D)在96孔板中与活菌(实心正方形)或热杀死(空心圆圈)的M. bovis BCG-OVApet(图A和C)或M. smegmatis-OVApet(图B和D)以1、10、50或100的感染复数(MOI)共孵育2小时,温度为37°C。剩余的细胞外细菌通过200微克/毫升的阿米卡星处理2小时,温度为37°C来杀死。之后,树突状细胞在PBS中洗涤,并与每105个B3Z细胞共培养16小时,温度为37°C。上清液通过固相ELISA检测IL-2的分泌。
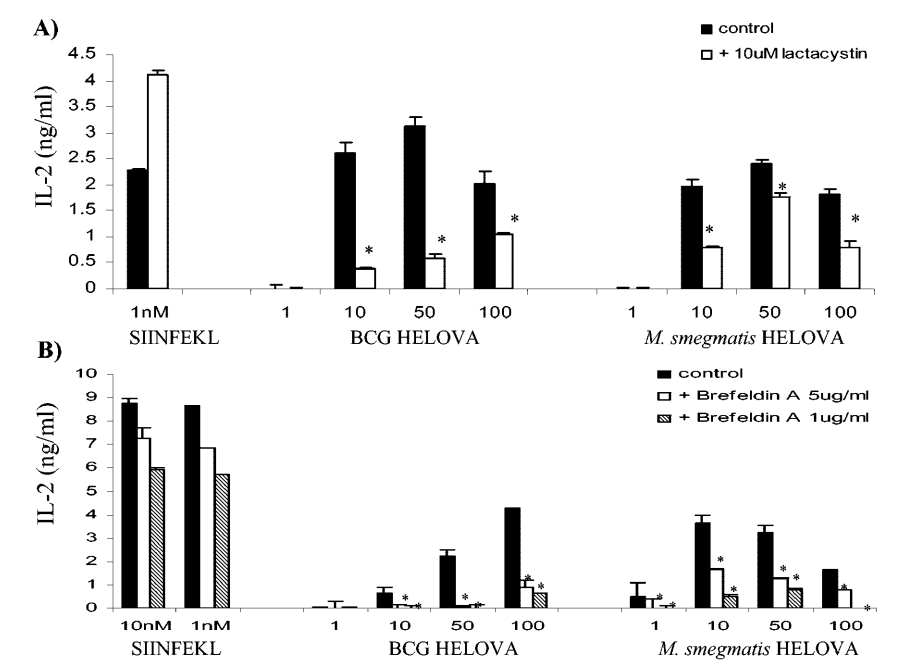
图6.蛋白酶体抑制剂乳环素和逆行运输抑制剂布雷菲德菌素A降低DC2.4细胞中重组细菌来源SIINFEKL的呈递。
作者发现蛋白酶体抑制剂乳环素和逆行运输抑制剂布雷菲德菌素A能够减少DC2.4细胞中重组细菌来源SIINFEKL的呈递。实验中,作者将每105个DC2.4细胞在96孔板中与M. bovis BCG-OVApet或M. smegmatis-OVApet以1、10、50或100的感染复数(MOI)共孵育2小时,温度为37°C,或者与SIINFEKL肽共孵育。剩余的细胞外细菌通过200微克/毫升的阿米卡星处理2小时,温度为37°C来杀死。树突状细胞随后在PBS中洗涤,并与每105个B3Z细胞共培养16小时,温度为37°C。上清液通过固相ELISA检测IL-2的分泌。在某些情况下,树突状细胞先用10微米乳环素处理3小时(图A),或用1或5微克/毫升布雷菲德菌素A处理30分钟(图B)。树突状细胞在加入B3Z之前用1%的甲醛固定并彻底洗涤(图B)。统计学上显著的呈递减少用*表示(P < 0.05,学生t检验)。
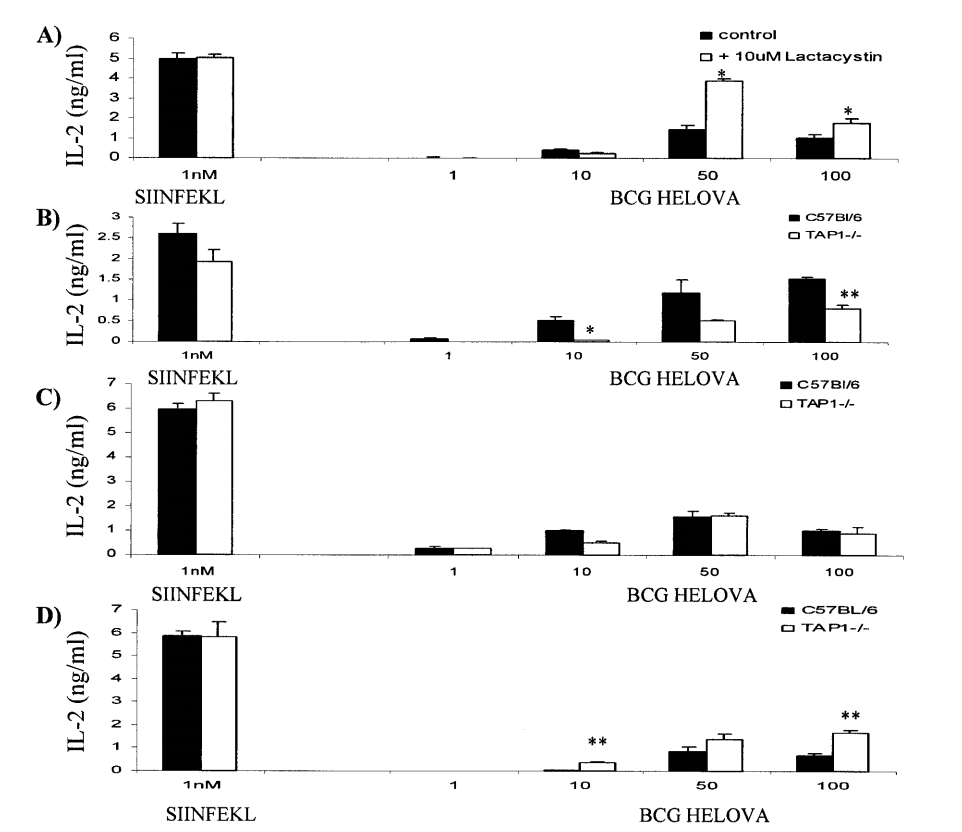
图7:MHC I类分子呈递SIINFEKL不受乳环素抑制,在BMDC和脾脏树突状细胞中部分独立于TAP。
作者发现MHC I类分子呈递的SIINFEKL不受蛋白酶体抑制剂乳环素的抑制,并且在骨髓来源的树突状细胞(BMDC)和脾脏树突状细胞中部分独立于TAP。实验中,作者将每105个BMDC用10微米乳环素处理3小时或不处理,然后在96孔板中与M. bovis BCG-OVApet以1、10、50或100的感染复数(MOI)共孵育2小时,温度为37°C,或者与SIINFEKL肽共孵育。剩余的细胞外细菌通过200微克/毫升的阿米卡星处理2小时,温度为37°C来杀死。树突状细胞随后在PBS中洗涤,并与每105个B3Z细胞共培养16小时,温度为37°C。上清液通过固相ELISA检测IL-2的分泌(图A)。作者还感染了来自C57BL/6或TAP1-/-小鼠的每105个BMDC(图B和C)或脾脏树突状细胞(图D)与M. bovis BCG-OVApet,或与SIINFEKL肽共孵育,SIINFEKL对B3Z细胞的呈递如上所述。如果乳环素处理后呈递显著减少或使用TAP1-/-树突状细胞后呈递显著增加,用*表示(P < 0.05,学生t检验)。
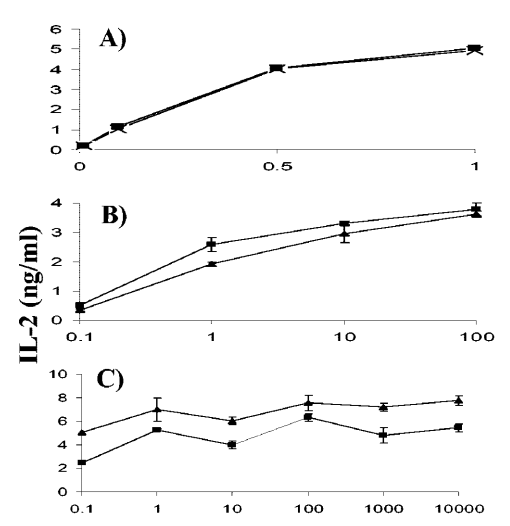
图8:经乳环素处理和TAP1-/-树突状细胞能以相似效率呈递SIINFEKL肽。
作者发现经乳环素处理的和TAP1-/-树突状细胞能够以相似的效率呈递SIINFEKL肽。实验中,作者将每105个经10微米乳环素处理(实心正方形)或未经处理(空心三角形)的C57BL/6 BMDC与不同浓度的SIINFEKL共孵育2小时,洗涤后与每105个B3Z细胞共培养16小时,温度为37°C。图A显示了B3Z细胞上清液中IL-2的分泌情况。图B显示了C57BL/6 BMDC(实心正方形)和TAP1-/- BMDC(空心圆形)与不同浓度的SIINFEKL共孵育后,与B3Z细胞共培养16小时的IL-2分泌情况。图C显示了C57BL/6脾脏树突状细胞(实心正方形)和TAP1-/-脾脏树突状细胞(空心圆形)与不同浓度的SIINFEKL共孵育后,与B3Z细胞共培养16小时的IL-2分泌情况。
在本研究中,两种重组分枝杆菌菌株——M. bovis BCG和M. smegmatis——被工程化以表达模型肿瘤抗原OVA257-264。研究发现,重组M. bovis BCG-OVApet能显著保护小鼠免受B16-OVA肿瘤细胞的挑战,而M. smegmatis-OVApet则未能提供这种保护。两种菌株均能诱导树突状细胞成熟,但M. smegmatis引起的成熟程度更高。DC2.4细胞系能够有效处理并呈递来自两种菌株的SIINFEKL表位,尽管M. bovis BCG的效率略高。相比之下,BMDC处理M. bovis BCG-OVApet的SIINFEKL效率低于DC2.4细胞,而对M. smegmatis-OVApet的SIINFEKL处理只在部分实验中观察到。脾脏树突状细胞能够处理并呈递M. bovis BCG-OVApet的SIINFEKL,但对M. smegmatis-OVApet的SIINFEKL则不能。此外,只有活菌分泌的表位才能在DC2.4细胞系和BMDC中通过MHC I类分子呈递。在DC2.4细胞中,SIINFEKL的呈递部分依赖于蛋白酶体和TAP功能,而在BMDC和脾脏树突状细胞中,则不依赖于这些因素。即使在TAP1基因缺陷小鼠中,BMDC仍能处理并呈递M. bovis BCG-OVApet的SIINFEKL,尽管效率有所下降。在某些实验中,TAP1基因缺陷小鼠的脾脏树突状细胞呈递效率甚至高于野生型小鼠。这些结果揭示了M. bovis BCG载体化的抗原能够在体外生成的树突状细胞中被有效处理并在MHC I类上呈递,而M. smegmatis载体化的抗原则不能,为重组微生物疫苗的开发提供了重要的启示。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:RAB6B是肝细胞癌潜在的预后标志物,并与肿瘤免疫微环境重塑相关