常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-02-27 10:46:41 细胞资源库平台 访问量:214
英文标题:MMP-2-triggered, mitochondria-targeted PROTAC-PDT therapy of breast cancer and brain metastases inhibition.
中文标题:乳腺癌及其脑转移的MMP-2触发线粒体靶向PROTAC-PDT治疗
发表期刊:《Nature Communications》
影响因子:17.69
作者单位:四川大学华西医院、海南大学药学院
作者信息:Fan Tong, Yufan Wang, Yanyan Xu, Yang Zhou, Siqin He, Yufan Du, Wenqin Yang, Ting Lei, YujunSong, Tao Gong, Huile Gao.
PROTAC技术是一种蛋白质阻断技术,具有抗肿瘤效果。
PROTAC技术的应用受到肿瘤内分布和积累不足的限制。
设计了一种新的纳米药物dBET6@CFMPD,它结合了PROTAC和光动力疗法(PDT)。
dBET6@CFMPD具有良好的生物分布性和保留性。
dBET6@CFMPD能够有效抑制原发性和转移性肿瘤的生长。
dBET6@CFMPD是一种有潜力的癌症联合治疗纳米药物。
研究设计:所有动物实验均遵循川大伦理委员会指南,并经伦理委员会批准。细胞系包括小鼠4T1乳腺癌细胞、E0771乳腺癌细胞和RAW264.7细胞,均经过STR分析验证。实验过程中,肿瘤大小不超过1500 mm3。
材料准备:实验所用材料包括氯素e6、MMP-2响应肽、BRD4抑制剂dBET6、DSPE-PEG2000-Mal、DSPE-PEG3400-NH2等,均购自国内外试剂公司。
Ce6-PEGylated MMP-2响应肽的合成:通过 maleimide 反应将肽的末端 sulfhydryl 与 DSPE-PEG2000-Mal 相连,再与活化的 Ce6 形成偶联物。
纳米粒子的制备和表征:采用文献报道的方法,将CFMPD、dBET6溶于DMF中,混合后加入水中,通过离心过滤得到纳米粒子。利用DLS和TEM对纳米粒子进行表征。
MMP-2响应性测试:将CFMPD和CFPD与MMP-2酶孵育,通过MALDI-TOF-MS监测分子量变化。同时,利用DLS和TEM观察纳米粒子尺寸和形态变化。
细胞摄取实验:4T1细胞与不同制剂孵育,通过流式细胞仪和荧光显微镜检测细胞内Ce6的摄取。
体内分布和保留实验:将小鼠接种4T1细胞建立乳腺癌模型,通过IVIS成像系统监测不同制剂的体内分布和肿瘤保留效果。
BBB穿透和脑积聚实验:利用bEnd.3细胞建立BBB模型,检测不同制剂的BBB穿透效率和脑积聚效果。
体内抗肿瘤和抗转移实验:对小鼠进行乳腺癌细胞皮下注射,建立原发肿瘤和肺转移模型,通过不同制剂治疗,评估其体内抗肿瘤和抗转移效果。
免疫反应评估:收集肿瘤、DLN和脾脏细胞,通过流式细胞仪和ELISA检测免疫细胞和细胞因子水平,评估免疫反应。
统计分析:所有数据以平均值±标准差表示,采用GraphPad Prism软件进行统计分析,通过学生t检验和方差分析进行两组或多组间的统计学比较。
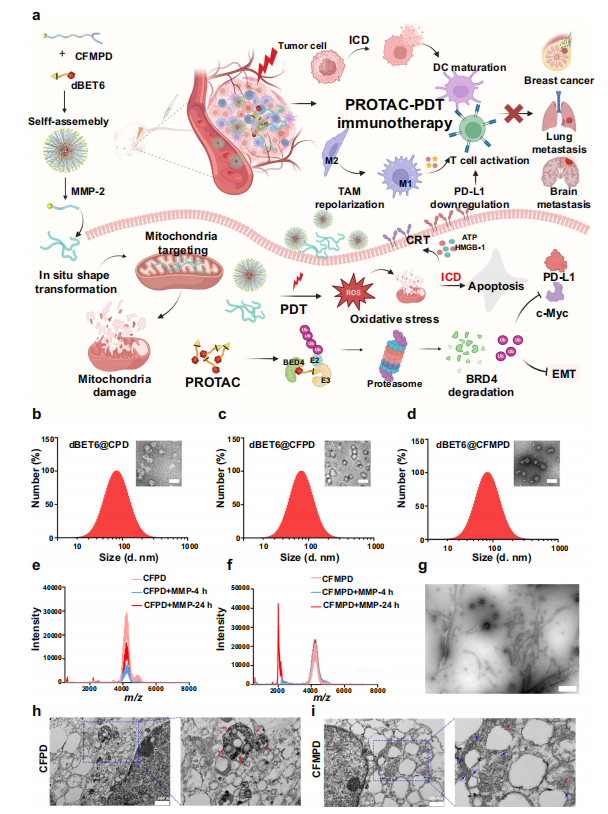
图1. 纳米药物的制备与表征。
要点:
a. 图示说明:
dBET6@CFMPD 的组成及其对原发性乳腺癌和脑转移的治疗效果。
插图由 BioRender.com 制作,并根据知识共享署名-非商业性-禁止演绎 4.0 国际许可发布。
b. 纳米药物表征:
dBET6@CPD 的动态光散射(DLS)结果和透射电镜(TEM)图像。
dBET6@CFPD 的TEM图像。
dBET6@CFMPD 的TEM图像(标尺 = 200 纳米)。
c. 分子质量变化:
CFPD 和 CFMPD 在与MMP-2孵育4小时和24小时后的分子质量变化,通过基质辅助激光解吸电离-飞行时间质谱(MALDI-TOF-MS)分析检测。
补充图 10 和 11 中包含了 e, f 的 MALDI-TOF-MS 谱图。
d. MMP-2 孵育后的TEM图像:
dBET6@CFMPD 与MMP-2孵育后的TEM图像(标尺 = 2 微米)。
e. 细胞处理后的TEM图像:
经CFPD处理的细胞的TEM图像(标尺 = 500 纳米)。
经CFMPD处理的细胞的TEM图像和放大图像。
红色箭头和蓝色箭头分别指示球状纳米颗粒和纳米纤维。
f. 数据提供:
源数据以源数据文件的形式提供。
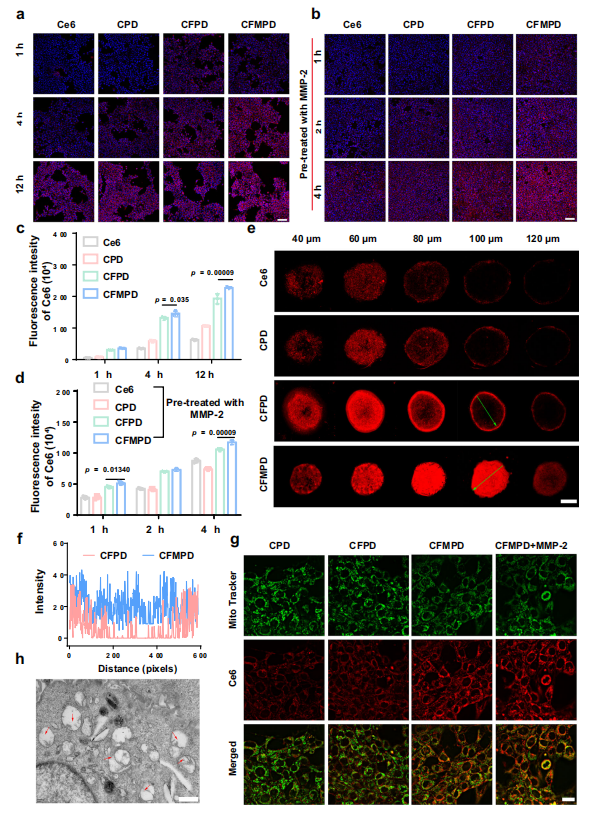
图2. 细胞摄取、保留和线粒体靶向。
要点:
a, b 细胞摄取测定:
使用荧光显微镜对不同制剂的细胞摄取进行测定(标尺 = 100 微米)。
c, d 细胞摄取测定:
使用流式细胞仪对不同制剂的细胞摄取进行测定(n = 3 个独立细胞系)。
e 共聚焦图像:
4T1 间充质干细胞与游离Ce6、CPD、CFPD和CFMPD孵育12小时后的共聚焦图像(标尺 = 100 微米)。
f 肿瘤球体切片定量分析:
对100微米厚的肿瘤球体切片进行定量分析。
g 线粒体定位分析:
对4T1细胞中不同制剂的线粒体定位进行分析(标尺 = 20 微米)。
h TEM图像:
经CFMPD处理的细胞的透射电镜图像(标尺 = 1 微米),红色箭头指示线粒体嵴。
数据表示:
所有数据均以平均值 ± 标准差(SD)的形式呈现。
统计学比较:
两组之间的比较采用双尾Student's t检验;多组之间的比较采用单因素方差(ANOVA)及Tukey后续检验。
显著性判定:
当p值 < 0.05时,认为差异具有统计学意义。
数据提供:
源数据以源数据文件的形式提供。
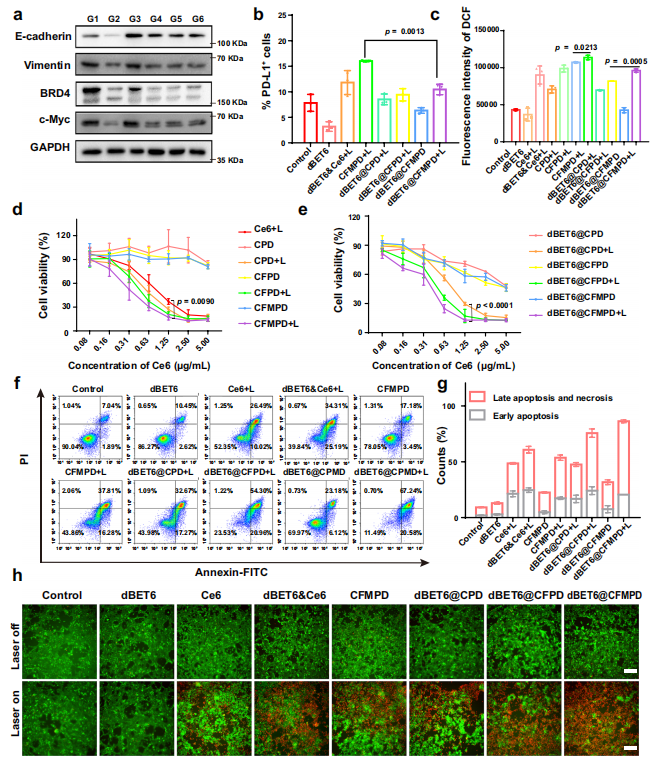
图3. BRD4抑制和体外抗肿瘤效果。
a. 通过Western blot分析4T1细胞中BRD4的抑制情况以及EMT下调情况。G1-G6分别代表对照组、dBET6&Ce6+L组、CFMPD+L组、dBET6@CPD+L组、dBET6@CFPD+L组和dBET6@CFMPD+L组。
b. 检测不同制剂处理4T1细胞后的PD-L1表达水平。
c. 通过流式细胞仪检测不同制剂处理后4T1细胞内ROS的生成情况(n=3个独立实验细胞系)。
d. 与父本纳米粒子孵育的4T1细胞进行MTT细胞活力实验。
e. 与BET6负载纳米粒子孵育的4T1细胞进行MTT细胞活力实验(n=3个独立细胞系)。
f. 检测不同制剂处理后4T1细胞的凋亡情况。
g. 统计凋亡分析的结果(n=3个独立细胞系)。
h. 对不同制剂孵育的4T1细胞进行活/死双重染色(标尺=100μm)。
所有数据以平均值±标准差表示。两组间的比较采用双尾Student's t检验,多组间的比较采用单因素方差分析(ANOVA)及Tukey事后检验。p值<0.05视为有统计学意义的差异。
源数据以Source Data文件形式提供。

图4. ICD评估、巨噬细胞极化及抗转移效果。
a, b. 通过共聚焦显微镜和流式细胞仪检测4T1细胞表面的CRT暴露情况(标尺=50μm,n=3个独立细胞系)。
c, d. 检测不同制剂孵育后肿瘤细胞外分泌的HMGB-1和ATP水平(n=3个独立细胞系)。
e–g. 检测不同制剂处理后RAW264.7细胞分泌的IL-10、TGF-β和IFN-γ水平(n=3个独立细胞系)。
h, i. 通过流式细胞仪分析不同制剂孵育后RAW264.7细胞中CD86+和CD206+细胞的丰富度(n=3个独立细胞系)。
j–l. 显微镜下观察不同制剂处理后4T1细胞的伤口愈合实验、迁移实验和侵袭分析(标尺=100μm)。
所有数据以平均值±标准差表示。两组间的比较采用双尾Student's t检验,多组间的比较采用单因素方差分析(ANOVA)及Tukey事后检验。p值<0.05视为有统计学意义的差异。
源数据以Source Data文件形式提供。
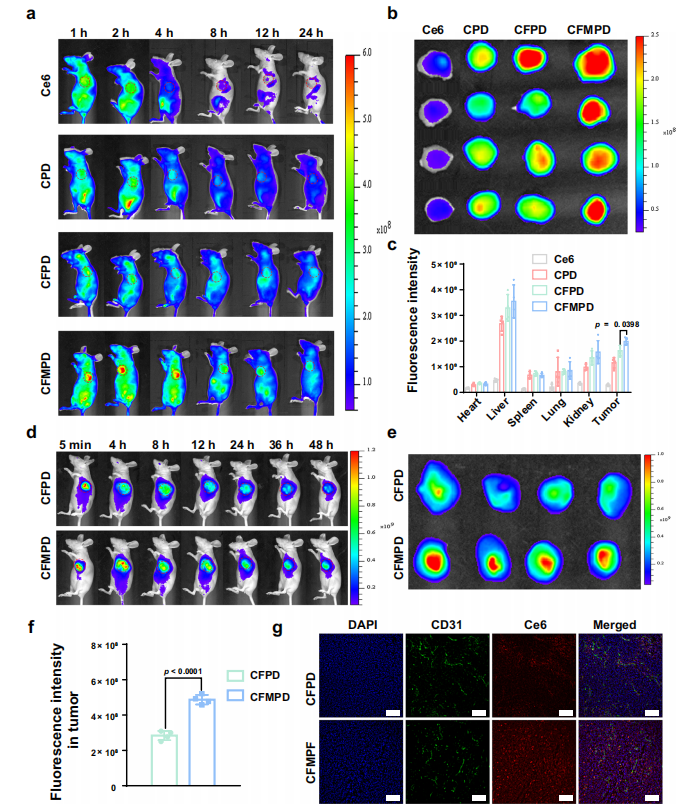
图5. 纳米药物体内靶向效率和保留效果评估。
a. 静脉注射后1、2、4、8、12、24小时对小鼠进行体内成像。
b. 肿瘤的体外成像。
c. 静脉注射后24小时对主要器官和肿瘤进行半定量分析(n=4只小鼠)。
d. 肿瘤内注射后5分钟、4、8、12、24、36和48小时对小鼠进行体内荧光成像。
e. 肿瘤的体外成像(48小时)。
f. 肿瘤的半定量分析(n=4只小鼠)。
g. 肿瘤冷冻切片的荧光分布情况(标尺=100μm)。
所有数据以平均值±标准差表示。两组间的比较采用双尾Student's t检验,多组间的比较采用单因素方差分析(ANOVA)及Tukey事后检验。p值<0.05视为有统计学意义的差异。
源数据以Source Data文件形式提供。
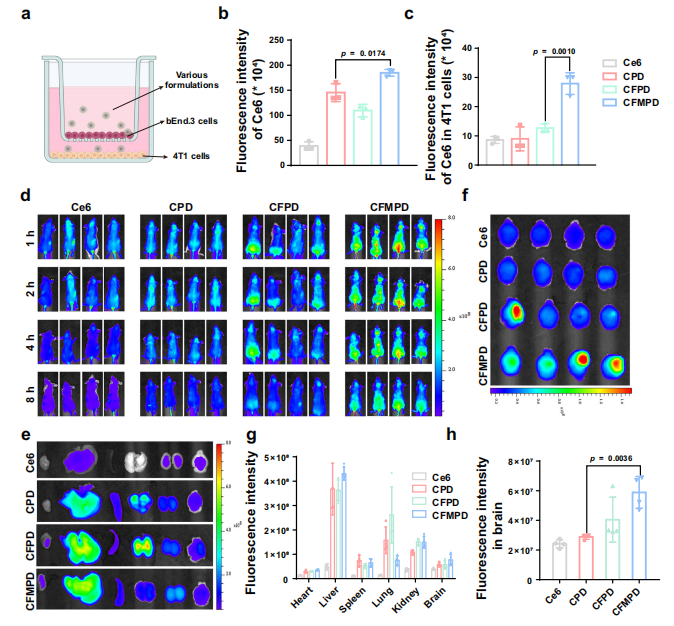
图6. 脑靶向能力评估。
a. 血脑屏障(BBB)体外构建过程示意图以及BBB穿越过程。图1a使用BioRender.com创建,并根据知识共享署名-非商业性-禁止演绎4.0国际许可发布。
b. 经过4小时纳米粒子(NPs)引入后,下室液体中的荧光强度(n=3个独立实验单元)。
c. 下室中4T1细胞摄取的纳米粒子的荧光强度(n=3个独立系)。
d. 静脉注射后1、2、4、8小时,带有脑转移肿瘤的小鼠的体内成像。
e, f. 静脉注射后8小时,主要器官和大脑的体外成像。
g, h. 主要器官和大脑的半定量分析(n=4只小鼠)。
所有数据以平均值±标准差表示。两组间的比较采用双尾Student's t检验,多组间的比较采用单因素方差分析(ANOVA)及Tukey事后检验。p值<0.05视为有统计学意义的差异。
源数据以Source Data文件形式提供。
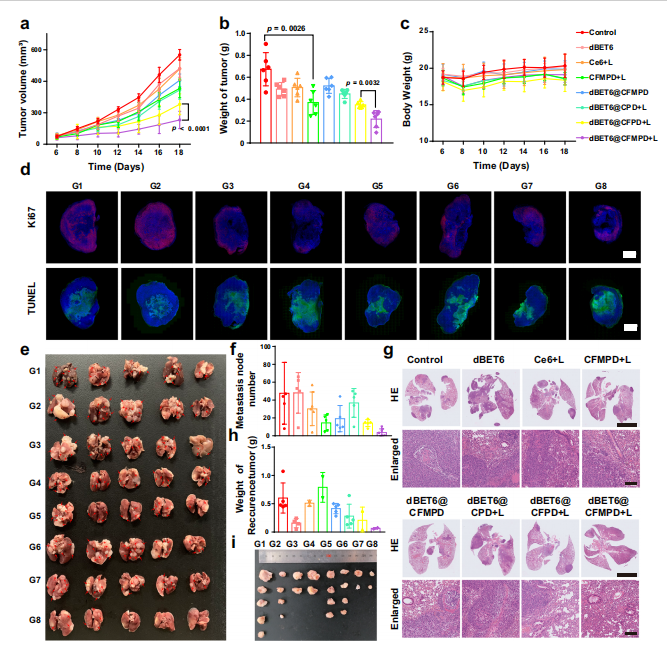
图7. 体内抗肿瘤和抗转移效果评估。
a. 每2天记录一次4T1肿瘤小鼠的肿瘤体积(n=6只小鼠)。
b. 4T1乳腺癌模型的肿瘤重量(n=6只小鼠)。
c. 接受不同制剂治疗的 mice 的体重(n=6只小鼠)。
d. 肿瘤切片的Ki67和TUNEL染色实验(标尺=2毫米)。
e, f. 肺转移的体外成像和统计结果(n=5只小鼠)。
g. 肺组织的HE染色图像(HE图像中的标尺=5毫米,放大图像中的标尺=100微米)。
h, i. 复发肿瘤的重量和体外成像(n=5只小鼠)。
G1–G8分别代表对照组、dBET6组、Ce6+L组、CFMPD+L组、dBET6@CFMPD组、dBET6@CPD+L组、dBET6@CFPD+L组和dBET6@CFMPD+L组。
所有数据以平均值±标准差表示。两组间的比较采用双尾Student's t检验,多组间的比较采用单因素方差分析(ANOVA)及Tukey事后检验。p值<0.05视为有统计学意义的差异。
源数据以Source Data文件形式提供。
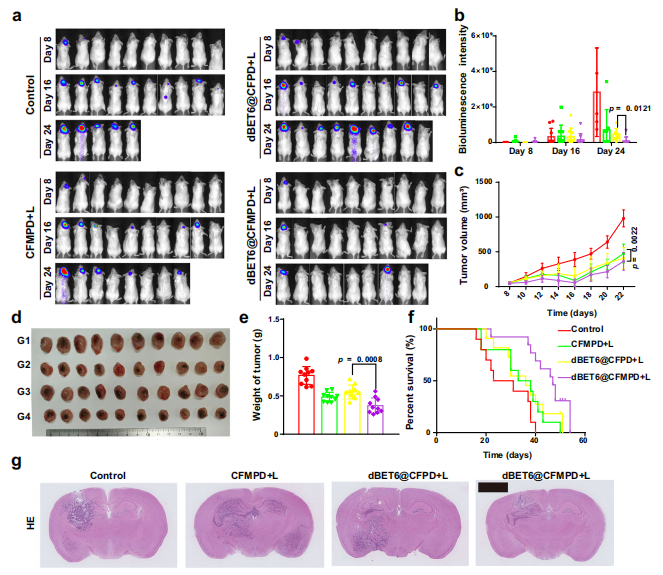
图8. 原发肿瘤和脑转移瘤的抑制效果。
a. 携带脑转移瘤的小鼠的生物发光成像。
b. 肿瘤接种后第8、16和24天的生物发光成像半定量结果(n=10只小鼠)。
c. 原发肿瘤的体积(n=10只小鼠)。
d, e. 原发肿瘤的体外成像和重量(n=10只小鼠)。G1–G4分别代表对照组、CFMPD+L组、BET6@CFPD+L组和BET6@CFMPD+L组。
f. 携带脑转移瘤和原发肿瘤的小鼠的生存率分析(n=10只小鼠)。生存研究通过双尾对数秩和检验(Mantel-Cox)进行分析。
g. 脑组织的HE染色图像(标尺=2毫米)。
所有数据以平均值±标准差表示。两组间的比较采用双尾Student's t检验,多组间的比较采用单因素方差分析(ANOVA)及Tukey事后检验。p值<0.05视为有统计学意义的差异。
源数据以Source Data文件形式提供。
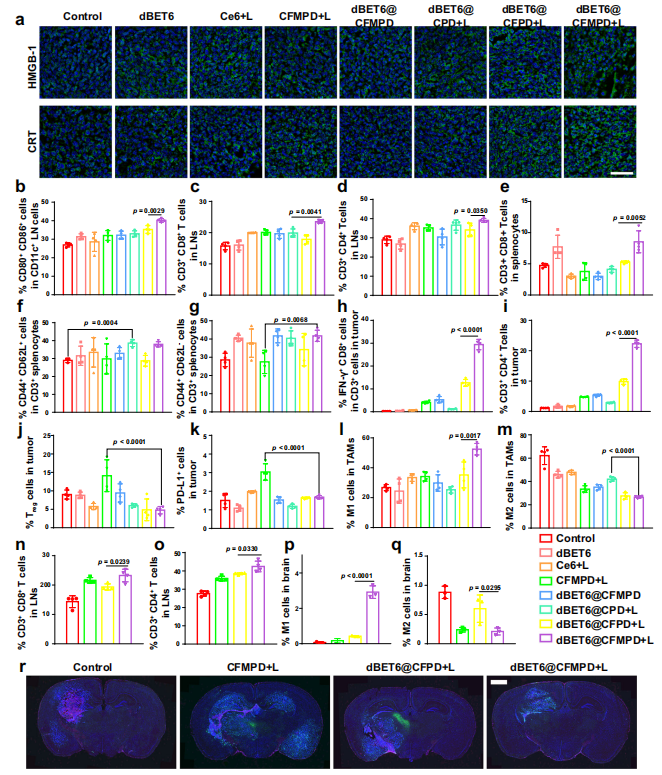
图9. 体内抗肿瘤免疫反应评估。
a. 代表性的免疫荧光图像,用于检测肿瘤切片中的CRT和HMGB1水平(标尺=50μm)。
b–d. LNs中CD80+ CD86+ DCs、CD8+ T细胞和CD4+ T细胞的百分比。脾脏中CD8+ T细胞(e)、中心记忆T细胞(Tcm,CD44+CD62L+)(f)和效应记忆T细胞(Tem,CD44+CD62L-)(g)的量化数据。
h. 肿瘤中IFN-γ+ CD8+ T细胞的丰富度(h)、CD4+ T细胞(i)和调节性T细胞(Treg细胞)(j)。
k. 不同治疗后肿瘤中PD-L1+细胞的百分比。
l, m. 肿瘤中M1(l)和M2(m)细胞的流式细胞仪分析。
n, o. 原发肿瘤和脑转移肿瘤小鼠的DLNs中CD8+ T细胞(n)和CD4+ T细胞(o)的流式细胞仪测量。
p, q. 不同治疗后大脑中M1(p)和M2(q)细胞的百分比。
r. 代表性的免疫荧光图像,观察不同处理后大脑中的CD86+和CD206+细胞(标尺=1mm)。绿色和红色荧光信号分别表示CD86和CD206。
所有实验每组n=4只小鼠。所有数据以平均值±标准差表示。两组间的比较采用双尾Student's t检验,多组间的比较采用单因素方差分析(ANOVA)及Tukey事后检验。p值<0.05视为有统计学意义的差异。
源数据以Source Data文件形式提供。
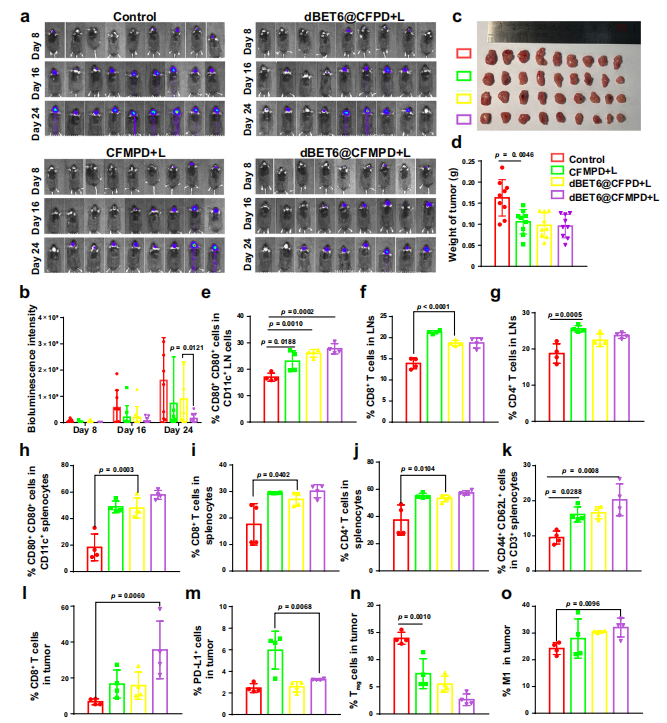
图10. E0771携带小鼠的抗转移效果和抗肿瘤免疫反应。
a. 携带脑转移瘤的小鼠的生物发光成像。
b. 肿瘤接种后第8、16和24天的生物发光成像半定量结果。
c, d. 原发肿瘤的体外成像和重量。
e–g. LNs中CD80+ CD86+ DCs、CD8+ T细胞和CD4+ T细胞的百分比。
h–k. 脾脏中CD80+ CD86+ DCs、CD8+ T细胞、CD4+ T细胞和中心记忆T细胞(Tcm细胞)的丰富度。
l–o. 肿瘤中CD8+ T细胞、PD-L1+细胞、调节性T细胞(Treg细胞)和M1细胞的丰富度。
对于原发肿瘤生长和生物发光成像研究(a, b, d),每组n=9只小鼠。对于其他研究,每组n=5只小鼠。
所有数据以平均值±标准差表示。两组间的比较采用双尾Student's t检验,多组间的比较采用单因素方差分析(ANOVA)及Tukey事后检验。p值<0.05视为有统计学意义的差异。
源数据以Source Data文件形式提供。
我们构建了一种多功能纳米药物dBET6@CFMPD,它基于MMP-2响应肽序列自我组装成球形纳米颗粒,具有可变形状和线粒体靶向能力,用于改善PROTAC的肿瘤特异性积聚并联合PDT。
dBET6@CFMPD在肿瘤中积聚后,响应MMP-2转化为纳米纤维,增强Ce6的保留以改善PDT效率,并诱导强烈的ICD。
dBET6抑制肿瘤细胞的c-Myc和PD-L1表达,通过PROTAC诱导细胞凋亡。同时,dBET6可以极化TAMs至M1表型,与ICD和PD-L1下调协同作用,重塑TIME并触发强烈的抗肿瘤免疫应答。
多功能纳米药物dBET6@CFMPD通过整合PROTAC和PDT-免疫疗法,可以重塑TIME并诱导强烈的抗肿瘤免疫应答,从而抑制原发和转移肿瘤的发展,为癌症联合治疗提供了一种策略。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:利用人源iPSC来源肝细胞培养基优化NTCP重构HepG2细胞HBV感染
下一篇:RAB6B是肝细胞癌潜在的预后标志物,并与肿瘤免疫微环境重塑相关