常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-02-19 09:27:21 细胞资源库平台 访问量:216
荧光素酶报告基因系统是一种基于荧光素酶催化底物氧化反应产生生物发光的检测技术,广泛应用于细胞生物学研究。其中,萤火虫荧光素酶(firefly luciferase, Fluc)因其高灵敏度、宽线性检测范围(约7~8个数量级)以及较短的半衰期(在哺乳动物细胞中约为3小时,在植物细胞中约为3.5小时)而成为最常用的报告基因。其发光信号强度在酶浓度为10⁻¹⁶ mol/L至10⁻⁸ mol/L的范围内与酶活性呈线性关系,并且在理想条件下可检测到低至10⁻²⁰ mol/L的荧光素酶活性。此外,荧光素酶报告基因系统具有非放射性、检测快速、灵敏度高(比氯霉素乙酰转移酶CAT高100倍)等优点,特别适用于高通量筛选和活细胞检测。通过将荧光素酶报告基因载体转染至宿主细胞后,可利用荧光素酶检测系统灵敏且便捷地监测基因表达水平,已成为细胞生物学研究中的重要工具。
英文标题:Breast Cancer Cell Colonization ofthe Human Bone Marrow AdiposeTissue Niche
中文标题:乳腺癌细胞定植于人类骨髓脂肪组织微环境
发表期刊:《Neoplasia》
影响因子:4.8
作者单位:
1.Department of Pediatrics, 150E Clark Center, 318 Campus Drive, Stanford University School of Medicine, Stanford, CA 94305-5427
2.EMD Millipore Corporation, 14 Research Park Drive, St Charles, MO 63304-5618
3.Department of Immunology, Fairchild Science Building, D033, 299 Campus Drive, Stanford University School of Medicine, Stanford, CA 94305-5124
作者信息:
Zach S. Templeton, Wen-Rong Lie, Weigi Wang, Yael Rosenberg-Hasson, Rajiv V. Alluri
乳腺癌骨转移是乳腺癌最常见的远处转移部位之一,骨转移相关事件严重影响患者的生活质量和生存时间。骨作为乳腺癌的首选转移部位,表明骨组织可能存在特定的组织学特征,吸引并促进乳腺癌细胞的生长。因此,深入研究乳腺癌骨转移的发生机制,寻找可靠的诊断手段和早期有效的治疗方法具有重要意义。
本研究使用了来自14名接受全髋关节置换术患者的股骨头样本,分离出松质骨组织碎片,用于研究乳腺癌细胞的迁移和定植模式。实验中使用了MDA-MB-231和MCF-7乳腺癌细胞系,这些细胞系被改造以稳定表达荧光素酶和绿色荧光蛋白。通过Transwell迁移实验,测量了乳腺癌细胞向骨组织条件培养基的迁移能力,并利用生物发光成像技术进行分析。同时,通过荧光显微镜和免疫组化方法评估了乳腺癌细胞在骨组织中的定植模式。此外,还对骨组织培养上清液中的细胞因子、趋化因子和脂肪因子进行了多重免疫分析,以探索与乳腺癌细胞迁移相关的分泌因子。实验结果表明,乳腺癌细胞的迁移与脂肪因子如瘦素(leptin)和白介素-1β(IL-1β)的水平显著相关。
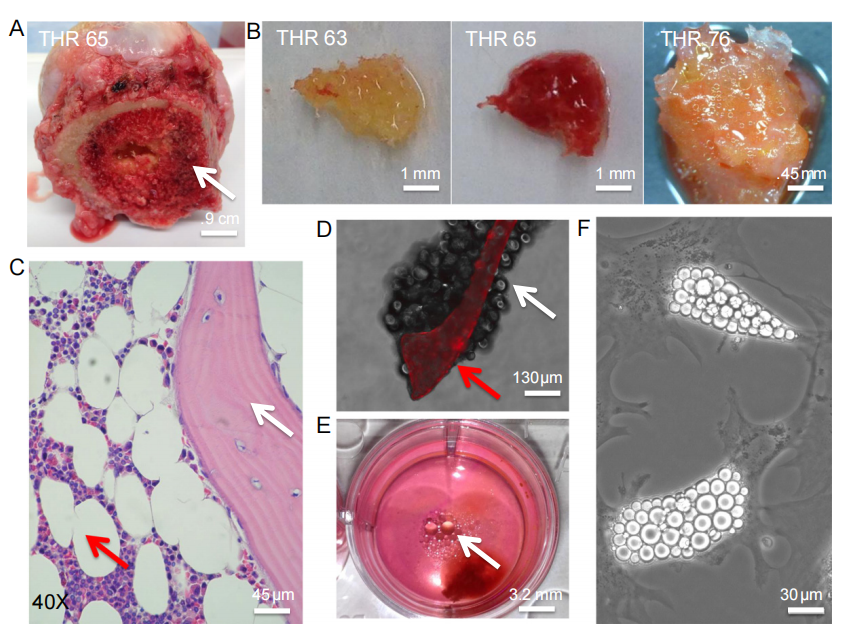
图1:骨髓脂肪组织是成熟人类骨微环境的重要组成部分
本研究通过手术切除的股骨头样本,展示了成熟人类骨微环境中脂肪组织的显著存在及其在体外模型中的可研究性。股骨头手术样本中分离出的松质骨组织碎片显示出黄色和红色骨髓含量的差异。组织学切片显示,骨髓腔内存在大量脂肪细胞“空泡”,紧邻矿化的骨小梁。荧光成像揭示了被Osteosense 680标记的矿化骨小梁周围环绕着脂肪细胞。此外,培养的骨组织碎片释放出脂肪微粒,并且可以从骨髓中分离出脂肪细胞进行培养。这些结果表明,脂肪组织是骨微环境的重要组成部分,且可在体外模型中进行研究。
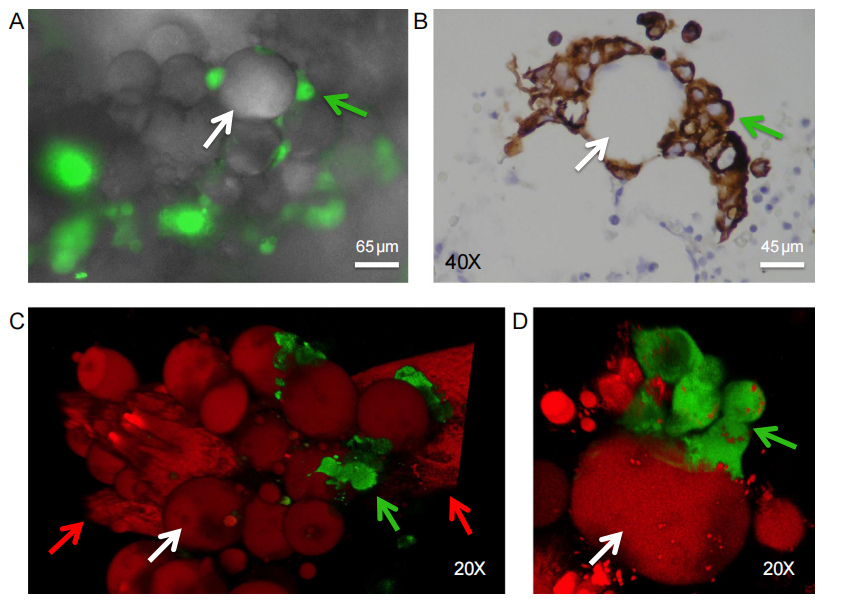
图2:乳腺癌细胞在骨髓腔定植过程中与脂肪细胞建立直接接触
在与人类松质骨组织碎片共培养过程中,乳腺癌细胞(如MCF-7-fLuc-EGFP细胞)在骨髓腔定植时与脂肪细胞建立了直接接触。荧光成像和免疫组化染色显示,乳腺癌细胞在24小时内即可与脂肪细胞直接接触,并在脂肪细胞周围定植。共聚焦显微镜进一步证实了这一现象,表明乳腺癌细胞在骨髓腔内定植过程中与脂肪细胞存在密切的相互作用。
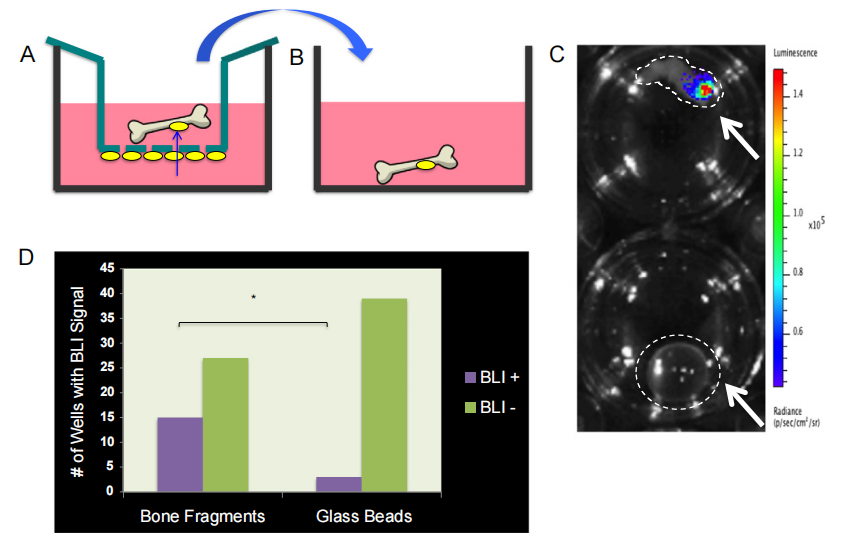
图3:乳腺癌细胞通过微孔膜向人类骨组织碎片迁移
在实验中,研究人员设计了一种非传统的“反向”迁移实验,将DA-MB-231-fLuc-EGFP细胞接种在带有8微米孔径的插入物的下表面,观察这些细胞是否能够通过微孔迁移并定植到骨组织碎片或对照组的玻璃珠上。结果显示,在24小时后,骨组织碎片比玻璃珠更频繁地被乳腺癌细胞定植,且生物发光成像(BLI)能够检测到乳腺癌细胞在骨组织碎片上的定植,但在玻璃珠上未检测到信号。实验共进行了14次,每次实验包括3个骨组织碎片和3个玻璃珠,结果表明,有生物发光信号的骨组织碎片数量(15/42)显著多于玻璃珠(3/42),P值为0.003,这表明乳腺癌细胞更倾向于向骨组织迁移。
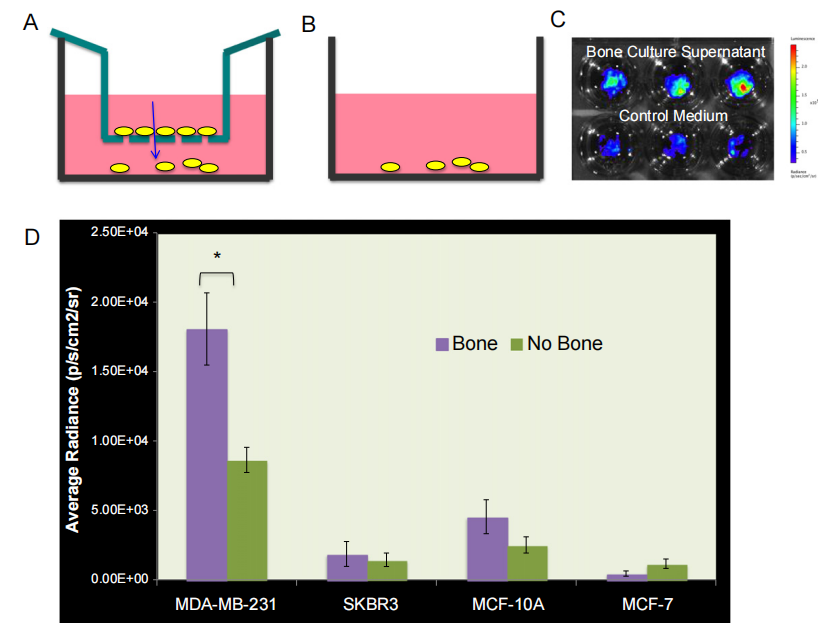
图4:乳腺癌细胞向人类骨组织条件培养基迁移
本实验采用传统迁移实验设计,将MDA-MB-231-fLuc-EGFP细胞接种在带有8微米孔径的插入物上表面,观察细胞是否能够通过微孔迁移至含有骨组织培养上清液的接收孔中。结果显示,经过20小时迁移后,MDA-MB-231-fLuc-EGFP细胞显著迁移到含有骨组织培养上清液的孔中,与对照培养基(DMEM-10% FBS)相比,迁移能力显著增强(P < 0.01)。此外,实验还比较了四种乳腺癌细胞系(MDA-MB-231-fLuc-EGFP、SKBR3-fLuc-EGFP、MCF-10A-fLuc-EGFP和MCF-7-fLuc-EGFP)向骨组织培养上清液的迁移能力,发现只有MDA-MB-231-fLuc-EGFP细胞表现出显著的迁移增强,而其他三种细胞系未观察到类似现象。这表明MDA-MB-231细胞对骨组织条件培养基具有更强的趋化性。
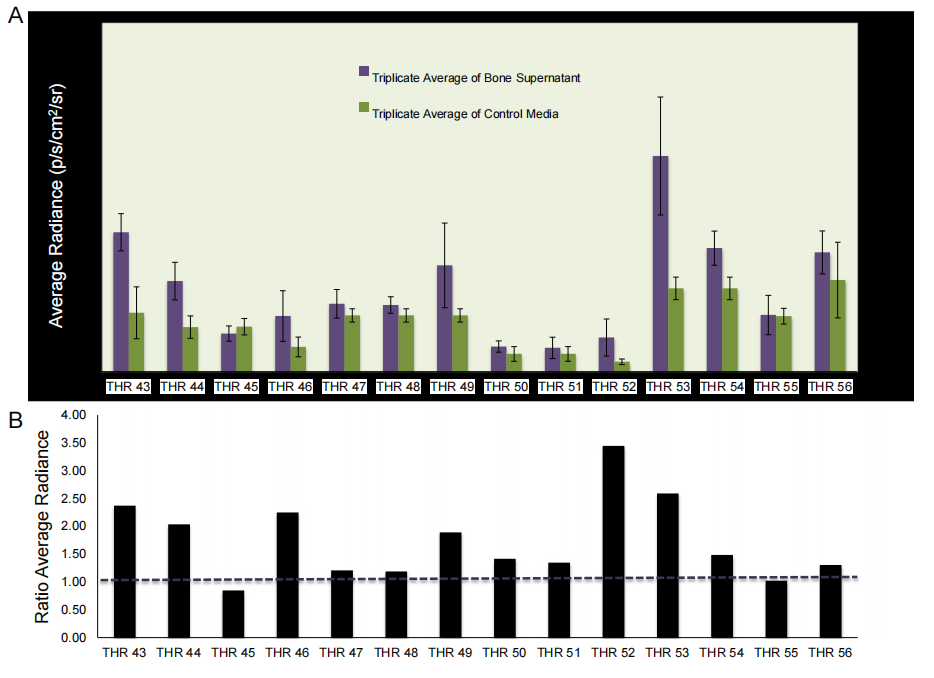
图5:MDA-MB-231乳腺癌细胞在骨组织条件培养基中的迁移能力增强
本研究通过14个全髋关节置换术(THR)样本的骨组织培养上清液,检测了MDA-MB-231-fLuc-EGFP乳腺癌细胞的迁移能力。实验结果表明,与对照培养基相比,MDA-MB-231-fLuc-EGFP细胞向骨组织条件培养基的迁移能力显著增强(P = 0.0014)。具体而言,骨组织条件培养基诱导的迁移能力平均增加了约2.5倍。这一结果表明,骨组织分泌的因子能够显著促进MDA-MB-231乳腺癌细胞的迁移,从而可能促进其在骨微环境中的定植。
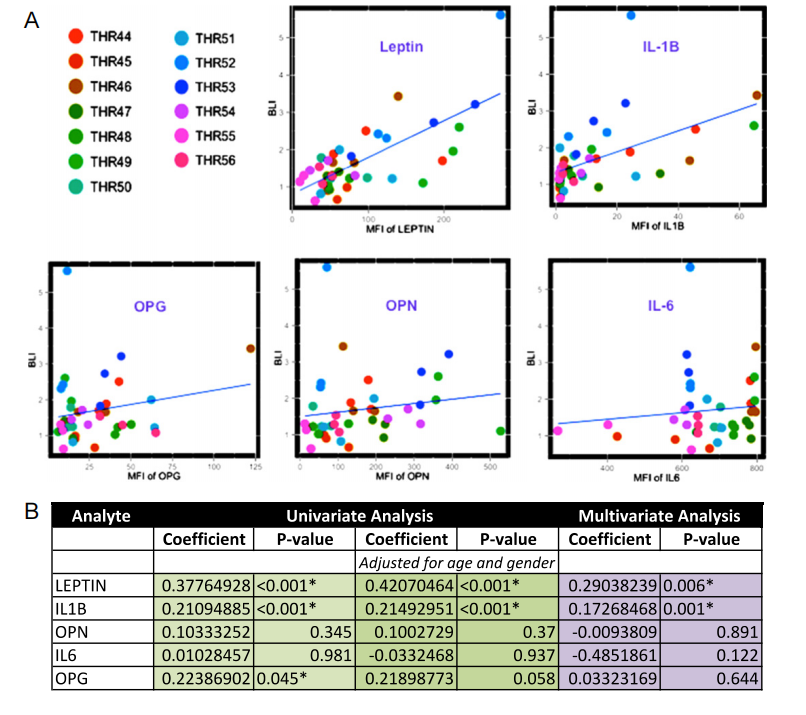
图6:MDA-MB-231乳腺癌细胞迁移与骨组织条件培养基中特定因子相关
本研究通过13个全髋关节置换术(THR)样本的骨组织条件培养基,分析了MDA-MB-231-fLuc-EGFP乳腺癌细胞的迁移能力。实验结果显示,乳腺癌细胞的迁移能力与培养基中瘦素(leptin)和白介素-1β(IL-1β)的水平显著相关。具体而言,散点图展示了乳腺癌细胞迁移能力与瘦素、IL-1β、OPG、OPN和IL-6水平的关系。通过回归分析,发现乳腺癌细胞迁移能力与瘦素和IL-1β水平呈正相关(P值均显著),而与其他因子(如OPG、OPN和IL-6)的相关性不显著。
本研究通过14个全髋关节置换术样本的松质骨组织碎片,发现乳腺癌细胞(如MDA-MB-231和MCF-7)在共培养过程中能够广泛侵入骨髓腔,并与脂肪细胞建立直接接触,显示出对脂肪细胞的偏好性迁移。实验中,MDA-MB-231-fLuc-EGFP细胞表现出显著的骨趋向性,能够通过微孔膜迁移到骨组织碎片上,并在11/14的样本中成功定植,迁移能力显著高于对照组(P = 0.003)。此外,MDA-MB-231细胞向骨组织条件培养基的迁移能力显著高于对照培养基(P = 0.0014),且与培养基中瘦素(leptin)和白介素-1β(IL-1β)水平显著相关(P < 0.0001)。这些结果表明,骨髓脂肪组织及其分泌的瘦素和IL-1β在乳腺癌细胞的骨转移过程中发挥重要作用。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
下一篇:NanoLuc标记的柯萨奇病毒A16稳定感染细胞模型