常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-02-18 10:11:36 细胞资源库平台 访问量:403
同源异体小鼠肿瘤模型是免疫肿瘤学(I/O)研究中不可或缺的临床前模型,但它们对免疫检查点抑制剂(ICIs)的反应有限,这可能是由于它们的固有低免疫原性。为了解决这一问题,研究人员通过将鸡卵清蛋白(OVA)这一高度免疫原性的蛋白质表达到同源异体肿瘤细胞中,开发了新的免疫原性同源异体模型。这些模型,如DC2.4-OVA和B16-OVA,显示出比它们的亲本细胞系更慢的肿瘤生长速度,这可能是由于免疫介导的排斥反应。更重要的是,这些OVA表达的模型对ICIs,特别是抗PD-1治疗,表现出更高的敏感性,这表明它们在增强T细胞介导的免疫反应方面具有潜力。此外,通过过继T细胞转移实验,研究人员验证了这些模型中存在肿瘤特异性记忆T细胞。这些结果表明,OVA工具细胞不仅增强了对ICIs的反应,而且为临床前免疫治疗评估提供了新的、具有更高免疫原性的同源异体模型,这对于I/O研究具有重要的意义。
英文标题:Computer-Aided Discovery of Potent Broad-Spectrum Vaccine Adjuvants
中文标题:计算机辅助发现强效广谱疫苗佐剂
发表期刊:《Angewandte Chemie International Edition》
影响因子:16.6
作者单位:
1.State Key Laboratory of Environmental Chemistry and Ecotoxicology, Research Center for Eco - Environmental Sciences, Chinese Academy of Sciences, Beijing 100085 (P. R. China).
2.School of Environmental Sciences, University of Chinese Academy of Sciences, Beijing 100049 (P. R. China).
3.Institute of Environmental Research at Greater Bays, Key Laboratory for Water Quality and Conservation of the Pearl River Delta, Ministry of Education, Guangzhou University, Guangzhou 510006 (P. R. China).
作者信息:Juan Ma、Shenging Wang、Chuanfang Zhao
当前疫苗佐剂(如铝盐和油水乳剂)虽安全性良好,但存在免疫反应范围窄、持续时间短等问题。新型佐剂(如MF59、AS01等)因靶向单一模式识别受体(PRR)或引发不良反应,临床应用受限。此外,重组蛋白疫苗抗原免疫原性较低,现有佐剂难以激发广谱持久的T/B细胞应答,导致新冠等疫苗需多次加强接种。针对这些挑战,研究提出利用计算机辅助分子设计和机器学习,开发靶向多种Toll样受体(TLR)的纳米佐剂,通过协同激活树突状细胞(DC)增强疫苗效果,为癌症免疫治疗和传染病防控提供新策略。
研究通过分子对接和机器学习分析TLR激动剂的关键结合特征(如疏水作用、氢键和π键),设计并合成了46种含芳香基团和氢键供体的TLR配体,并将其组装于5 nm金纳米颗粒(AuNP)表面。利用透射电镜、流式细胞术、ELISpot等技术,评估AuNP佐剂对骨髓源性树突状细胞(BMDC)的激活能力(如细胞因子分泌、表面标志物表达)。通过定量构效关系(QSAR)模型和随机森林算法,解析纳米颗粒-配体复合物的关键结构特征。最终在B16-OVA黑色素瘤和4T1-PD1乳腺癌小鼠模型中验证佐剂的抗肿瘤效果及免疫机制。
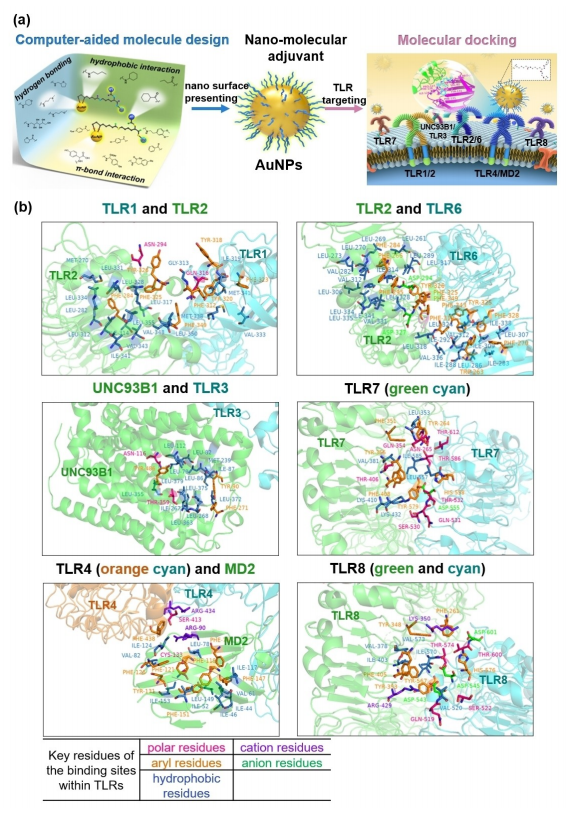
图1:计算机辅助设计的金纳米颗粒(AuNP)佐剂
a)示意图显示了通过计算机辅助设计从疏水相互作用、氢键和π-键与Toll样受体(TLR)结合获得的TLR激动剂配体(左侧)。配体呈现在金纳米颗粒表面形成AuNP佐剂(中间),靶向细胞表面和细胞内TLR(右侧)。
b)各种TLR的晶体结构以及与TLR激动剂配体结合的极性(粉色)、芳香性(橙色)、疏水性(蓝色)、阳离子(紫色)和阴离子(绿色)残基。
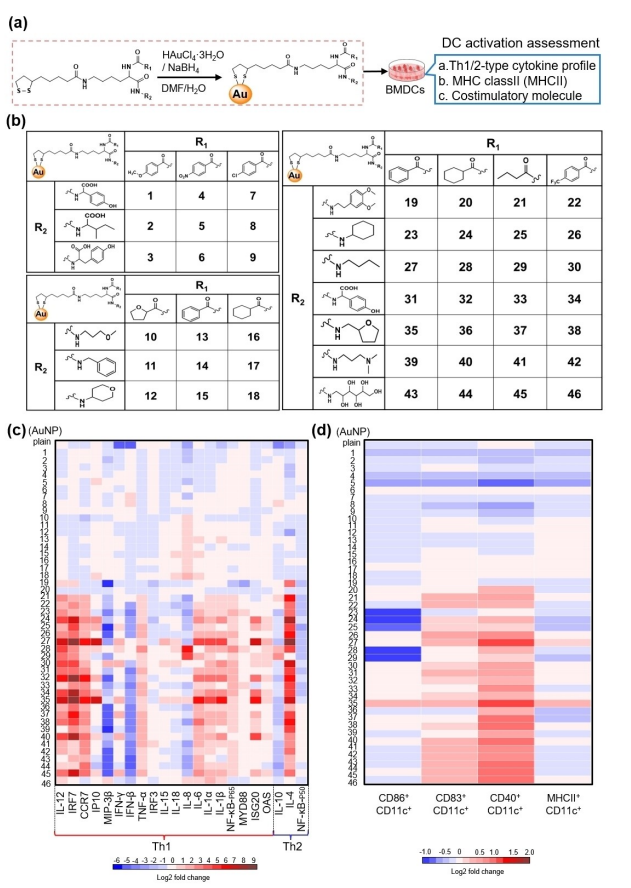
图2:金纳米颗粒(AuNP)佐剂库的合成与筛选,用于激活骨髓来源的树突状细胞(BMDCs)a) TLR激动剂配体由L-赖氨酸连接子和多样的R1和R2基团组成,通过强的金-硫键连接到金纳米颗粒表面(左侧)。所得的AuNP佐剂被测试其在BMDCs中促进树突状细胞(DC)激活的能力(右侧)。b) 包含46种成员的TLR激动剂配体库含有多种R1和R2功能基团。c) 热图显示了在2.5 µg/mL浓度下,AuNP1-46处理24小时后,BMDCs中细胞因子基因表达(c)和表面标志物表达d)的平均倍数变化,相对于未处理的空白对照(n=4)。未处理的空白对照:未用AuNP处理的BMDCs,仅添加了等体积的溶剂溶液(pgs)。普通AuNPs:表面包覆柠檬酸但未连接分子配体。
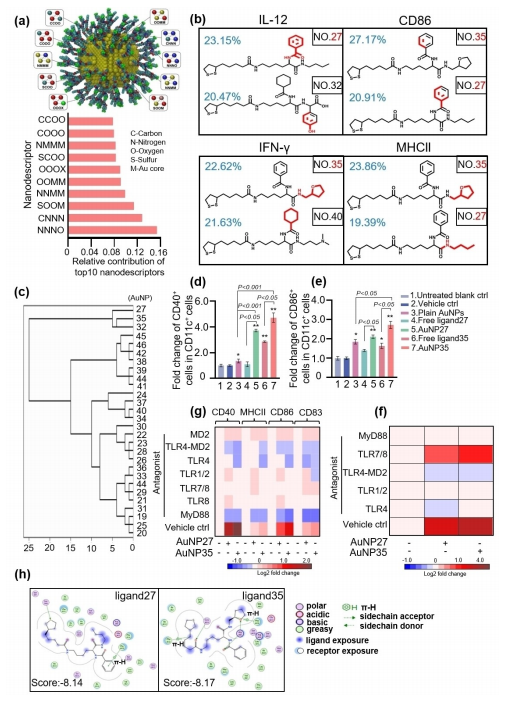
图3:展示了AuNP27和AuNP35通过其表面配体的结构特征(如苯环和四氢呋喃)以TLR依赖的方式促进BMDCs的激活,表现为增加IL-12、TNF-α的产生以及CD86和MHC-II的表达。
通过机器学习分析纳米描述符,揭示了这些纳米颗粒的物理化学性质(如尺寸、zeta电位)与BMDC反应(如细胞活力、氧化应激、细胞因子表达)之间的关系。实验结果表明,AuNP27和AuNP35显著增加了BMDCs中激活标志物的表达,且这种激活作用可通过TLR拮抗剂抑制,表明其激活依赖于TLR信号通路。此外,配体27和配体35与TLR4-MD2复合物的结合模式分析进一步揭示了其作用机制。这些结果来自至少3次独立实验,具有良好的重复性。
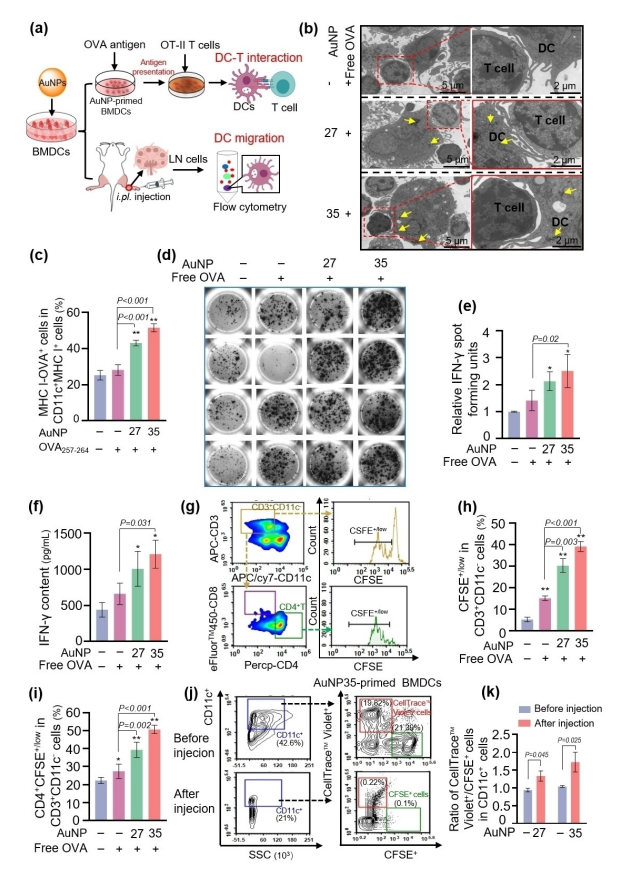
图4:展示了AuNP27和AuNP35在增强树突状细胞(DC)抗原呈递和迁移至淋巴结(LN)方面的作用。
在体外实验中,AuNP佐剂显著增强了DC的抗原呈递能力,而在体内实验中,它们促进了BMDCs向淋巴结的迁移。透射电子显微镜(TEM)图像显示,经AuNP27或AuNP35预处理的BMDCs能够与OT.I小鼠来源的CD4+ T细胞形成免疫突触。此外,AuNP处理的BMDCs在MHC-II呈递OVA复合物方面表现出更高的效率,并且在与脾细胞共培养时诱导了更多的TNF-α分泌斑点,表明其增强了T细胞的激活。流式细胞术分析显示,AuNP35显著促进了BMDCs向淋巴结的迁移,且迁移细胞的比例在注射后显著增加。这些结果表明AuNP27和AuNP35作为佐剂能够有效增强DC的抗原呈递和迁移能力,从而促进免疫反应。实验数据来自至少3次独立实验,结果具有良好的重复性。
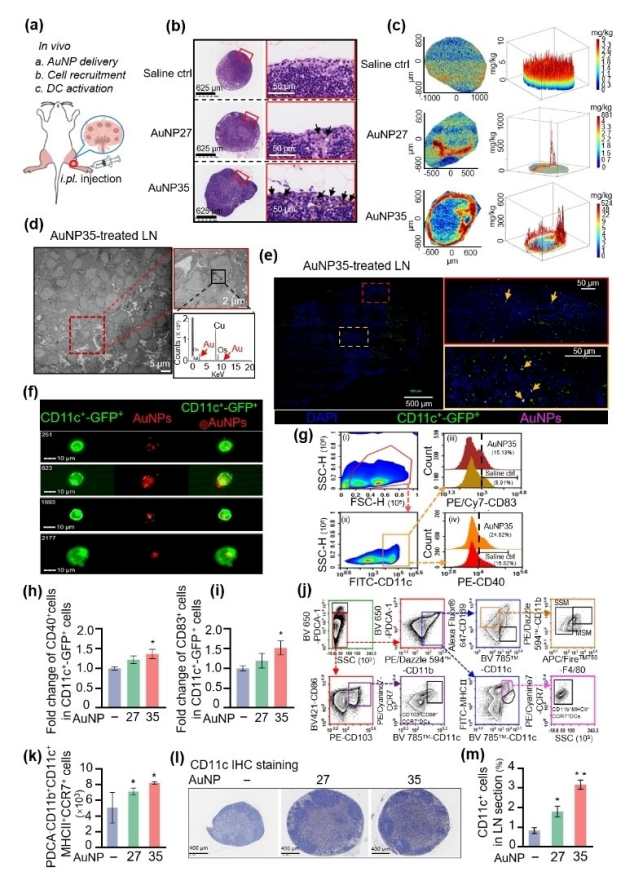
图5:研究了金纳米颗粒(AuNP)佐剂在淋巴结(LN)中与树突状细胞(DC)的相互作用及其分布
研究通过多种方法评估了AuNP在淋巴结中的分布及其引起的细胞反应。实验小鼠在腹腔注射AuNP27或AuNP35后,H&E染色显示AuNP在淋巴结中沉积但未引起组织损伤。激光剥蚀电感耦合等离子体质谱(LA-ICP-MS)分析显示,Au在淋巴结中的分布呈现聚集或积累的高信号峰。透射电子显微镜(TEM)和共聚焦显微镜图像进一步确认了AuNP在淋巴结中的存在,并显示其与CD11c+ DC细胞的邻近分布。流式细胞术分析表明,AuNP处理的小鼠淋巴结中,DC细胞的CD40和CD83表达显著增加,表明AuNP佐剂增强了DC的成熟和激活。此外,免疫组化染色显示,AuNP处理的小鼠淋巴结中CD11c+细胞的比例显著增加。这些结果表明AuNP佐剂能够有效进入淋巴结并与DC相互作用,增强其成熟和激活,从而促进免疫反应。实验数据来自至少3次独立实验,结果具有良好的重复性。
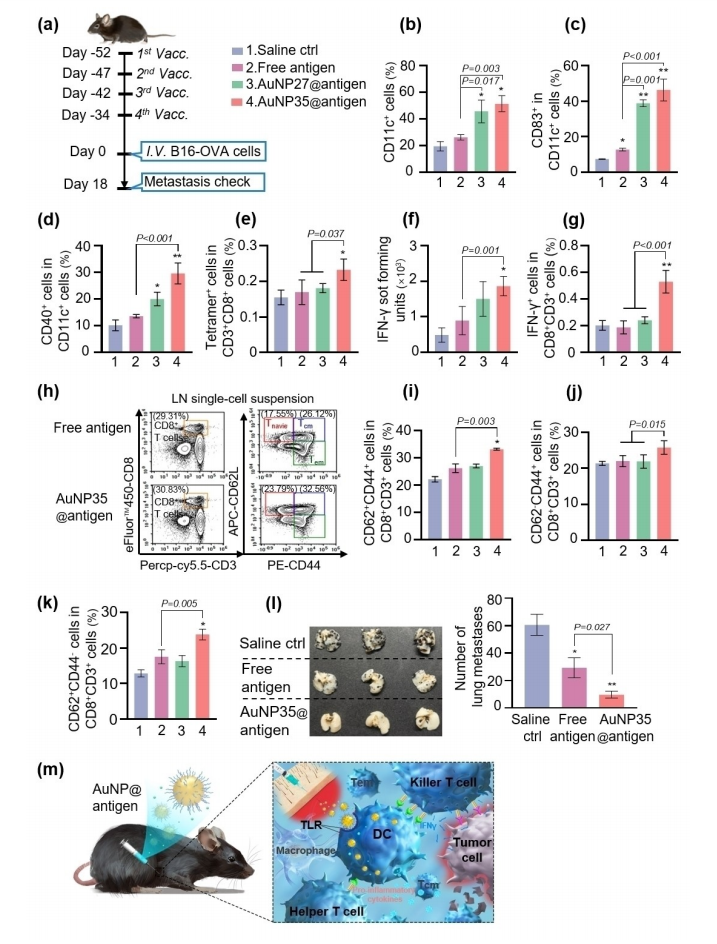
图6:研究了AuNP27和AuNP35在增强树突状细胞(DC)介导的抗肿瘤免疫中的作用
实验设计如下:C57BL/6N小鼠在肿瘤细胞注射前的第52天、47天、42天和34天,通过尾部皮下注射自由OVA抗原、AuNP27@抗原或AuNP35@抗原进行免疫。结果显示,在免疫后的第0天,AuNP处理的小鼠脾脏中树突状细胞(DCs)的成熟标志物(CD11c、CD83和CD40)表达显著增加,表明AuNP佐剂增强了DC的成熟和激活。此外,AuNP处理的小鼠脾细胞中特异性CD8+ T细胞的百分比和数量显著增加,且这些T细胞在重新刺激后表现出更高的TNF-α分泌能力。流式细胞术分析还显示,AuNP处理的小鼠淋巴结和脾脏中T细胞亚群的比例显著增加。在肿瘤挑战实验中,AuNP35@抗原免疫的小鼠肺部肿瘤结节数量最少,表明其具有更强的抗肿瘤效果。这些结果表明,AuNP27和AuNP35通过激活DC并促进抗原呈递给T细胞,有效增强了抗肿瘤免疫反应。实验数据来自每组6只生物学独立的小鼠,结果具有统计学意义。
本研究通过计算机辅助设计和机器学习,筛选出两种新型广谱疫苗佐剂(AuNP27和AuNP35),它们能够通过靶向多种Toll样受体(TLR)显著激活树突状细胞(DC),增强其抗原呈递能力和T细胞激活效率,并促进DC向淋巴结的迁移。在B16-OVA黑色素瘤和4T1-PD1乳腺癌小鼠模型中,AuNP27和AuNP35与肿瘤特异性抗原联合使用时,显著抑制了肿瘤生长和肺转移,并诱导了强烈的抗肿瘤免疫反应。这些结果表明,AuNP27和AuNP35作为一种新型纳米佐剂,具有强大的免疫激活能力,可广泛应用于疫苗开发,尤其是在癌症免疫治疗领域展现出巨大潜力。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:丙型肝炎病毒(HCV)感染周期特异性微RNA分析揭示阶段特异性miR-4423-3p靶向RIG-I以促进感染