常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-02-16 11:01:18 细胞资源库平台 访问量:581
英文标题:Low-dose metformin targets the lysosomal AMPK pathway through PEN2
中文标题:低剂量二甲双胍通过PEN2靶向溶酶体AMPK通路
发表期刊:《Nature》
影响因子:64.8
作者单位:厦门大学
作者信息:林圣彩院士团队、邓贤明团队
二甲双胍是治疗2型糖尿病的常用药物,具有抗衰老和抗癌的潜力。虽然AMPK在二甲双胍的作用机制中起重要作用,但其直接分子靶点尚未明确。
探讨二甲双胍在临床相关浓度下如何激活AMPK,以及其对细胞内AMP水平的影响。
研究者使用了多种细胞模型和生化分析方法,包括Western blot、酶活测定、细胞代谢分析等,以研究二甲双胍对溶酶体v-ATPase的抑制作用及其对AMPK激活的影响。
研究发现,二甲双胍在临床相关浓度下通过抑制溶酶体质子泵v-ATPase来激活AMPK,而不影响细胞内的AMP水平。这表明二甲双胍的作用机制可能涉及溶酶体功能的调节。
本研究揭示了二甲双胍通过抑制溶酶体质子泵v-ATPase来激活AMPK的新机制,为理解二甲双胍的生物学效应提供了新的视角,并为开发新的治疗策略提供了潜在的靶点。
微阵列基因表达谱 从GEO数据库中检索到与心肌I/R损伤相关的mRNA数据集GSE4105和miRNA数据集GSE50885。构建了小鼠心肌I/R损伤模型,并对心肌组织进行了circRNA测序。
小鼠心肌I/R损伤模型的建立 使用了104只雄性C57BL/6小鼠,其中88只用于构建心肌I/R损伤模型,76只建模成功,其余16只进行了假手术。
心肌组织circRNA测序 建立了两个小鼠心肌I/R损伤模型用于测序,并使用两个正常心脏样本作为对照。
心脏功能指数测定 建模后7天,通过超声检测小鼠的心脏功能指数。
Evans Blue/TTC双重染色 通过Evans Blue/TTC双重染色来确定心肌缺血和梗死的面积。
HE染色 对石蜡包埋的心肌组织进行HE染色,以观察组织结构。
透射电镜(TEM) 使用透射电镜观察小鼠心肌组织的超微结构。
H/R细胞模型的开发和细胞处理 从1-2天大的C57BL/6小鼠中分离出心肌细胞,并在缺氧/复氧条件下处理。
免疫荧光检测 通过免疫荧光检测LC3荧光斑点的数量和分布。
Hoechst 33258染色 使用Hoechst 33258染色来观察细胞核形态。
双荧光素酶报告基因检测 通过双荧光素酶报告基因检测来验证circ_ZNF512和miR-181d-5p之间的结合。
细胞质/核分离试验 使用PARIS试剂盒分离细胞质和核成分。
RIP实验 使用RIP试剂盒来分析circ_ZNF512/miR-181d-5p和Ago2的结合。
RNA下拉实验 通过RNA下拉实验来检测circ_ZNF512的富集。
RNA分离和定量 从心肌组织和细胞中分离并定量总RNA。
Western Blot分析 通过Western Blot分析来检测蛋白表达。
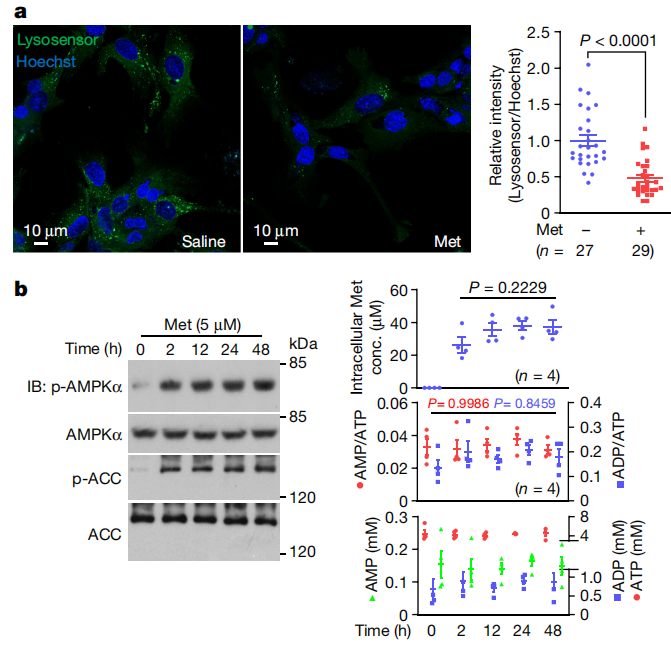
图1:二甲双胍通过不增加AMP/ADP水平激活AMPK。
a. 在小鼠原代肝细胞中,低剂量二甲双胍使溶酶体去酸化(左)。细胞用5μM二甲双胍(Met)处理2小时,Lysosensor的相对荧光强度如右图所示。
b. 二甲双胍不会增加小鼠原代肝细胞中的AMP/ADP水平。细胞用5μM二甲双胍处理指定时间后,通过免疫印迹(IB;左)分析磷酸化的(p)-AMPKα和p-ACC,通过质谱法(底部右)分析AMP/ATP和ADP/ATP比率,AMP、ADP和ATP的绝对浓度。用PBS洗涤三次后,通过质谱法(顶部右)测量细胞内二甲双胍浓度(conc.)。有关凝胶源数据,请参见补充图1。数据为均值 ± 标准误差,n值在每个面板上都有标记。P值使用双侧Mann–Whitney检验(a)或单因素方差分析(ANOVA)后进行Tukey检验(b,底部右)或Sidak检验(b,顶部右)计算。a中的实验进行了三次,b中的实验进行了五次。
低剂量二甲双胍能够使小鼠原代肝细胞中的溶酶体去酸化。
二甲双胍处理后,通过免疫印迹检测到磷酸化的AMPKα和p-ACC水平增加,表明AMPK被激活。
质谱分析显示,二甲双胍处理后,细胞内的AMP/ATP和ADP/ATP比率没有显著变化,AMP、ADP和ATP的绝对浓度也没有增加。
实验结果表明,二甲双胍通过不增加AMP/ADP水平来激活AMPK。
本研究中的实验重复次数分别为a部分三次,b部分五次,以确保数据的可靠性。
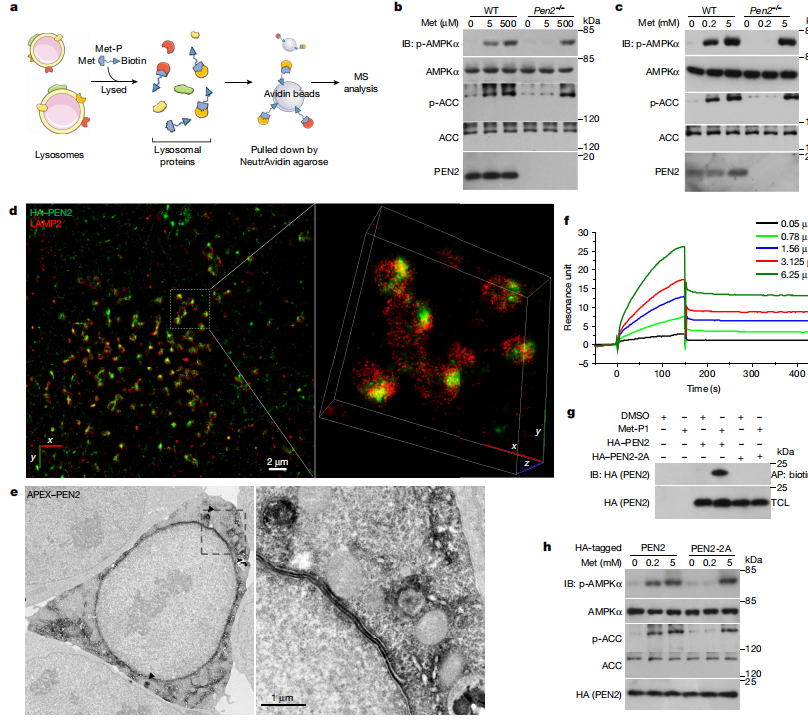
图2:PEN2与二甲双胍结合,并且是低剂量二甲双胍诱导的AMPK激活所必需的
a. 一个示意图,展示了使用光活性二甲双胍探针(Met-P)从纯化自MEFs的溶酶体蛋白提取物中识别二甲双胍靶点的亲和力为基础的方法。MS,质谱。
b, c. Pen2基因敲除阻断了低剂量二甲双胍激活的AMPK。小鼠原代肝细胞(b)和MEFs(c;克隆1,除非另有说明,否则后续均为此克隆)分别用5μM和200μM二甲双胍处理2小时和12小时,然后分析p-AMPKα和p-ACC。WT,野生型。
d, e. MEFs的STORM图像(d)和HEK293T细胞的TEM图像(e)显示PEN2的一部分定位于溶酶体(e,黑色箭头),并与溶酶体标记物LAMP2(d)重叠。
f, g. PEN2能够与二甲双胍结合。f, 在SPR测定中,PEN2与指定浓度的二甲双胍孵育。g, 在Met-P1结合测定中,转染PEN2或PEN2-2A的HEK293T细胞被裂解,与10μM Met-P1孵育,然后生物素化,接着进行生物素化蛋白质的亲和力沉淀(AP)。
h. PEN2-2A不介导二甲双胍激活的AMPK。Pen2–/– MEFs重新引入了带有HA标签的PEN2-2A,用200μM二甲双胍处理12小时,然后分析p-AMPKα和p-ACC。有关凝胶源数据,请参见补充图1。本图中的实验进行了三次,除了b和c,它们进行了四次。
通过亲和力方法,使用光活性二甲双胍探针(Met-P)从MEFs的溶酶体蛋白提取物中鉴定出二甲双胍的靶点,并通过质谱进行确认。
在小鼠原代肝细胞和MEFs中,Pen2基因敲除后,低剂量二甲双胍无法激活AMPK,表明PEN2在二甲双胍激活AMPK中起关键作用。
STORM和TEM图像显示,PEN2在MEFs和HEK293T细胞中部分定位于溶酶体,并与溶酶体标记物LAMP2重叠。
SPR和Met-P1结合测定表明,PEN2能够与二甲双胍结合。
在Pen2–/– MEFs中重新引入PEN2-2A后,二甲双胍无法激活AMPK,说明PEN2-2A不介导二甲双胍的AMPK激活作用。
本图中的实验重复次数为三次,除了b和c部分进行了四次,以确保结果的可靠性。
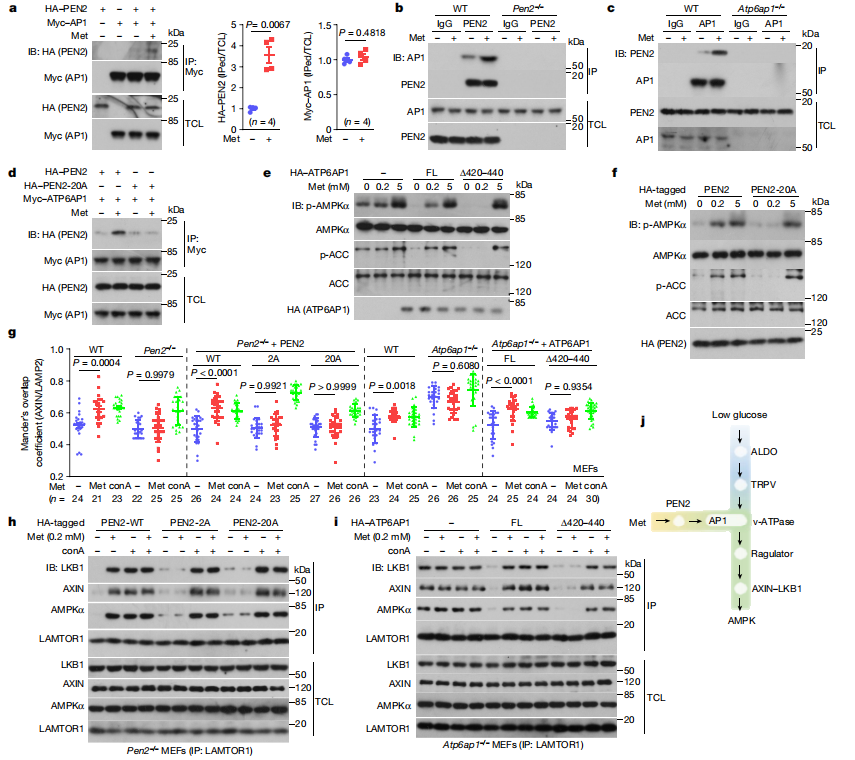
图3:ATP6AP1将PEN2与v-ATPase连接起来以激活AMPK
a–c. 通过免疫共沉淀(IP)和免疫印迹(IB)确定ATP6AP1是PEN2的相互作用蛋白。a, 在表达HA–PEN2或Myc–ATP6AP1的HEK293T细胞裂解物中孵育10μM二甲双胍,然后进行PEN2和AP1蛋白的免疫共沉淀。b, c, 分别在野生型MEFs、Pen2–/– MEFs或Atp6ap1–/– MEFs的裂解物中孵育10μM二甲双胍,然后进行PEN2和AP1蛋白的免疫共沉淀。
d. 二甲双胍不促进ATP6AP1与PEN2-20A之间的相互作用。转染HA标签的PEN2或PEN2-20A的HEK293T细胞裂解物按照a中的方法处理,然后通过IP和IB分析ATP6AP1与PEN2的相互作用。
e–i. 失去PEN2–ATP6AP1相互作用会废除二甲双胍对AMPK激活的影响。e, 在Atp6ap1–/– MEFs中重新引入ATP6AP1Δ420–40,f, 在Pen2–/– MEFs中重新引入PEN2-20A突变体,然后用200μM二甲双胍处理12小时,随后分析p-AMPK和p-ACC。g–i, 分析了ATP6AP1和PEN2突变体对AXIN向溶酶体转运(g)以及AXIN为基础的复合物形成(h, i)的影响。Concanamycin A(conA;5μM,2小时)用作对照。FL,全长。
j. 一个示意图,展示了二甲双胍–PEN2–ATP6AP1和FBP–醛缩酶轴构成两条汇合到v-ATPase的输入分流,通过溶酶体途径引发AMPK激活。有关凝胶源数据,请参见补充图1。数据为均值 ± 标准误差,n值在每个面板上都有标记,P值使用双侧Student’s t检验(a,针对Myc–ATP6AP1)、双侧Student’s t检验带Welch’s校正(a,针对HA–PEN2)或双向ANOVA,随后进行Tukey’s检验(g)计算。本图中的实验进行了三次,除了a部分进行了四次,h和i部分进行了五次。
通过免疫共沉淀和免疫印迹技术,确定了ATP6AP1是PEN2的相互作用蛋白,并且这种相互作用在二甲双胍处理后增强。
二甲双胍不促进ATP6AP1与PEN2-20A之间的相互作用,表明PEN2的特定区域对于与ATP6AP1的结合是必要的。
在Atp6ap1–/– MEFs中重新引入ATP6AP1Δ420–440突变体,以及在Pen2–/– MEFs中重新引入PEN2-20A突变体后,二甲双胍无法激活AMPK,说明PEN2–ATP6AP1相互作用对于二甲双胍激活AMPK是必需的。
分析了ATP6AP1和PEN2突变体对AXIN向溶酶体转运以及AXIN为基础的复合物形成的影响,发现这些过程受到PEN2–ATP6AP1相互作用的影响。
提出了一个模型,说明二甲双胍通过与PEN2结合,进而与ATP6AP相互作用,最终通过溶酶体途径激活AMPK。
本图中的实验重复次数为三次,除了a部分进行了四次,h和i部分进行了五次,以确保结果的可靠性。
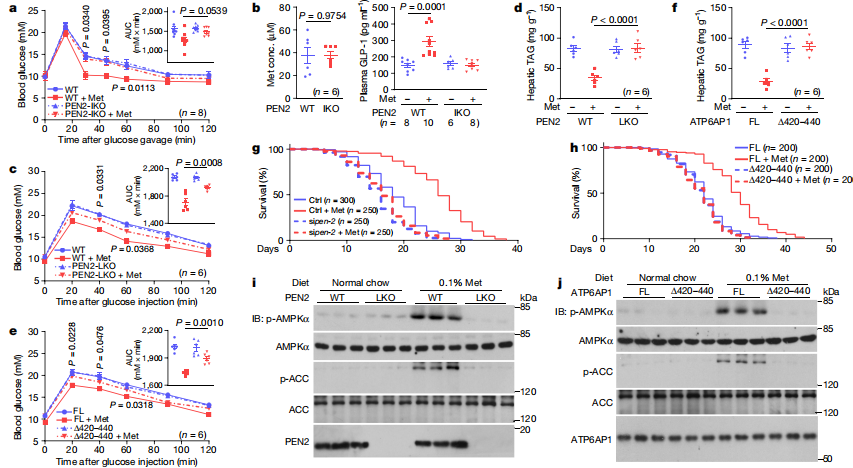
图4:PEN2和ATP6AP1是二甲双胍生物效应所必需的
a, b. 肠道PEN2对于二甲双胍诱导的血糖降低效应是必需的。PEN2-IKO小鼠按照扩展数据图12d所示给予二甲双胍。然后进行口服葡萄糖耐量测试分析(a)、测量十二指肠二甲双胍浓度(b,左)以及在葡萄糖灌胃前后的血浆GLP-1水平测量(b,右)。
c, d. PEN2对于二甲双胍诱导的肝脏脂肪减少是必需的。在肝脏中特异性敲除Pen2的小鼠按照扩展数据图12f所示给予二甲双胍。在二甲双胍治疗16周后,显示小鼠的腹腔内葡萄糖耐量测试结果(c)和肝脏TAG水平(d)。
e, f. ATP6AP1对于二甲双胍诱导的肝脏脂肪减少是必需的。小鼠按照扩展数据图12m所示给予二甲双胍。在二甲双胍治疗16周后,显示小鼠的腹腔内葡萄糖耐量测试结果(e)和肝脏TAG水平(f)。
g, h. PEN2和ATP6AP1是二甲双胍诱导的寿命延长所必需的。用siRNA敲低pen-2(T28D6.9)的WT(N2)线虫(g)或表达全长ATP6AP1或ATP6AP1Δ420–440的ATP6AP1–/–(vha-19)线虫(h)用50 mM二甲双胍处理。寿命数据以Kaplan–Meier曲线显示(统计分析见补充表3)。Ctrl,对照。
i, j. PEN2和ATP6AP1是饮食中0.1%二甲双胍诱导的AMPK激活所必需的。5周龄的PEN2-LKO小鼠(i;4周龄时注射他莫昔芬)或8周龄的表达ATP6AP1Δ420–440的ATP6AP1-LKO小鼠(j;4周龄时注射病毒,5周龄时注射他莫昔芬)按照之前描述的方法10给予含有0.1%二甲双胍的正常饲料1周。然后通过免疫印迹分析肝脏AMPK激活。有关凝胶源数据,请参见补充图1。数据以均值 ± 标准误差显示,n值在每个面板上都有标记,P值使用双向重复测量ANOVA,随后进行Tukey’s检验(a, c和e比较WT/ATP6AP1-FL + Met组和PEN2-IKO/LKO/ATP6AP1Δ420–440 + Met组在每个时间点的血糖水平;另见a, c和e的插图中的接收者操作特征曲线(AUC)值,以及使用双向ANOVA,随后进行Tukey’s检验的P值),双侧Student’s t检验(b,左),以及双向ANOVA,随后进行Tukey’s检验(b的右图板,以及d, f)。本图中的实验进行了三次。
肠道PEN2对于二甲双胍诱导的血糖降低效应是必需的,PEN2-IKO小鼠在给予二甲双胍后血糖降低效果减弱。
PEN2对于二甲双胍诱导的肝脏脂肪减少是必需的,肝脏特异性敲除Pen2的小鼠在给予二甲双胍后肝脏脂肪减少效果减弱。
ATP6AP1对于二甲双胍诱导的肝脏脂肪减少是必需的,ATP6AP1–/–小鼠在给予二甲双胍后肝脏脂肪减少效果减弱。
PEN2和ATP6AP1是二甲双胍诱导的寿命延长所必需的,敲低pen-2或ATP6AP1–/–的线虫在给予二甲双胍后寿命延长效果减弱。
PEN2和ATP6AP1是饮食中0.1%二甲双胍诱导的AMPK激活所必需的,PEN2-LKO和ATP6AP1-LKO小鼠在给予含有0.1%二甲双胍的饲料后肝脏AMPK激活效果减弱。
本图中的实验重复次数为三次,以确保结果的可靠性。
PEN2是二甲双胍的靶点,通过与ATP6AP1结合抑制v-ATPase的活性,激活溶酶体AMPK,从而实现二甲双胍的有益效应。
PEN2-ATP6AP1轴与溶酶体v-Pase-AXIN-AMPK轴相交,使低浓度的二甲双胍能够利用AMP独立的AMPK激活途径,类似于葡萄糖饥饿或卡路里限制。
PEN2-ATP6AP1轴对于二甲双胍的三大有益效应——餐后血糖降低、肝脏脂肪减少和寿命延长——是必需的,这些效应严格依赖于AMPK。
二甲双胍通过促进肠道GLP-1的分泌以依赖AMPK的方式降低血糖,但低剂量的二甲双胍不抑制肝脏糖异生。
PEN2-ATP6AP1轴还参与二甲双胍抑制mTORC1信号传导,但mTORC1的抑制不涉及由AMPK介导的有益效应。
二甲双胍信号与溶酶体AMPK途径的交叉,而不干扰AMP/ADP水平,可能是二甲双胍具有许多益处而副作用较少的原因。
PEN2-ATP6AP1轴为筛选二甲双胍的替代品提供了潜在目标,这可能适用于更广泛的组织,如肌肉,从而在治疗糖尿病和其他代谢疾病方面产生更好的疗效。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:新型NanoLuc底物实现动物体内明亮的双群体生物发光成像
下一篇:免疫调节和RNA干扰对乙型肝炎病毒特异性CD8T细胞识别HepG2-NTCP感染细胞的影响