常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-02-16 13:18:26 细胞资源库平台 访问量:405
在生物医学研究和药物开发领域,生物发光成像技术因其高信噪比而被广泛应用于细胞测定和动物成像研究。然而,传统的荧光素酶种类有限,限制了同时成像多个分子和细胞事件的能力。为了突破这一限制,科学家们开发了一种新型的ATP非依赖性荧光素酶——NanoLuc(NL),它源自深海虾Oplophorus
gracilirostris,并经过工程改造以增强蛋白质稳定性。NanoLuc作为一种小型(19
kDa)、高亮度的荧光素酶,其亮度是传统萤火虫或海肾荧光素酶的100倍,并且使用furimazine作为底物产生明亮的辉光型发光。
NanoLuc的意义在于其为双报告基因生物发光分子成像提供了新的可能。它不仅可以在活体小鼠的表层和深层组织中成像,而且其生物发光随时间的变化可以用来定量肿瘤生长,甚至在少量血清中也能检测到分泌的NL。此外,NanoLuc与萤火虫荧光素酶的结合使用,为在完整细胞和活体小鼠中定量TGF-β信号传导的两个关键步骤提供了一种新型双荧光素酶成像策略,从而在正常生理、疾病和药物开发中扩展了信号转导的成像能力。NanoLuc的作用不仅体现在其高灵敏度和高稳定性上,它还具有更小的尺寸,这使得在标记细胞和蛋白质时对样本的侵入性更小,有助于保持细胞或组织的天然状态。NanoLuc的快速反应、低背景发光和多样灵活等特点,使其在生物学和医学研究中具有广泛的应用前景。因此,NanoLuc作为一种新的报告基因,不仅增强了我们对生物过程的理解和疾病机理的研究,而且在开发潜在治疗方法和疗法方面发挥了重要作用。
英文标题:Novel NanoLuc Substrates Enable Bright Two-Population Bioluminescence Imaging in Animals
中文标题:新型NanoLuc底物实现动物体内明亮的双群体生物发光成像
发表期刊:《Nature Methods》
影响因子:36.1
作者单位:
1. Department of Neurobiology, Stanford University, Stanford, CA, USA.
2. Department of Bioengineering, Stanford University, Stanford, CA, USA.
3. Promega Biosciences LLC, San Luis Obispo, CA, USA.
4. Promega Corporation, Madison, WI, USA.
作者信息:Yichi Su, Joel R. Walker, Yunhee Park, Thomas P. Smith, Lan Xiang Liu, Mary P. Hall, Louai Labanieh, Robin Hurst, David C. Wang, Lance P. Encell, Namdoo Kim, Feijie Zhang, Mark A. Kay, Kerriann M. Casey, Robbie G. Majzner, Jennifer R. Cochran, Crystal L. Mackall, Thomas A. Kirkland, Michael Z. Lin
生物发光成像的目标是实现体内对两个生物事件的敏感检测。Antares是一种由NanoLuc荧光素酶和橙色荧光蛋白CyOFP融合而成的明亮生物发光报告基因,具有与萤火虫荧光素酶(FLuc)及其衍生物如AkaLuc正交的底物特异性。然而,Antares在老鼠中的亮度受到其底物furimazine溶解度和生物利用度差的限制。生物发光成像的优势在于无需激发光,因此在成像过程中不会产生自发荧光,只有通过自发底物发射产生的背景,这对于常用的底物来说是微不足道的,从而可以实现非常高的信噪比,能够非侵入性地成像深层组织中的细胞,检测限低于荧光。为了提高基于NanoLuc的生物发光成像在动物体内的敏感性,提高其底物的溶解性和生物利用度是至关重要的。研究人员假设可以通过开发新的NanoLuc底物来进一步提高NanoLuc基底的体内生物发光报告。为此,他们开发了两种新的NanoLuc底物:hydrofurimazine (HFz)和fluorofurimazine (FFz),它们在水性溶液中的溶解度更高,能够在体内产生更高的剂量。这些新型底物能够在体内产生更高的亮度,允许基于Antares的报告基因在深层组织中进行高分辨率和长时间的动态事件追踪,同时Antares与FFz和AkaLuc与AkaLumine可以用于同一主题的双生物发光成像。
研究人员首先以furimazine为基础,通过化学合成引入极性取代基,开发出新型NanoLuc底物hydrofurimazine和fluorofurimazine。这些底物具有更高的水溶性和生物利用度,能够向小鼠体内递送更高剂量。在实验中,研究人员将这些底物与Antares荧光素酶结合,通过腹腔注射到表达Antares的小鼠体内,观察其在肝脏中的亮度表现。结果显示,hydrofurimazine在肝脏中的亮度与AkaLuc及其底物AkaLumine相似,而fluorofurimazine在体内表现出更高的亮度。此外,研究人员还利用Antares与fluorofurimazine追踪肿瘤大小,同时使用AkaLuc与AkaLumine可视化CAR-T细胞,实现了在同一小鼠上对两种细胞群体的双色生物发光成像。
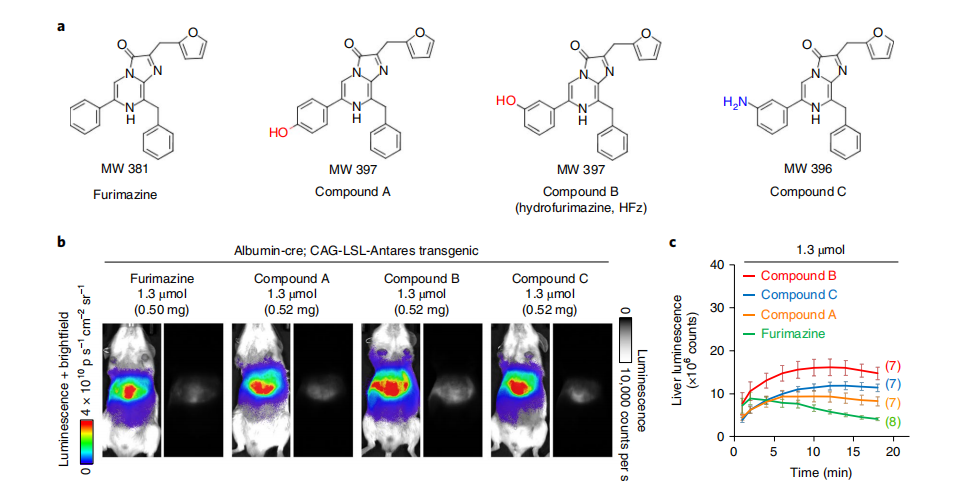
图1:新型furimazine衍生物的体内筛选
研究人员对新型furimazine衍生物进行了体内筛选。首先,展示了这些生物发光底物的结构及其分子量。接着,使用表达Antares蛋白的小鼠(具有albumin-Cre和CAG-loxP-stop-loxP-Antares基因),在肝脏中观察不同底物注射后的生物发光情况。实验结果以两种图像格式展示:左侧为线性伪彩色生物发光强度图像叠加在明场图像上,这是动物生物发光常用的显示方式;右侧为原始灰度图像,直观地评估相对亮度并可视化解剖特征,尽管这种格式在荧光成像中是标准的,但在动物生物发光中很少使用。图像的曝光时间为1秒,像素合并为1,光圈为8。最后,研究人员记录了不同注射剂量下每种底物的平均生物发光强度随时间的变化,并以标准误差表示,实验小鼠的数量在括号中注明。
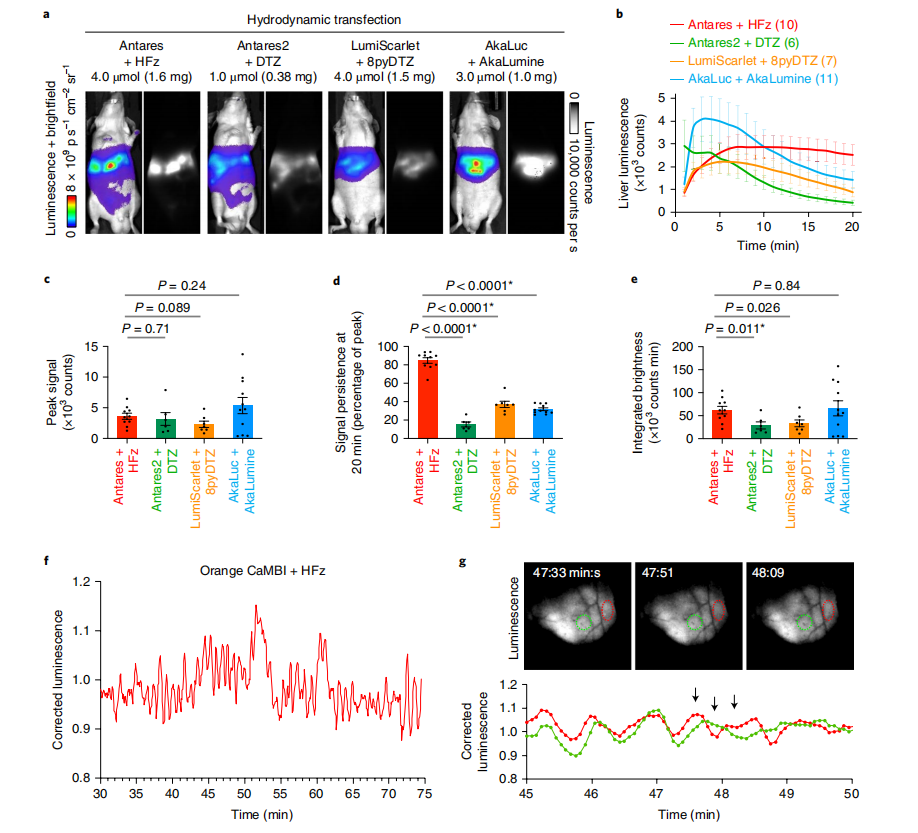
图2:化合物B(HFz)的体内表征与应用
研究人员对化合物B(HFz)进行了详细的体内表征和应用研究。首先,在J:NU小鼠中通过水动力转染法导入编码Antares、Antares2、LumiScarlet或AkaLuc的质粒,并腹腔注射相应荧光素酶的最大量。在最大亮度时间点拍摄的生物发光图像显示了相同的强度标度,曝光时间为1秒,像素合并为1,光圈为1.2。接着,研究了不同荧光素酶-底物系统的肝脏平均信号强度随时间的变化,并以标准误差表示,实验小鼠的数量在括号中注明。此外,计算了三个系统的平均峰值信号强度,并量化了信号持续性(以20分钟时的强度除以峰值强度表示)以及从0到20分钟的总积分信号。在c-e部分,误差条表示标准误差,P值通过双尾Welch不配对t检验得出,星号表示P值低于0.0167(根据Bonferroni方法,三次比较的总体α水平为0.05)时的统计显著差异。最后,利用Orange CaMBI和延长释放的化合物B(HFz)对小鼠肝脏中的钙进行生物发光成像,揭示了肝脏某一区域的钙振荡。原始发光信号通过拟合单指数衰减曲线校正底物衰减。顶部的生物发光图像显示了CaMBI活性的局部变化,下方的生物发光强度显示了两个区域的信号变化,箭头指示了三个图像对应的时间点。f和g部分的结果独立重复两次,结果相似。
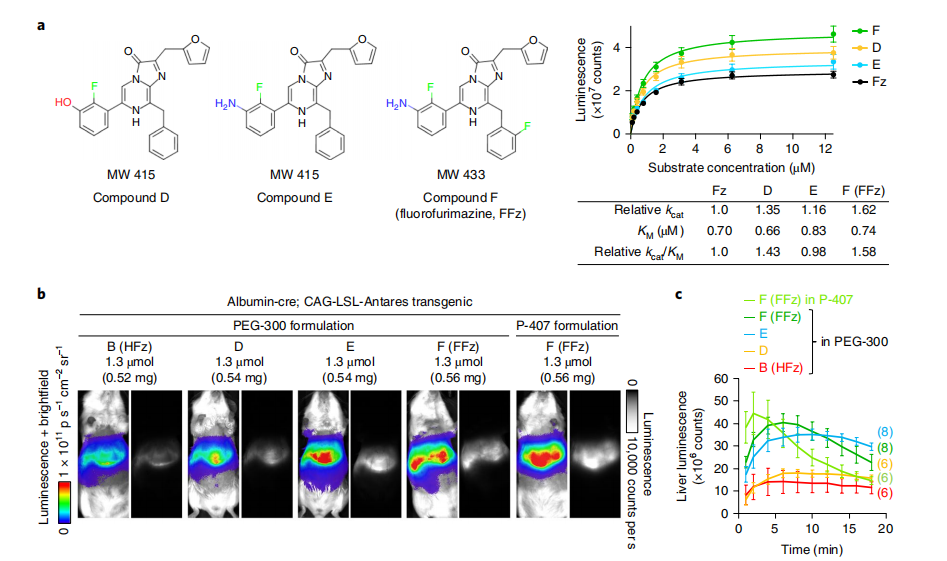
图3:新型氟化furimazine衍生物的体外表征与体内筛选
研究人员对新型氟化furimazine衍生物进行了体外和体内研究。在体外实验中,展示了氟化furimazine衍生物的结构,并测定了Antares与每种底物的相对kcat和绝对KM的酶动力学参数。由于使用相同浓度的纯化Antares与每种底物反应,相对kcat可以通过相对渐近发光(Vmax)值计算得出。中心值表示平均值,误差条表示标准误差,实验重复了3次。在体内筛选中,使用6-8周龄的表达Antares蛋白的小鼠(具有albumin-Cre和CAG-loxP-stop-loxP-Antares基因),注射不同量的氟化furimazine衍生物进行生物发光成像。展示了具有峰值生物发光的代表性结果,实验条件和数据处理与图1b相同,曝光时间为1秒,像素合并为1,光圈为8。最后,记录了每种注射底物的平均生物发光强度随时间的变化,并以标准误差表示,实验小鼠的数量在括号中注明。
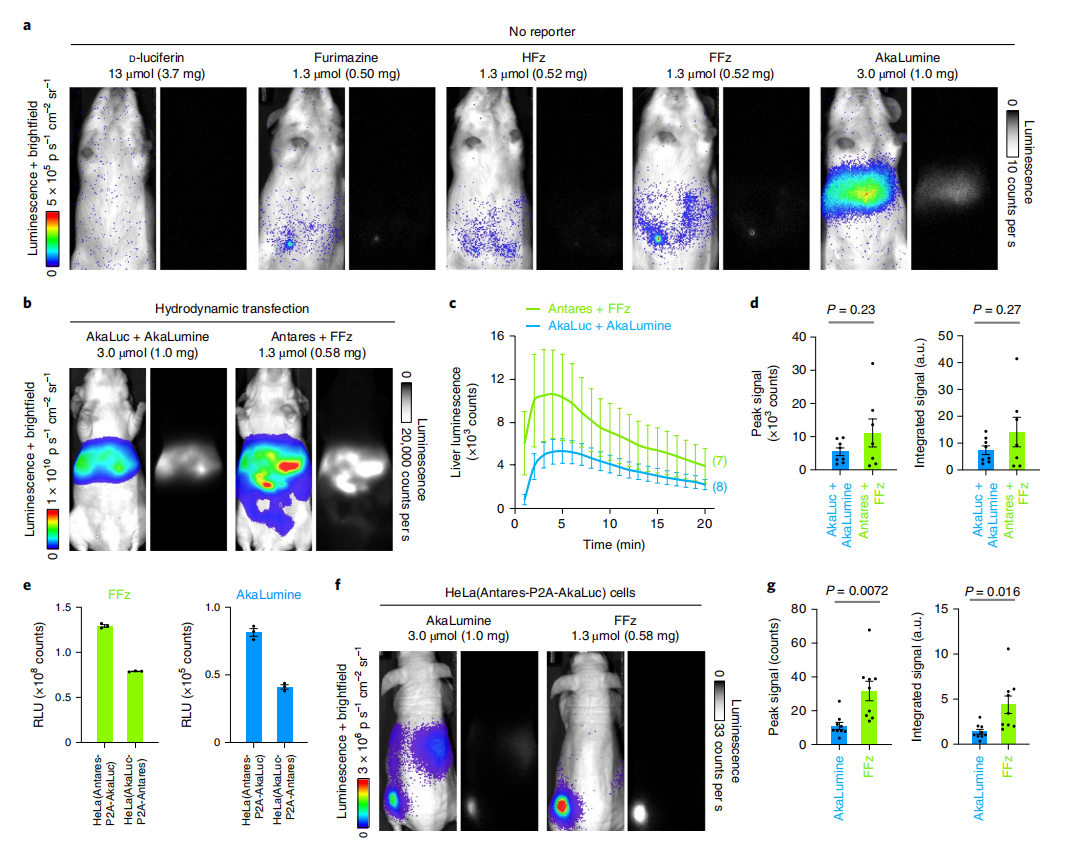
图4:FFz的体内表征与应用
研究人员对FFz进行了详细的体内表征和应用研究。首先,在未剃毛的白色皮毛小鼠中,测量了新底物、d-荧光素和AkaLumine的背景发光,实验独立重复两次,结果相似。接着,在J:NU裸鼠中通过水动力转染法导入编码Antares或AkaLuc的质粒,并腹腔注射相应荧光素酶的最大量。每种类型的图像以相同的强度标度显示,并代表最大亮度时间点,曝光时间为1秒,像素合并为1,光圈为1.2。然后,记录了每种注射底物的平均生物发光强度随时间的变化,并以标准误差表示,实验小鼠的数量在括号中注明。此外,计算了每个系统的平均峰值信号强度和从0到20分钟的总积分信号。在体外实验中,测定了转基因HeLa细胞系中荧光素酶的表达。最后,在J:NU裸鼠中皮下植入稳定表达Antares和AkaLuc荧光素酶的HeLa细胞,进行生物发光成像,曝光时间为60秒,像素合并为2,光圈为1.2。
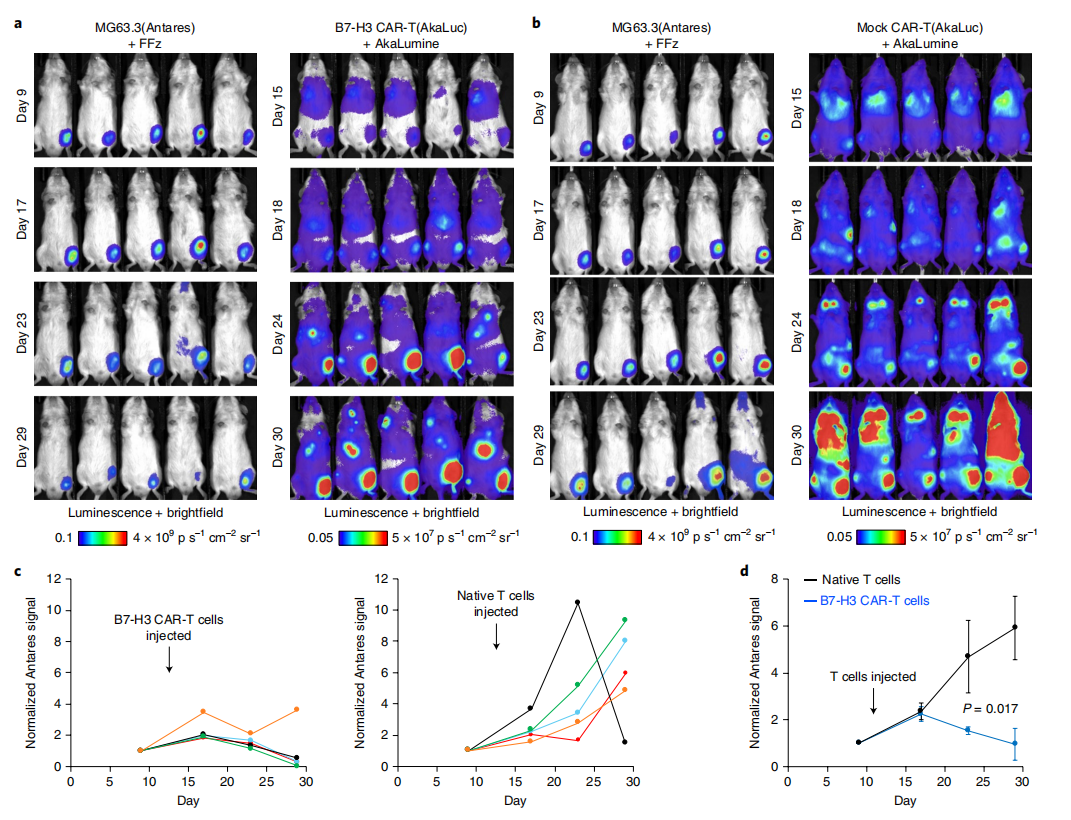
图5:肿瘤异种移植和CAR-T细胞的双色生物发光成像
研究人员在NSG小鼠中进行了肿瘤异种移植和CAR-T细胞的双色生物发光成像实验。首先,在小鼠的一条腿中植入表达Antares的MG63.3肿瘤细胞(第0天),然后在第14天通过尾静脉注射表达AkaLuc的B7-H3 CAR-T细胞(图a)或原生T细胞(图b)。在指定的天数,腹腔注射最大量的相应荧光素酶底物。接着,对每只小鼠的信号强度进行归一化处理(图c)。最后,记录了肿瘤的平均信号强度随时间的变化,并将其归一化到肿瘤细胞注射后的第9天(首次测量时间点),实验小鼠数量为5只,误差条表示标准误差,P值通过双尾Welch不配对t检验得出。
研究人员合成了一系列极性取代的furimazine衍生物,其中化合物B(HFz)溶解度最高,作为Antares底物时表现出优异的酶促动力学参数和稳定性。在小鼠模型中,HFz的亮度显著高于furimazine。进一步开发的氟化底物FFz在体内外均表现出更高的亮度和溶解度,且生物发光半衰期短于HFz。在免疫治疗模型中,Antares与FFz和AkaLuc与AkaLumine可用于双色成像,揭示T细胞与肿瘤反应的关系。此外,Antares和AkaLuc用于监测肿瘤生长和免疫细胞动态,其中Antares在FFz作用下信号更强,且在CAR-T细胞治疗中,Antares信号的变化表明肿瘤消退由CAR介导。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:Pirin抑制FAS介导的细胞凋亡以支持结直肠癌生存