常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-02-15 09:08:58 细胞资源库平台 访问量:343
英文标题:Pirin Inhibits FAS‐Mediated Apoptosis to Support Colorectal Cancer Survival
中文标题:Pirin抑制FAS介导的细胞凋亡以支持结直肠癌生存
发表期刊:《Advanced Science》
影响因子:15.1
作者单位:厦门大学生命科学学院细胞应激生物学国家重点实验室
作者信息:Huanhuan Ma, Muhammad Suleman, Fengqiong Zhang, Tingyan Cao, Shixiong Wen, Dachao Sun, Lili Chen, Bin Jiang, Yue Wang, Furong Lin, Jinyang Wang, Boan Li, Qinxi Li.
PIR是一个杯状超家族蛋白,在人体大多数组织中广泛表达,主要定位于细胞核和细胞质。
近年研究发现,PIR与结直肠癌、乳腺癌和黑色素瘤等多种癌症相关,可能促进癌症生长和转移。
PIR是核因子NF𝜅B1的共调节因子,可以增强其DNA结合能力和转录活性。PIR还是NRF2的靶标,在结直肠癌中过表达,但具体功能尚不清楚。
PIR可以抑制FAS表达,使癌细胞逃避FAS介导的凋亡,从而增强癌细胞生存能力。
结直肠癌是一种起源于结肠或直肠的恶性肿瘤。本文旨在研究PIR在结直肠癌发生中的具体生物学功能和分子机制。
通过敲低PIR,研究发现PIR可以抑制FAS表达,并发现NF𝜅B2而非NF𝜅B1参与其中,提出了PIR-NIK-NF𝜅B2-FAS调控轴。
通过该调控轴,PIR过表达可抑制FAS表达,增强癌细胞对FAS依赖性损伤的抵抗力,尤其是免疫系统的攻击。
因此,PIR可能成为克服结直肠癌免疫治疗抵抗性的治疗靶点。
患者和结直肠癌组织标本的获取:32对结直肠癌组织和相邻正常组织标本。另外,从厦门大学附属第一医院获取4对结直肠癌组织和相邻正常组织标本,用于免疫组化分析。
细胞系:使用实验室保存的HEK293T、HCT116、HT29、MEF、HFF和SW620细胞系。
抗体和试剂:列出了一些关键抗体和试剂的来源和标识。
动物实验:使用裸鼠和C57BL/6小鼠进行肿瘤移植和药物处理实验。所有动物实验都经过厦门大学动物护理和使用委员会批准。
质粒构建:扩增人类PIR、NF𝜅B2、FAS和RELB的cDNA,通过PCR方法构建表达质粒。
质粒转染和病毒感染:使用脂质体转染法将质粒转染到HEK293T细胞中。利用慢病毒感染法将shRNA质粒感染到HCT116细胞中。
免疫沉淀和西方印迹分析:使用细胞裂解液裂解细胞,进行免疫沉淀和西方印迹分析。
免疫荧光染色:将细胞培养在载玻片上,固定、透化、封闭后,进行免疫荧光染色。
反转录定量PCR:提取细胞RNA,通过反转录合成cDNA,然后进行定量PCR分析。
流式细胞术:使用流式细胞术分析细胞凋亡、细胞周期等。
染色质免疫沉淀:进行染色质免疫沉淀实验,分析蛋白质与DNA的结合。
RNA测序:对HCT116细胞进行RNA测序,分析基因表达变化。
统计分析:使用Graphpad Prism 8软件进行统计分析。
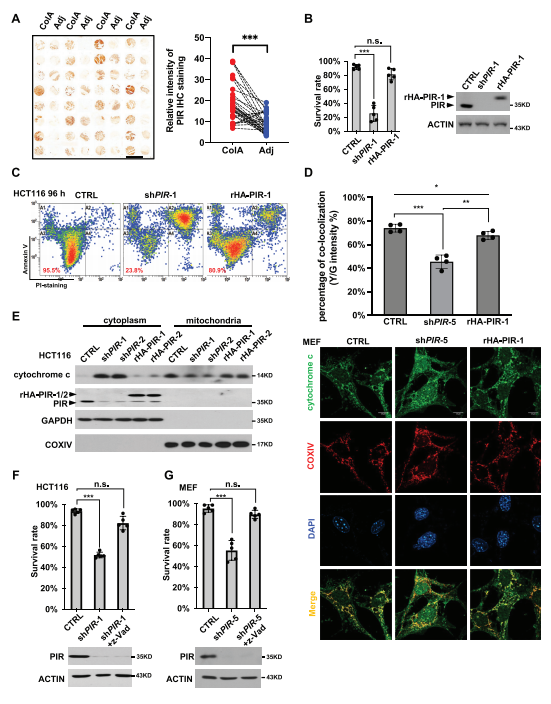
图1:PIR缺失引发凋亡
A) 使用PIR抗体对连续的结直肠癌组织微阵列进行免疫组化染色(左图),并分析PIR蛋白表达强度(右图)。ColA:结直肠癌组织;Adj:肿瘤相邻的正常结肠组织。标尺代表3毫米。数据通过配对Student’s t检验进行分析(***p < 0.001, n = 32)。B和C) HCT116细胞感染表达shPIR-1的慢病毒以敲低内源性PIR,并通过表达HA标签的PIR-1(rHA-PIR-1)来拯救PIR表达,其shPIR-1靶序列包含同义突变,对shPIR-1具有抗性。感染96小时后,通过FITC/PI染色基于流式细胞术确定存活率(C图)。PIR蛋白通过西方印迹(WB)检测(B图右)。数据呈现为五次独立实验的平均值±标准差,并通过非配对Student’s t检验进行分析(B图左,***p < 0.001, n.s.:无显著差异)。CTRL:对照组。D) MEF细胞按B图中的方法处理,随后进行免疫染色以显示色素c和COXIV定位(下板)。统计结果(上板)呈现为四次独立实验的平均值±标准差(非配对Student’s t检验,*p < 0.05, **p < 0.01, ***p < 0.001)。细胞核用DAPI染色。标尺代表10微米。Y/G指的是黄色/绿色。E) HCT116细胞在PIR KD或拯救表达后分离为细胞质和线粒体部分,随后检测细胞色素c、GAPDH(作为细胞质对照)和COXIV(作为线粒体对照)。F和G) HCT116细胞(F)和MEF细胞(G)感染表达shPIR-1或shPIR-5的慢病毒,随后用泛胱天蛋白酶抑制剂Z-VAD-FMK处理。感染后72小时,细胞用PI染色并通过流式细胞仪计数存活率(上板)。PIR KD效率通过WB确定(下板)。结果呈现为五次独立实验的平均值±标准差(非配对Student’s t检验,***p < 0.001, n.s.:无显著差异)。
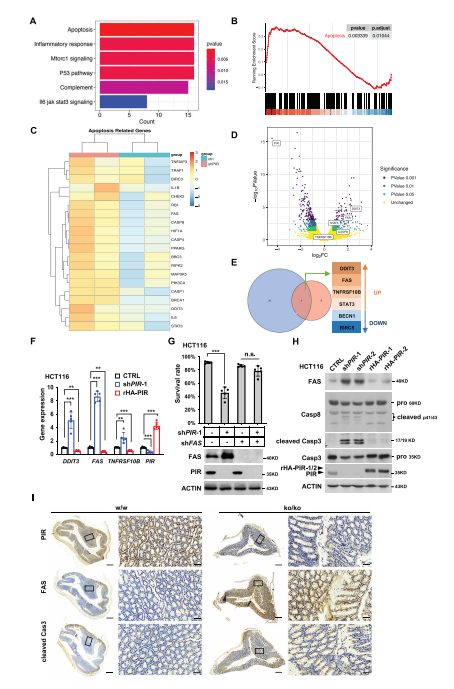
图2:PIR缺失引发的凋亡是通过上调FAS转录活性介导的
A) 使用MSigDB的标准集合对本研究中PIR敲低HCT116细胞的RNA-Seq数据中的分化基因进行富集分析(|log2FC| ≥ 1, p-value < 0.05)的条形图。B) 使用GSEA富集分析本研究中HCT116细胞的RNA-Seq数据,寻找凋亡通路的特征签名。P值通过GSEA的单尾排列检验确定。C) 本研究中RNA-Seq数据生成的前几个上调的凋亡基因的表达热图。D) PIR敲低组与对照组相比的转录组差异表达基因(DEGs)的火山图。横轴代表不同组间基因表达的log2FoldChange (log2FC)。纵轴代表表达差异的显著性水平。DEGs使用limma voom R包计算。E) 显示本研究中PIR敲低RNA-Seq数据与公开的PIR敲低表达数据集(GSE17551和GSE16798)共享的大部分改变的凋亡基因的维恩图。F) HCT116细胞进行PIR敲低并进一步拯救PIR表达。PIR敲低48小时后,提取总RNA,随后通过RT-qPCR测定指示基因的表达。数据以平均值±标准误差(n = 5, 非配对Student’s t检验,*p < 0.05, **p < 0.01, ***p < 0.001)表示。G) HCT116细胞单独或联合敲低PIR-1和FAS。敲低72小时后,细胞用PI染色,并通过流式细胞术进行存活分析。数据代表五次独立实验的平均值±标准差(非配对Student’s t检验,***p < 0.001, n.s.:无显著差异)。H) 对HCT116细胞进行WB分析,以确定FAS、PIR、casp8全长和casp3的蛋白水平,以及PIR敲低或拯救表达后的casp8和casp3的裂解片段。Casp指的是胱天蛋白酶。I) PIR KO小鼠结肠中PIR、FAS和裂解Casp3的IHC染色代表性图像。低倍镜(1×,左面板)的标尺为500微米,高倍镜(10×,右面板)的标尺为50微米。
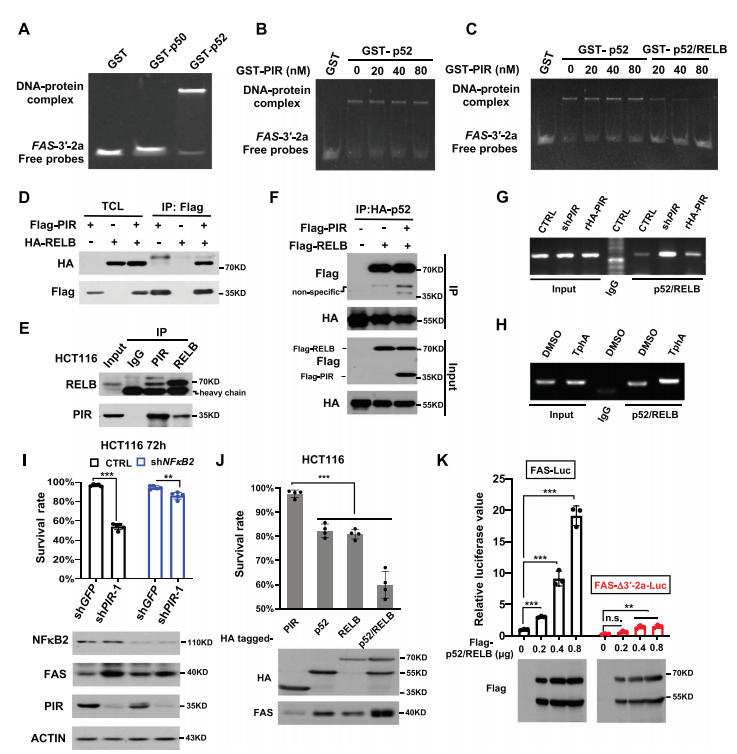
图3:NFB2对于FAS的转录激活是必需的
A) 进行凝胶迁移实验,观察GST、GST-p50或GST-p52对覆盖FAS启动子3′-2a区域的DNA探针的迁移率的影响。探针和蛋白质的浓度均为20纳米。B) 使用探针3′-2a、GST-p52蛋白和递增剂量的GST-PIR蛋白进行凝胶迁移实验。探针的最终浓度为20纳米。C) 使用探针3′-2a和指示蛋白进行凝胶迁移实验。探针的最终浓度为20纳米。D) 在HEK293T细胞中瞬时表达Flag标签的PIR和HA标签的RELB。使用抗Flag琼脂糖(Flag IP)进行共免疫沉淀实验,随后在免疫沉淀物中检测Flag-PIR和HA-RELB。E) 使用内源性蛋白质进行共免疫沉淀实验,以确定PIR与RELB在HCT116细胞中的相互作用。F) 在HEK293T细胞中瞬时表达Flag-PIR、Flag-RELB和HA-p52。进行共免疫沉淀实验,以确定PIR是否干扰RELB和p52的相互作用。G) 在HCT116细胞中瞬时表达Flag-RELB和Flag-p52,随后用shPIR敲低PIR并进一步用rHA-PIR拯救PIR。然后进行染色质免疫沉淀(ChIP)实验,使用抗Flag抗体确定p52/RELB与FAS启动子的结合。H) 在HCT116细胞中瞬时表达Flag-RELB和Flag-p52,随后用DMSO或TphA (50微米,12小时)处理。然后按照G中的方法进行ChIP实验。I) 首先在HCT116细胞中分别表达shGFP(作为对照)和shNF𝜅B2,以创建NF𝜅B1敲低的细胞系。24小时后,每组细胞进一步表达shGFP或shPIR-1。再培养72小时后,通过流式细胞术评估细胞的存活率(上板)和通过西方印迹检测指示蛋白的表达水平(下板)。数据代表平均值±标准差(n = 5,非配对Student’s t检验,**p < 0.01, ***p < 0.001)。J) 在HCT116细胞中转染指示的质粒。转染72小时后,评估细胞的存活率(上板)和蛋白质的表达水平(下板)。数据代表平均值±标准差(n = 4,非配对Student’s t检验,***p < 0.001)。K) 在HEK293T细胞中共转染携带FAS全长启动子的荧光素酶报告质粒(FAS-Luc)或其3′-2a缺失突变体(FAS-3′-2a-Luc),以及不同剂量的Flag-p52/RELB复合物。转染24小时后,测定荧光素酶活性并归一化到第一列(上板)。通过西方印迹检测蛋白质水平(下板)。数据以平均值±标准差表示(n = 3,非配对Student’s t检验,**p < 0.01, ***p < 0.001, n.s.:无显著差异)。
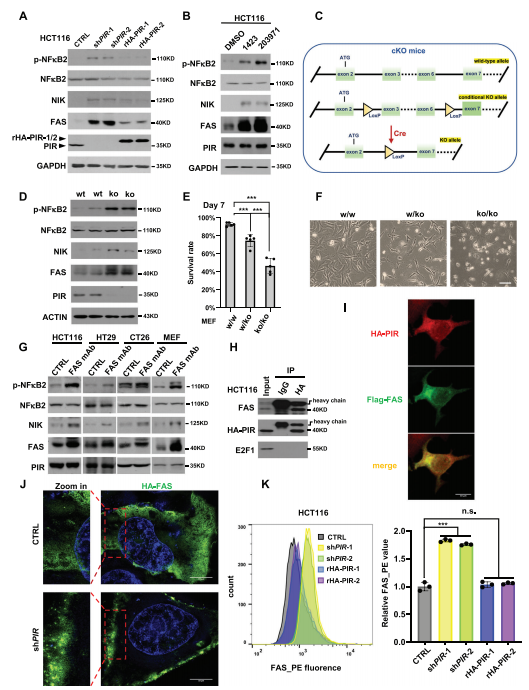
图4:PIR抑制FAS膜转位和NF𝜅B2激活
A) HCT116细胞在预先拯救表达HA-PIR与否的情况下敲低PIR。48小时后,检测指示蛋白的表达。B) HCT116细胞分别用10微米的PIR抑制剂CCG-1423和CCG-203971处理12小时,然后检测指示蛋白。C) 建立条件性PIR敲除(cKO)小鼠的策略的简化描述。D) 通过在来自PIR cKO小鼠的原代MEF细胞中表达腺病毒基础的Cre重组酶创建PIR KO MEFs,并检测指示蛋白。E) 在Cre-Ad处理后第七天,通过流式细胞术检测生成的PIR KO MEFs的存活率。F) 显示与E中相同的PIR KO MEFs的形态。G) HCT116、HT29、CT26和MEF细胞在有无抗FAS-mAb(HCT116和HT29细胞为2.5微克/毫升,CT26和MEF细胞为10微克/毫升)处理24小时后,检测指示蛋白。H) 在HCT116细胞中瞬时表达HA-PIR,并使用抗HA进行共免疫沉淀,以确定HA-FAS与内源性PIR的关联。E2F1作为阴性对照。I) 进行免疫荧光染色,以确定Flag-FAS(绿色)和HA-PIR(红色)在MEFs中的共定位。标尺代表50微米。J) 在MEFs中过表达HA-FAS,有无PIR敲低,随后进行FAS的免疫荧光(IF)染色(绿色)。细胞核(蓝色)用DAPI染色。标尺,10微米。K) HCT116细胞在预先拯救表达HA-PIR与否的情况下敲低PIR。48小时后,用抗FAS-PE染色,并通过流式细胞术确定膜分布的FAS。右侧显示相对PE荧光强度的平均值±标准差(n = 3,非配对Student’s t检验,***p < 0.01, n.s.:无显著差异)。
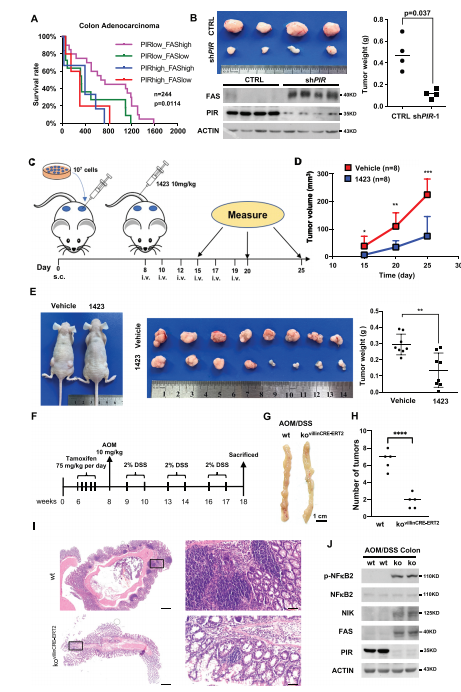
图5:PIR抑制减弱结直肠癌的形成
A) 根据FAS和PIR的平均表达水平,将患者数据分为4组,绘制Kaplan-Meier生存曲线。数据来源于Oncomine数据库。通过Log-rank检验进行统计分析。B) 将野生型(ctrl)和shPIR-1 HCT116细胞(106个细胞)分别皮下注射到裸鼠的左右两侧,观察4周内的移植瘤形成。切除的肿瘤(左上)称重,并通过非配对Student’s t检验进行分析(右,n = 4)。相应肿瘤中的指示蛋白通过西方印迹检测(左下)。C) 显示了使用PIR抑制剂CCG-1423治疗移植瘤的程序示意图。简而言之,8只裸鼠在左右两侧皮下注射107个HCT116细胞。小鼠随机分为两组。一周后,小鼠每周三次静脉注射PBS(对照组)或PIR抑制剂CCG-1423(每次10毫克/千克)。在第15天、第20天和第25天测量肿瘤体积。s.c.:皮下注射;i.v.:静脉注射。D) 显示了(C)中对照组和CCG-1423处理组的肿瘤体积,以平均值±标准差表示,并通过非配对Student’s t检验进行分析(*p < 0.05, **p < 0.01, ***p < 0.001)。E) 显示了分别用溶剂和CCG-1423处理的裸鼠的代表性移植瘤图片(左面板)。切除的肿瘤(中间)称重,并通过Student’s t检验进行分析(右面板,n = 8, **p < 0.01)。F) AOM/DSS诱导的结直肠癌小鼠模型的简化实验。G和H) 显示了野生型和PIR敲除小鼠的代表性结肠图片(G)以及肿瘤数量的计算和分析(H, n = 5, ****p < 0.0001)。I) 结肠组织的代表性病理学图片。低倍镜(1×,左面板)的标尺为500微米,高倍镜(10×,右面板)的标尺为50微米。J) 通过西方印迹检测野生型或PIR敲除结肠组织中的指示蛋白水平。
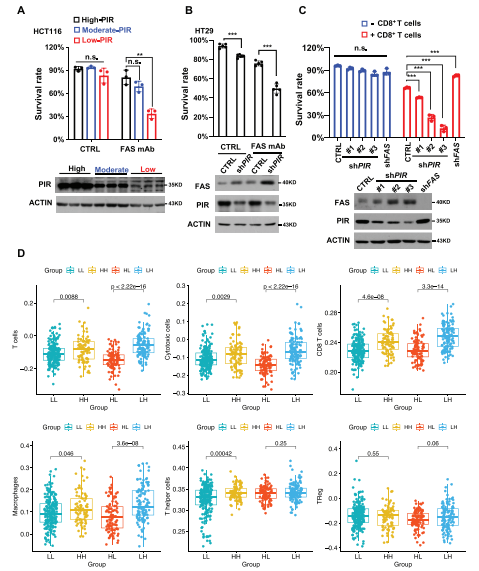
图6:PIR抑制使细胞对FAS为基础的免疫治疗敏感
A) HCT116细胞感染空白载体病毒或不同体积的shPIR-1病毒。感染后24小时,细胞用抗FAS-mAb (2.5 μg mL−1)处理24小时。然后通过PI染色确定存活率。数据代表平均值±标准差(n = 3, **p < 0.01, n.s.:无显著差异,非配对Student’s t检验)。PIR蛋白水平显示在下面板。
B) HT29细胞用空白载体病毒(CTRL)或PIR KD病毒处理。感染后24小时,细胞用抗FAS-mAb (2.5 μg mL−1)处理24小时,随后检测存活率(n = 5, 非配对Student’s t检验,***p < 0.001)。C) 创建了敲低FAS或不同水平PIR的HCT116细胞系,标记为GFP,并与预先活化的成人CD8+ T细胞共孵育20小时。通过流式细胞术确定HCT116细胞的存活率。条形图(上板)代表三次独立实验的平均值±标准差(非配对Student’s t检验,***p < 0.001, n.s.:无显著性)。PIR和FAS蛋白通过西方印迹检测(下板)。D) 结直肠癌中不同PIR和FAS表达状态的肿瘤中各种免疫细胞浸润水平的箱形图。P值通过Student’s t检验分析。数据来源于TCGA数据库。HH:PIR高表达和FAS高表达;HL:PIR高表达和FAS低表达;LH:PIR低表达和FAS高表达;LL:PIR低表达和FAS低表达。
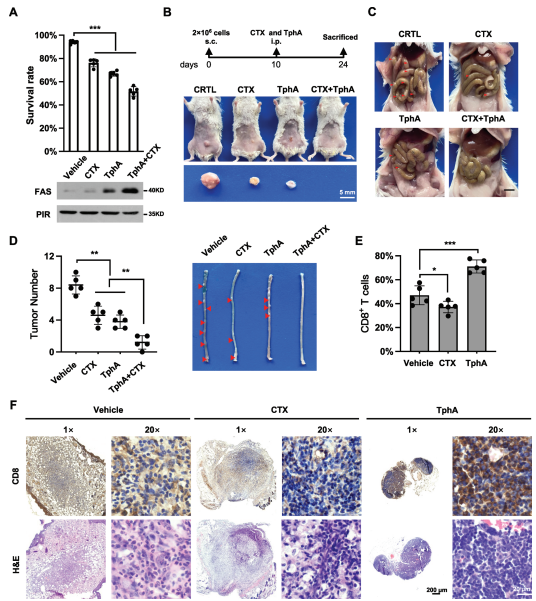
图7:PIR通过关闭NF-𝜅B2-FAS轴抑制FAS依赖性凋亡
A) CT26细胞单独或联合使用西妥昔单抗(CTX,10微克/毫升)和TphA (50微克/毫升)处理24小时,随后检测存活率(上板,n = 5,非配对Student’s t检验,***p < 0.001)和FAS蛋白水平(下板)。
B和C) 根据B图上板的程序,使用小鼠CT26细胞进行同种异体移植瘤实验。小鼠在第24天被牺牲。展示了单独或联合使用CTX和TphA处理的鼠标在 situ肿瘤(B)和转移性肠道肿瘤(C)的代表性图片。s.c.:皮下注射;i.p.:腹腔注射。标尺代表5毫米。D) 显示了(B)和(C)中相同小鼠的结肠肿瘤数量(左板)和肿瘤负荷的结肠(右板)(n = 5,非配对Student’s t检验,**p < 0.01)。E和F) 对CD8+ T细胞的百分比进行定量分析(E,n = 5,非配对Student’s t检验,*p < 0.05, ***p < 0.001)。使用CD8+ T细胞特异性抗体进行免疫组化染色,以确定在 situ肿瘤中的CD8+ T细胞浸润(F)。标尺分别代表200微米和20微米。
FASL和FAS长期被认为是扮演着在免疫清除癌细胞中重要角色的死亡系统。
IL-2激活的CD8+ T淋巴细胞通过启动FASL/FAS凋亡途径,作为消除癌细胞的主要执行者。
癌细胞内源性的FAS蛋白表达及其随后向细胞膜的转位,是CD8+ T淋巴细胞执行FASL触发的凋亡的决定因素。
本研究揭示了PIR蛋白在保护癌细胞免受CD8+杀伤T细胞执行凋亡方面的 ● previously undefined role(先前未定义的作用)。
PIR通过破坏FAS转录活性和阻断FAS膜转位(图S7A,支持信息),在多个方面抑制FAS依赖性凋亡。
研究的关键点在于内源性FAS蛋白表达及其向细胞膜的转位对CD8+ T淋巴细胞介导的凋亡的重要性。
PIR蛋白通过两种方式抑制NF𝜅B2介导的FAS转录活性。
PIR促进NIK的蛋白酶体降解,NIK是NF𝜅B2的上游激酶,整合TNF受体家族成员的信号并激活NF𝜅B2成熟(从幼稚的p100到成熟的p52)和核转位。
PIR与RELB相互作用,破坏NF𝜅B2复合物(p52-RELB)与FAS启动子的结合,从而阻断NF𝜅B2对FAS的转录活性。
PIR通过与FAS相互作用并将其保留在细胞质中,阻止其膜转位,进一步抑制FAS表达。
FAS mAb触发的FAS激活也能诱导NIK和FAS表达,建立FAS激活和NIK介导的● NF𝜅B2介导的FAS表达之间的正反馈循环。
PIR的过量表达可能破坏这种FAS信号的自动放大。
本研究建立了PIR-NIK-NF𝜅B2-FAS生存信号传导途径,并表明PIR是抑制FAS依赖性凋亡、促进CRC恶性的重要生存因子。
PIR在CRC中抑制FAS表达,并通过多种机制促进CRC恶性。
目前尚不清楚这些机制是否特限于CRC或CRC特异性。
研究还提供了令人信服的证据,证明PIR可能是CRC治疗的新兴靶点。
PIR敲低或抑制剂处理导致的内源性FAS上调可以显著触发凋亡,即使没有上游启动子的刺激。
PIR抑制剂可以显著减缓HCT116细胞的小鼠移植瘤生长。
PIR表达与NIK和FAS表达以及生存率呈负相关,这支持了PIR作为CRC治疗靶点的建议。
PIR抑制可能是一种有希望的CRC治疗策略,特别是对于PIR水平高、FAS水平低的CRC。
PIR抑制剂与免疫检查点阻断联合使用可能是一种治疗CRC的潜在策略,特别是对于那些对免疫治疗耐药的CRC。
开发更有效的PIR抑制剂是未来的紧迫任务。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:Chemerin肽类似物促进两种人类结直肠癌异种移植模型中的肿瘤生长
下一篇:新型NanoLuc底物实现动物体内明亮的双群体生物发光成像