常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-02-14 08:51:30 细胞资源库平台 访问量:267
同源异体小鼠肿瘤模型是免疫肿瘤学(I/O)研究中不可或缺的临床前模型,但它们对免疫检查点抑制剂(ICIs)的反应有限,这可能是由于它们的固有低免疫原性。为了解决这一问题,研究人员通过将鸡卵清蛋白(OVA)这一高度免疫原性的蛋白质表达到同源异体肿瘤细胞中,开发了新的免疫原性同源异体模型。这些模型,如DC2.4-OVA和B16-OVA,显示出比它们的亲本细胞系更慢的肿瘤生长速度,这可能是由于免疫介导的排斥反应。更重要的是,这些OVA表达的模型对ICIs,特别是抗PD-1治疗,表现出更高的敏感性,这表明它们在增强T细胞介导的免疫反应方面具有潜力。此外,通过过继T细胞转移实验,研究人员验证了这些模型中存在肿瘤特异性记忆T细胞。这些结果表明,OVA工具细胞不仅增强了对ICIs的反应,而且为临床前免疫治疗评估提供了新的、具有更高免疫原性的同源异体模型,这对于I/O研究具有重要的意义。
英文标题:Targeting CD73 Enhances the Antitumor Activity of Anti-PD-1 and Anti-CTLA-4 mAbs.
中文标题:靶向CD73增强抗PD-1和抗CTLA-4单克隆抗体的抗肿瘤活性
发表期刊:《Clin Cancer Res》
影响因子:11.4
作者单位:
1.Centre de Recherche du Centre Hospitalier de l'Universite de Montréal, Faculté de Pharmacie et Institut du Cancer de Montréal, Montréal, Québec, Canada
2.Cancer Immunology Program, Trescowthick Laboratories, Peter MacCallum Cancer Centre, St. Andrews Place, East Melbourne
3.Sir Peter MacCallum Department of Oncology, University of Melbourne, Parkville, Victoria
4.Immunology in Cancer and Infection Laboratory, Queensland Institute of Medical Research
5.School of Medicine, University of Queensland, Herston, Queensland, Australia
作者信息:Bertrand Allard, Sandra Pommey, Mark J. Smyth, John Stagg.
阻断程序性死亡(PD)-1或细胞毒性T淋巴细胞抗原(CTLA-4)受体的单克隆抗体(mAb)与多种癌症类型的持久临床反应相关,并作为新型癌症治疗药物展现出巨大潜力。近期证据表明,针对多个免疫抑制途径的靶向阻断可诱导协同抗肿瘤反应。
实验方法:本研究使用MC38-OVA、RM-1和4T1.2肿瘤细胞系,以及野生型C57Bl/6、BALB/c、IFN-γ缺陷和穿孔素缺陷C57Bl/6小鼠进行实验。实验中使用了多种抗体和化学品,包括抗CD73、抗PD-1、抗CTLA-4单克隆抗体等。MC38-OVA和RM-1肿瘤细胞皮下注射到C57Bl/6小鼠中,小鼠接受抗CD73、抗PD-1、抗CTLA-4单克隆抗体或对照Ig处理。为了评估T细胞的作用,小鼠还接受抗CD4和抗CD8b单克隆抗体处理。对于生存实验,4T1.2肿瘤细胞接种到BALB/c小鼠的乳腺脂肪垫中,肿瘤切除后进行处理。通过流式细胞术分析肿瘤浸润淋巴细胞,使用定量实时PCR检测肿瘤组织中的基因表达。此外,还通过3-甲基胆蒽诱导C57Bl/6小鼠产生纤维肉瘤,评估不同抗体处理的效果。
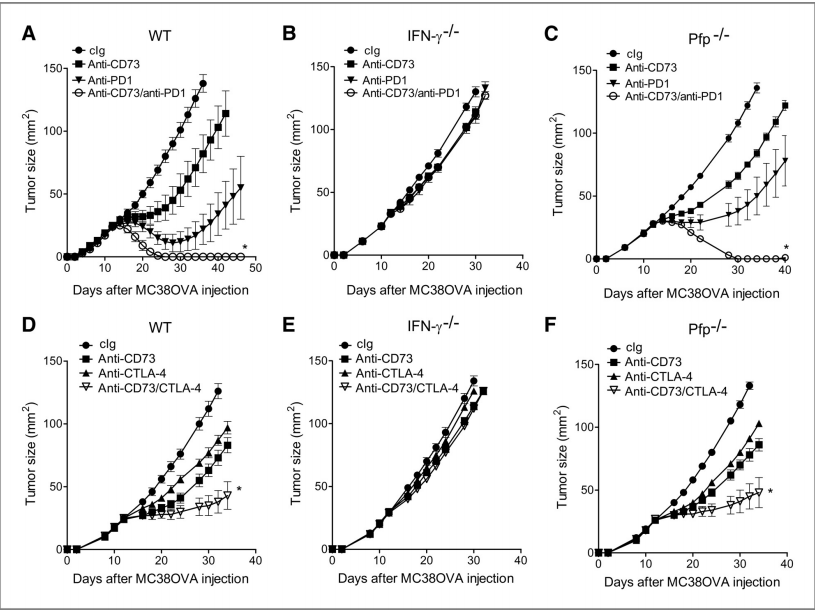
图1:抗CD73单克隆抗体增强抗PD-1和抗CTLA-4单克隆抗体的抗肿瘤活性
野生型(A和D)、IFN-γ缺陷(B和E)或穿孔素缺陷(C和F)C57Bl/6小鼠皮下注射MC38-OVA肿瘤细胞(10^6个细胞),并在第12天、第16天和第20天接受腹腔注射抗CD73单克隆抗体(100 mg,克隆TY/23)、抗PD-1单克隆抗体(100 mg,克隆RMP1-14)、抗CTLA-4单克隆抗体(100 mg,克隆UC10-4F10)、抗CD73/抗PD-1单克隆抗体(各100 mg,腹腔注射;A-C)或抗CD73/抗CTLA-4单克隆抗体(各100 mg,腹腔注射;D-F),或对照Ig(200 mg,腹腔注射)。每组5只小鼠的平均值±标准误(SE)如图所示(*P < 0.05,Mann–Whitney检验,联合治疗与单一药物治疗之间)。图中显示的是2次实验中的一个代表性结果。
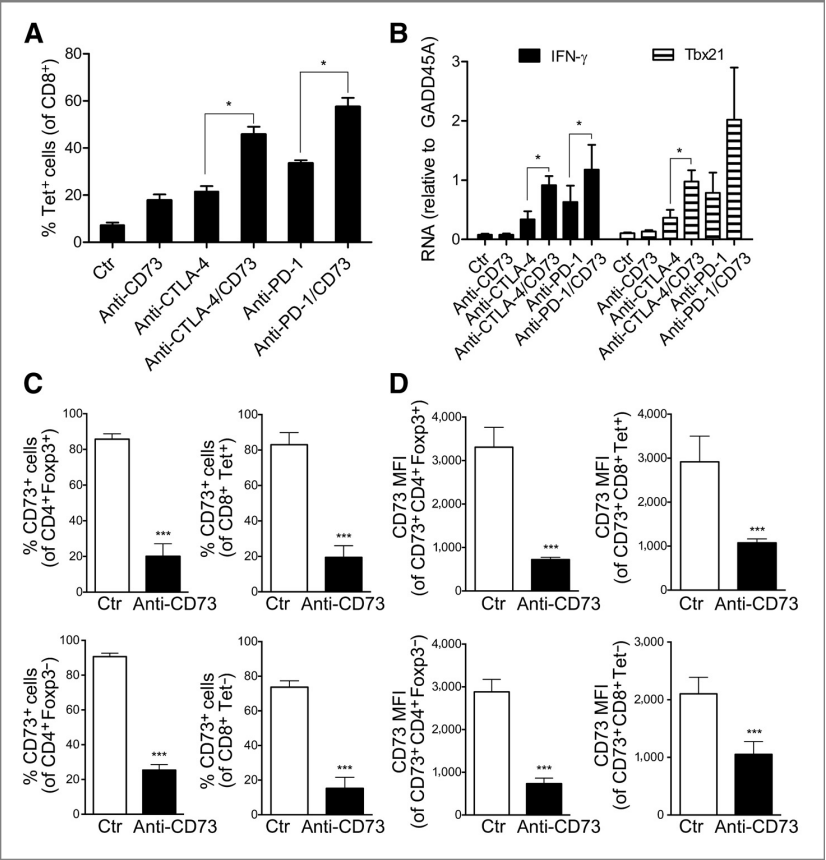
图2:抗CD73单克隆抗体增强抗PD-1和抗CTLA-4单克隆抗体诱导的Th1反应
A部分,野生型C57Bl/6小鼠皮下注射MC38-OVA肿瘤细胞(106个细胞),并在第12天和第15天接受腹腔注射抗CD73单克隆抗体(100 mg,克隆TY/23)、抗PD-1单克隆抗体(100 mg,克隆RMP1-14)、抗CTLA-4单克隆抗体(100 mg,克隆9H10)、抗CD73/抗PD-1单克隆抗体(各100 mg)或抗CD73/抗CTLA-4单克隆抗体(各100 mg),或对照Ig(200 mg)。第18天,通过流式细胞术分析肿瘤单细胞悬液的CD8表达和四聚体反应性(Tet)。每组5只小鼠的平均值±标准误(SE)如图所示(*P < 0.05,Mann–Whitney检验)。
B部分,通过实时PCR分析治疗后肿瘤中IFN-γ和T-bet(Tbx21)mRNA的表达。每组4只小鼠的平均值±标准误(SE)如图所示(*P < 0.05,Mann–Whitney检验)。C和D部分,分别显示了经腹腔注射抗CD73单克隆抗体或对照Ig处理的MC38-OVA荷瘤小鼠中TIL(肿瘤浸润淋巴细胞)群体中CD73表达的百分比(C)和平均荧光强度(MFI;D)。使用不同的抗CD73单克隆抗体进行阻断(克隆TY/23)和流式细胞术(TY/11.8)。每组5只小鼠的平均值±标准误(SE)如图所示(***P < 0.001,Mann–Whitney检验)。
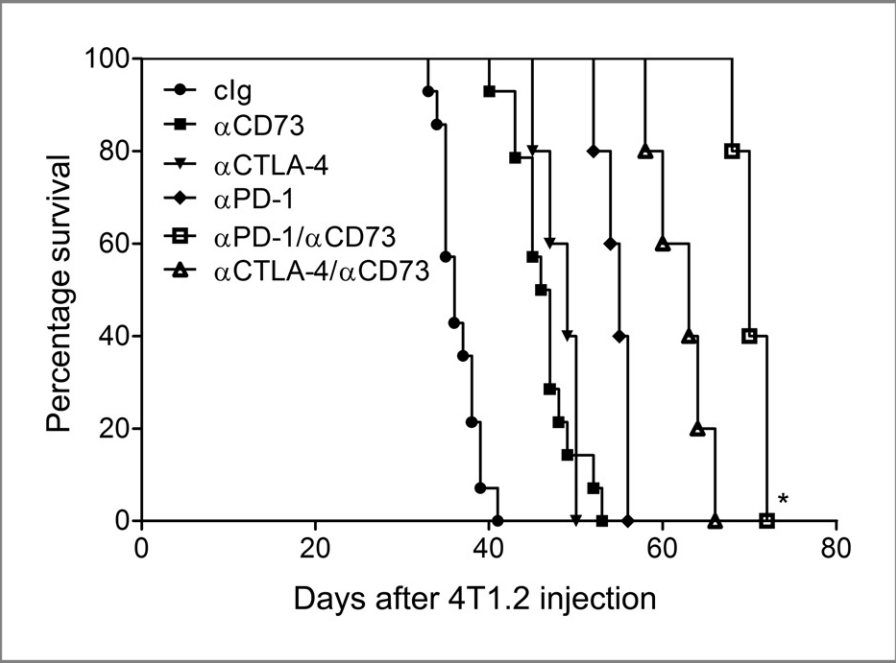
图3:抗CD73单克隆抗体联合抗PD-1或抗CTLA-4单克隆抗体治疗已建立的转移性乳腺癌的疗效
将5万4T1.2肿瘤细胞接种到野生型BALB/c小鼠的乳腺脂肪垫中,第25天切除原发肿瘤,第28、32、36和40天用100 mg抗CD73单克隆抗体(TY/23)、抗PD-1单克隆抗体(RMP1-14)和/或抗CTLA-4单克隆抗体(UC10-4F10)进行治疗。通过log-rank(Mantel–Cox)检验评估各组间生存差异的显著性(P < 0.0001)。
具体比较结果如下:
a. 抗CD73与抗PD-1/抗CD73或抗CD73/抗CTLA-4比较:log-rank检验P = 0.0002,Gehan–Breslow–Wilcoxon(GBW)检验P = 0.002。
b. 抗CTLA-4与抗CD73/抗CTLA-4比较:log-rank检验P = 0.0027,GBW检验P = 0.0043。
c. 抗PD-1与抗PD-1/抗CD73比较:log-rank检验P = 0.0027,GBW检验P = 0.0043。
d. 抗PD-1/抗CD73与抗CD73/抗CTLA-4比较:log-rank检验P = 0.0018,GBW检验P = 0.0039。
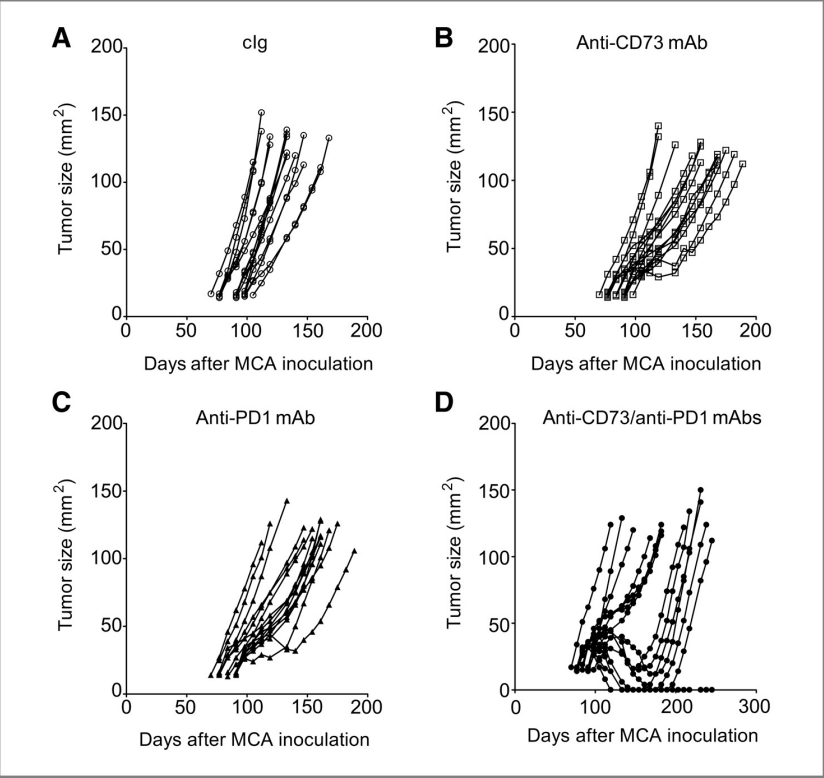
图4:联合抗CD73/抗PD-1单克隆抗体治疗抑制致癌物诱导的肿瘤发生
C57Bl/6小鼠在后肢皮下接种400 mg的3-甲基胆蒽(MCA)。一旦肿瘤形成(0.24–0.39 cm²),小鼠接受以下处理:
(A) 腹腔注射对照Ig(100 mg)
(B) 腹腔注射抗CD73单克隆抗体(100 mg,克隆TY/23)
(C) 腹腔注射抗PD-1单克隆抗体(100 mg,克隆RMP1-14)
(D) 联合抗CD73/抗PD-1单克隆抗体(各100 mg),每周两次,持续6周
在300天内每周监测纤维肉瘤的发展。图中显示了每只小鼠的肿瘤大小。
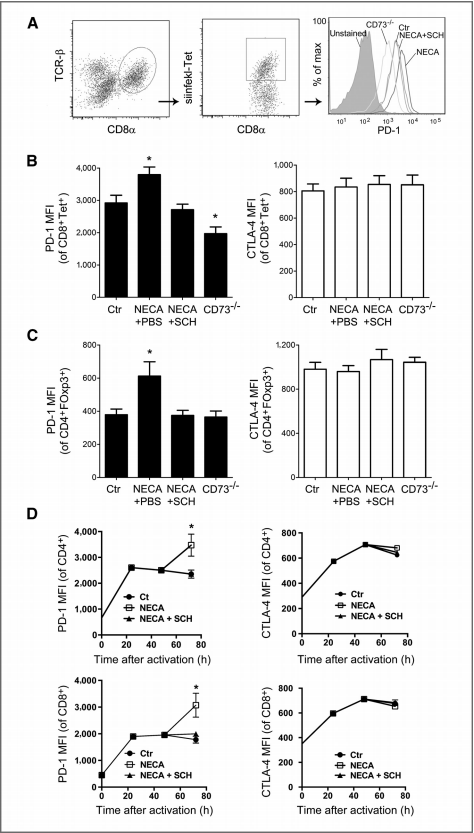
图5:GP-M30在B16F10黑色素瘤模型中诱导了针对B16F10新抗原M30的特异性细胞免疫反应和抗肿瘤活性
野生型或CD73缺陷C57Bl/6小鼠皮下注射MC38-OVA肿瘤细胞(106个细胞),并在第12天和第15天接受泛腺苷受体激动剂NECA(0.05 mg/kg 腹腔注射+0.05 mg/kg 皮下注射)和/或A2A腺苷受体拮抗剂SCH58261(1 mg/kg)处理。第18天,分析肿瘤细胞悬液。A部分,流式细胞术(FACS)点图显示肿瘤浸润CD8+ T细胞(左)和CD8+ Tet+ T细胞上PD-1表达水平的直方图(右)。B和C部分,分别显示卵清蛋白特异性CD8+ T细胞(B)和CD4+ Foxp3+ T细胞(C)上PD-1(左)和CTLA-4(右)表达的平均荧光强度(MFI)。每组5只小鼠的平均值±标准误(SE)如图所示(*P < 0.05,Mann–Whitney检验)。D部分,C57Bl/6小鼠脾脏T细胞在体外激活,48小时后用NECA+ SCH58261处理。激活后24、48和72小时,通过流式细胞术测量CD4+和CD8+ T细胞上的PD-1和CTLA-4表达水平(MFI)。
本研究通过一系列实验探讨了CD73阻断对抗PD-1和抗CTLA-4单克隆抗体治疗效果的增强作用。在MC38-OVA肿瘤模型中,抗CD73和抗PD-1单克隆抗体的联合治疗显著延迟了肿瘤生长,并在所有处理小鼠中诱导了完全肿瘤排斥。这种抗肿瘤活性依赖于IFN-γ,而与穿孔素无关。类似地,抗CD73单克隆抗体也显著增强了抗CTLA-4单克隆抗体的治疗效果,但未诱导完全肿瘤回归。进一步研究发现,联合治疗增加了肿瘤浸润的抗原特异性CD8+ T细胞,并上调了Th1免疫基因Tbx21和IFN-γ的表达。此外,抗CD73单克隆抗体治疗显著下调了TILs上的CD73表达。在4T1.2乳腺癌模型中,联合抗CD73和抗PD-1或抗CTLA-4单克隆抗体显著延长了小鼠的生存期。在MCA诱导的纤维肉瘤模型中,联合治疗显著延迟了肿瘤进展,并在部分小鼠中诱导了完全或部分肿瘤回归。最后,研究发现A2A腺苷受体的激活上调了TILs上的PD-1表达,而抗CD73单克隆抗体处理未改变TILs上的PD-1或CTLA-4水平,表明CD73阻断与抗PD-1单克隆抗体之间存在非冗余的协同机制。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:CRISPR技术联合单细胞RNA测序在乙肝感染研究中的应用
下一篇:Chemerin肽类似物促进两种人类结直肠癌异种移植模型中的肿瘤生长