常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-02-13 08:32:57 细胞资源库平台 访问量:580
在生物医学研究和药物开发领域,生物发光成像技术因其高信噪比而被广泛应用于细胞测定和动物成像研究。然而,传统的荧光素酶种类有限,限制了同时成像多个分子和细胞事件的能力。为了突破这一限制,科学家们开发了一种新型的ATP非依赖性荧光素酶——NanoLuc(NL),它源自深海虾Oplophorus gracilirostris,并经过工程改造以增强蛋白质稳定性。NanoLuc作为一种小型(19 kDa)、高亮度的荧光素酶,其亮度是传统萤火虫或海肾荧光素酶的100倍,并且使用furimazine作为底物产生明亮的辉光型发光。
NanoLuc的意义在于其为双报告基因生物发光分子成像提供了新的可能。它不仅可以在活体小鼠的表层和深层组织中成像,而且其生物发光随时间的变化可以用来定量肿瘤生长,甚至在少量血清中也能检测到分泌的NL。此外,NanoLuc与萤火虫荧光素酶的结合使用,为在完整细胞和活体小鼠中定量TGF-β信号传导的两个关键步骤提供了一种新型双荧光素酶成像策略,从而在正常生理、疾病和药物开发中扩展了信号转导的成像能力。NanoLuc的作用不仅体现在其高灵敏度和高稳定性上,它还具有更小的尺寸,这使得在标记细胞和蛋白质时对样本的侵入性更小,有助于保持细胞或组织的天然状态。NanoLuc的快速反应、低背景发光和多样灵活等特点,使其在生物学和医学研究中具有广泛的应用前景。因此,NanoLuc作为一种新的报告基因,不仅增强了我们对生物过程的理解和疾病机理的研究,而且在开发潜在治疗方法和疗法方面发挥了重要作用。
英文标题:Illuminating the mechanism and allosteric behavior of NanoLuc luciferase
发表期刊:Nature Communications
中文标题:揭示NanoLuc荧光素酶的机制和变构行为
发表期刊:《Nature Communications》
影响因子:16.6
作者单位:
1.Loschmidt Laboratories, Department of Experimental Biology and RECETOx, Faculty of Science, Masaryk University, Kamenice 5, Bld. 013, 625 00 Brno, Czech Republic.
2.International Clinical Research Center, St. Anne's University Hospital Brno, Pekarska 53, 656 91 Brno, Czech Republic.
3.Department of Histology and Embryology, Faculty of Medicine, Masaryk University, Kamenice 753/5, 625 00 Brno, Czech Republic.
4.Unité de Chimie et Biocatalyse, Institut Pasteur, UMR 3523, CNRS, 28 rue du Dr. Roux, 75724 Paris Cedex 15, Paris, France.
作者信息:Michal Nemergut, Daniel Pluskal, Jana Horackova, Tereza Sustrova, Jan Tulis.
NanoLuc荧光素酶是一种经过工程改造的β-桶折叠荧光素酶,虽然其开发已有10年历史,但其催化机制仍然令人困惑。NanoLuc是基于天然深海虾荧光素酶(OLuc)优化而来,通过蛋白质工程改造,使其具有更高的活性和稳定性。它能够催化新型底物furimazine(FMZ)氧化为furimamide(FMA),产生比传统荧光素酶(如萤火虫荧光素酶和海肾荧光素酶)更强的光信号,广泛应用于生物成像、蛋白相互作用研究和生物发光共振能量转移(BRET)传感器等领域。然而,尽管NanoLuc在技术和商业上取得了巨大成功,其荧光素结合位点和产生蓝光的机制仍未明确。此外,FMZ底物存在溶解性差、细胞毒性以及成本较高等问题,限制了其广泛应用。
本文采用了一系列实验方法来研究NanoLuc荧光素酶的催化机制和变构行为。首先,通过化学合成方法制备了荧光素(CTZ)和其类似物(如FMZ和azaFMZ)。利用大肠杆菌表达系统过表达并纯化了NanoLuc及其突变体,并通过共晶实验解析了NanoLuc与不同荧光素复合物的晶体结构。通过小角X射线散射(SAXS)技术研究了NanoLuc在溶液中的构象变化。此外,利用荧光素酶活性测定法评估了NanoLuc及其突变体的催化活性,并通过稳态动力学实验测定了其动力学参数。为了进一步探索NanoLuc的变构机制,结合分子对接和自适应采样分子动力学模拟(ASMD)技术,研究了荧光素在NanoLuc中的结合和解离过程。这些方法的综合应用揭示了NanoLuc荧光素酶的催化机制及其变构行为的分子基础。
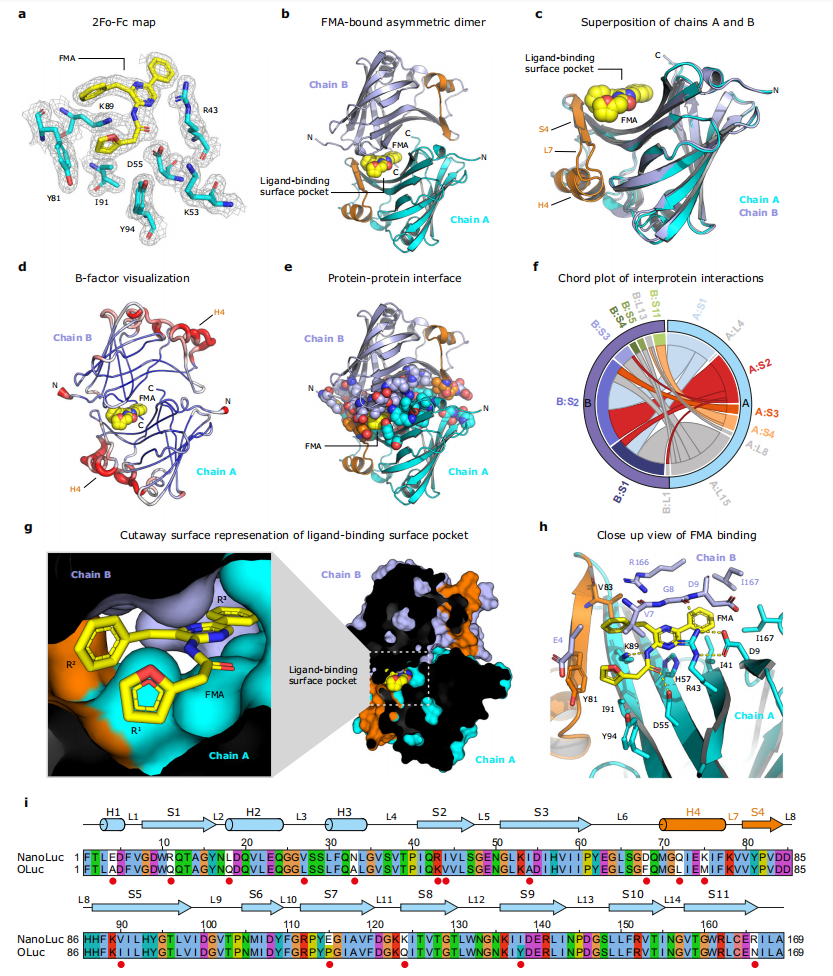
图1:NanoLuc荧光素酶FMA(furimamide)结合位点的结构特征
图a为FMA-oxyluciferin结合位点的2Fo-Fc电子密度图(等值面水平为1.2σ)。图b为NanoLuc非对称二聚体的整体结构,其中链A为青色,链B为蓝色,结合的FMA荧光素为黄色。图c为链A和链B的叠加,显示了导致二聚体界面不对称的结构元素(包括螺旋H4、环L7和链S4,以橙色标记)。图d为NanoLuc同二聚体的B因子表示。图e为二聚体界面的可视化,所有参与二聚体界面的残基以空间填充球表示,FMA以黄色球表示。图f为NanoLuc二聚体中链A和链B在二级结构水平上的相互作用图,由Protein Contact Atlas计算和可视化。图g为FMA结合的NanoLuc二聚体的切面表面表示。图h为FMA结合口袋的特写,活性位点的残基以棍状表示,关键氢键以黄色虚线表示。图i为NanoLuc与O. gracilirostris荧光素酶(OLuc)催化单元的序列比对,NanoLuc中的二级结构元素显示在比对上方,NanoLuc工程改造过程中突变的氨基酸残基以红点标记。
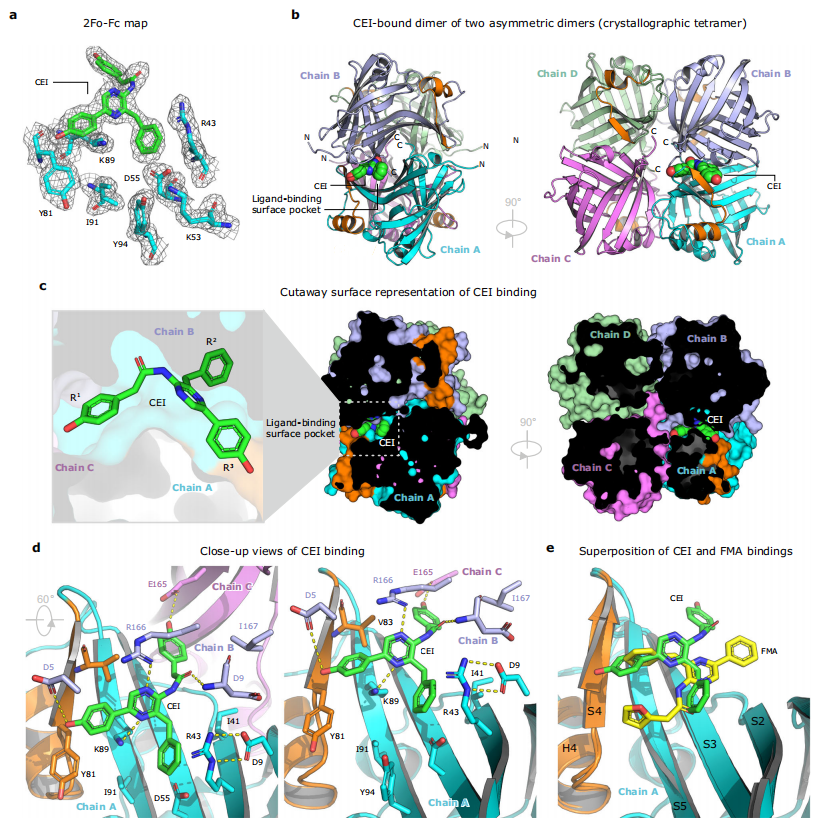
图2:NanoLuc荧光素酶与CEl(coelenteramide)结合的晶体结构
图a为CEl-oxyluciferin结合位点的2Fo-Fc电子密度图(等值面水平为1.2σ)。图b为NanoLuc同四聚体的整体结构,由两个尾对尾的非对称同二聚体组成(链A为青色,链B为蓝色,链C为紫色,链D为绿色),CEl荧光素以空间填充球表示(绿色)。图c为CEl结合的NanoLuc四聚体的切面表面表示。图d为CEl结合口袋的特写,活性位点的残基以棍状表示,关键氢键以黄色虚线表示。图e为FMA(黄色)和CEl(绿色)结合模式的叠加。
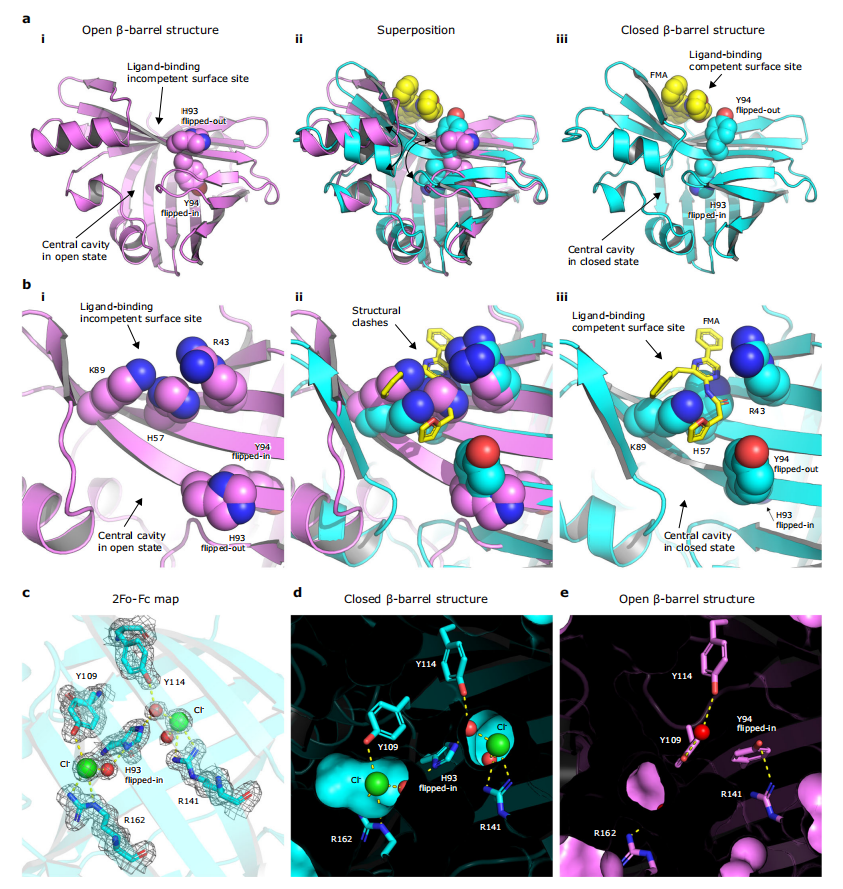
图3:NanoLuc荧光素酶β-桶结构在开放和闭合状态之间的构象转换
图a为卡通表示的(i)无配体的apo-NanoLuc结构(PDB ID: 5BOU)、(iii)FMA结合的NanoLuc结构以及(ii)两者的叠加。H93和Y94残基以及FMA荧光素以空间填充球表示。图b为(i)无配体的apo-NanoLuc结构、(iii)FMA结合的NanoLuc结构以及(ii)两者的叠加的荧光素结合表面口袋的特写。R43、H57、K89、H93和Y94残基以空间填充球表示,FMA荧光素以黄色棍状表示。图c为氯离子结合位点1和2的2Fo-Fc电子密度图(等值面水平为1.2σ)。图d和e分别为NanoLuc β-桶内部在闭合状态(d)和开放状态(e)的切面表面表示,注意在闭合状态的β-桶中,两个氯离子结合在β-桶内部。
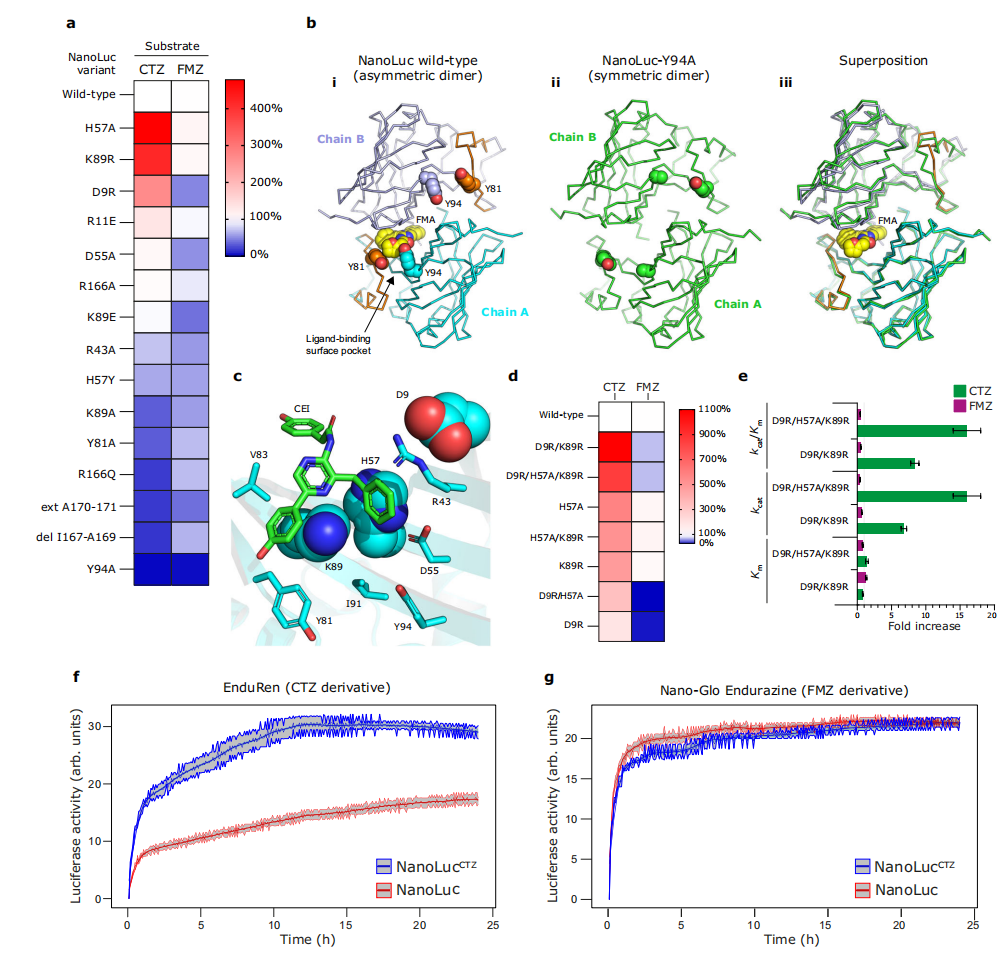
图4:NanoLuc突变体的特性分析图a为NanoLuc突变体与CTZ(左列)和FMZ(右列)荧光素的相对荧光素酶活性热图,以NanoLuc野生型为100%。图b为FMA结合的NanoLuc野生型非对称二聚体结构(i)和无荧光素的NanoLuc-Y94A突变体对称二聚体结构(ii)及其叠加(iii),酪氨酸-酪氨酸门控残基Y81和Y94(A94)以及FMA荧光素以空间填充球表示。图c为NanoLuc荧光素酶CEl结合的荧光素结合表面位点的特写,三个突变后增加生物发光的残基D9、H57和K89以青色空间填充球表示,其他蛋白残基以青色棍状表示,CEl荧光素以绿色棍状表示。图d为NanoLuc突变体与CTZ(左列)和FMZ(右列)荧光素的相对荧光素酶活性热图,以NanoLuc野生型为100%。图e为双突变NanoLuc-D9R/K89R和三突变NanoLuc-D9R/H57A/K89R的荧光素酶活性相对增加倍数(包括标准误差),以NanoLuc野生型为1。绝对的荧光素酶动力学参数(Km、kcat和kcat/Km)值总结于表1。图f和g为长期活细胞生物发光成像,展示培养的ARPE-19细胞表达原始NanoLuc或工程化的NanoLuc-CEl,并分别使用EnduRen(f)或Nano-Glo Endurazine(g)底物。荧光素酶活性在加入相应荧光素后通过LuminoCell设备测量,积分时间为5分钟。每个数据点代表三个重复的平均酶活性,标准误差以平均曲线周围的阴影区域表示。
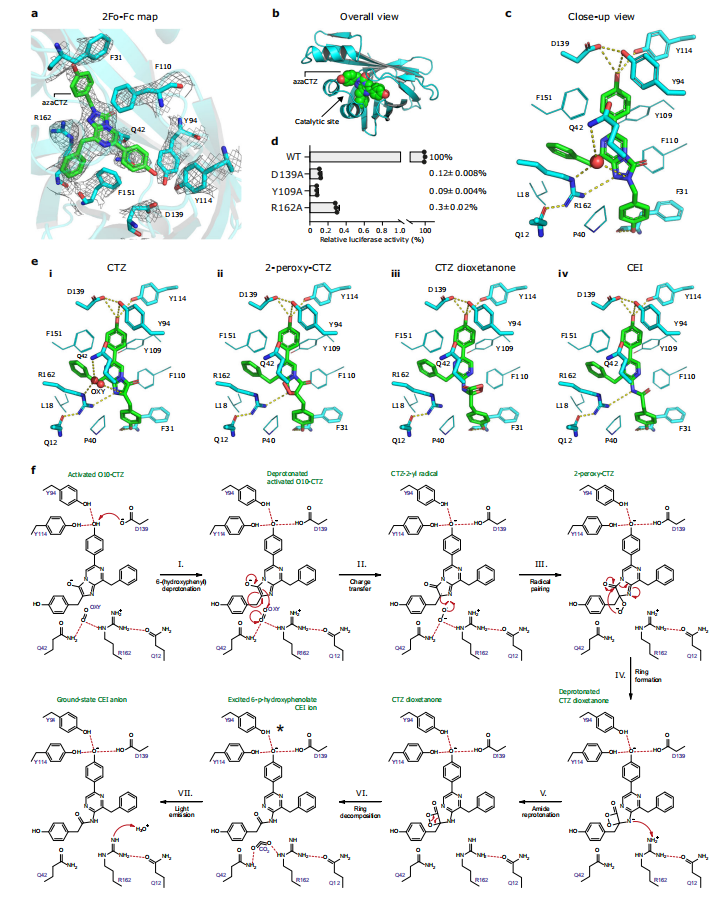
图5:NanoLuc荧光素酶的催化机制
图a展示了azaCTZ结合在NanoLuc-CEl催化位点的电子密度图。图b和c为NanoLuc的整体结构和azaCTZ结合位点的特写,关键残基和水分子以不同颜色标记。图d为活性位点突变分析,显示突变对荧光素酶活性的影响。图e和f通过模型化和蓝图形式展示了催化位点中氧气、CTZ和CEl的结合及反应机制,包括CTZ的去质子化、自由基反应、环化和发光过程。
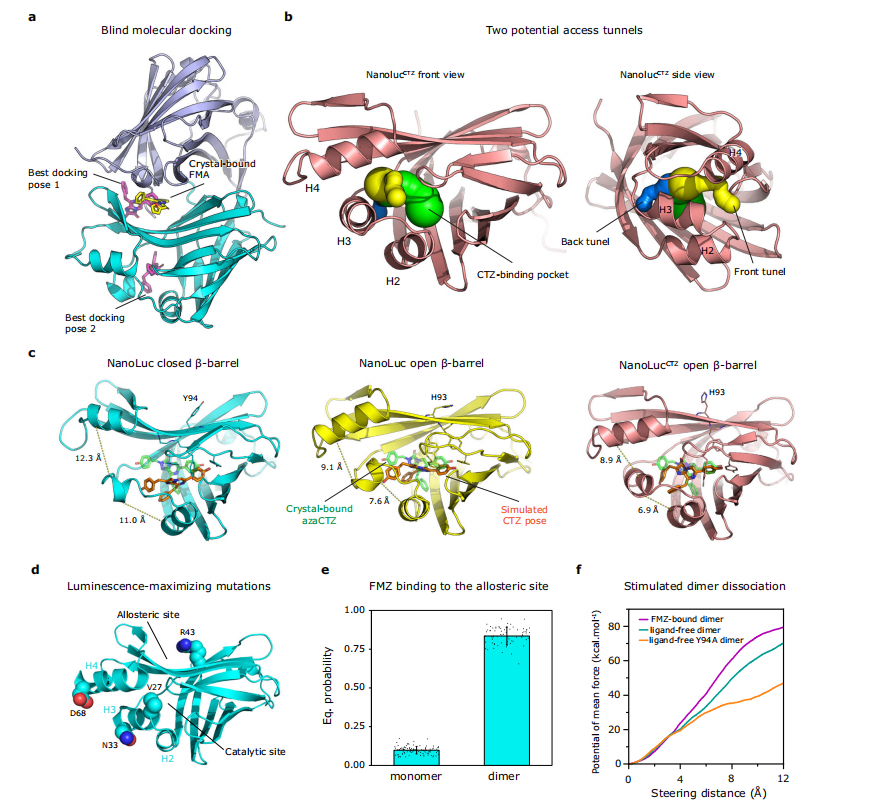
图6:NanoLuc复合物的分子对接和计算模拟研究
通过分子对接,研究了FMZ与NanoLuc单体二聚体的结合模式,并与晶体结构中的FMA进行了对比。计算分析发现NanoLuc存在两个潜在的通道通往荧光素结合腔,为底物进入提供了可能路径。动力学模拟揭示了CTZ在NanoLuc中的结合姿态及其与周围残基的相互作用。此外,研究还分析了NanoLuc闭合β-桶结构中的关键突变位点,这些突变有助于最大化FMZ的荧光。结合概率分析表明,FMZ在单体和二聚体NanoLuc表面口袋中的结合具有不同的概率分布。最后,通过力场分析计算了不同NanoLuc二聚体亚基分离所需的平均力,揭示了其力学特性。这些研究为理解NanoLuc的结构与功能提供了重要依据,并为基于NanoLuc的生物传感器设计提供了理论支持。
本研究通过结构分析、突变体实验和计算机模拟揭示了NanoLuc荧光素酶的特性。发现酶表面存在一个新的荧光素结合位点,由β-桶结构的凹槽形成,与脂肪酸结合位点重叠。SAXS分析确认NanoLuc在溶液中以单体形式存在,且β-桶结构存在开放和闭合状态的转换。突变体研究显示,某些突变显著提高了CTZ的生物发光,而不影响FMZ。细胞实验表明,工程化的NanoLucCTZ突变体在长期活细胞成像中表现优越。共结晶结构和模拟揭示了荧光素进入催化位点的路径,且FMZ结合显著稳定了酶的二聚体形式。这些发现为理解NanoLuc的作用机制提供了结构基础。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
下一篇:CRISPR技术联合单细胞RNA测序在乙肝感染研究中的应用