常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-02-12 08:01:32 细胞资源库平台 访问量:415
荧光素酶报告基因系统是一种基于荧光素酶催化底物氧化反应产生生物发光的检测技术,广泛应用于细胞生物学研究。其中,萤火虫荧光素酶(firefly luciferase, Fluc)因其高灵敏度、宽线性检测范围(约7~8个数量级)以及较短的半衰期(在哺乳动物细胞中约为3小时,在植物细胞中约为3.5小时)而成为最常用的报告基因。其发光信号强度在酶浓度为10⁻¹⁶ mol/L至10⁻⁸ mol/L的范围内与酶活性呈线性关系,并且在理想条件下可检测到低至10⁻²⁰ mol/L的荧光素酶活性。此外,荧光素酶报告基因系统具有非放射性、检测快速、灵敏度高(比氯霉素乙酰转移酶CAT高100倍)等优点,特别适用于高通量筛选和活细胞检测。通过将荧光素酶报告基因载体转染至宿主细胞后,可利用荧光素酶检测系统灵敏且便捷地监测基因表达水平,已成为细胞生物学研究中的重要工具。
英文标题:Development of a dual-luciferase reporter system for in vivo visualization of MicroRNA biogenesis and posttranscriptional regulation
中文标题:开发一种用于体内可视化MicroRNA生物合成和转录后调控的双荧光素酶报告系统
发表期刊:《J Nucl Med》
影响因子:9.1
作者单位:
1.Interdisciplinary Program in Brain Science, Seoul National University, Seoul, Korea.
2.Department of Nuclear Medicine, Seoul National University College of Medicine, Seoul, Korea.
3.Medical Research Center, Seoul National University College of Medicine, Seoul, Korea.
作者信息:
Ji Young Lee, Soonhag Kim, Do Won Hwang, Jae Min Jeong, June-Key Chung, Myung Chul Lee, Dong Soo Lee
微小RNA(miRNA)是一类在植物和动物中普遍表达的17到24个核苷酸长度的单链非编码RNA分子,近期研究发现其在转录后水平调控基因表达,并在多种生物学过程中起关键作用。尽管miRNA的生物学功能逐渐被理解,但其在转录后调控方面的主要功能,如mRNA降解或靶基因翻译抑制,尚未完全明确。在动物中,成熟的miRNA通过涉及pre-miRNA从细胞核转移到细胞质的顺序处理过程生成。目前,检测miRNA在转录后调控各个阶段的内源性水平的技术耗时且繁琐,无法在同一受试者上重复进行。本研究提出了一种体内非侵入性成像系统,通过使用两种不同的生物发光蛋白——萤火虫荧光素酶(Fluc)和高斯荧光素酶(Gluc),来监测内源性miRNA生物合成及其转录后处理。
本研究构建了两种报告基因载体,miR23P639/Fluc和CMV/Gluc/3xPT mir23,用于监测miRNA的生物合成和转录后调控。miR23P639/Fluc载体通过将pri-miR-23a的启动子序列与萤火虫荧光素酶(Fluc)基因融合,用于监测pri-miR-23a的表达。CMV/Gluc/3xPT mir23载体则包含三个miR-23a的完美互补靶序列,融合在高斯荧光素酶(Gluc)基因的终止密码子后,用于检测成熟miR-23a的活性。通过共转染这两种载体到HeLa和293细胞中,同时监测pri-miR-23a的转录和成熟miR-23a的活性。此外,还通过RT-PCR和qRT-PCR技术检测了干细胞分化标志物和pri-miR-23a的表达,以及成熟miR-23a的水平。为了在活体动物中验证miR-23a的表达和活性,将转染了上述载体的细胞皮下植入裸鼠体内,并使用生物发光成像技术进行监测。通过尾静脉注射coelenterazine和D-luciferin,分别获取Gluc和Fluc的活体成像。
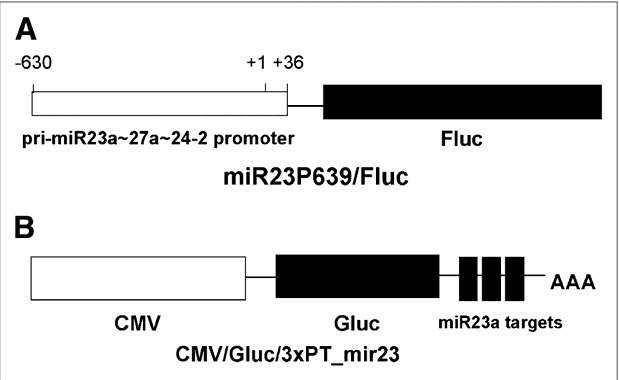
图1:展示了用于监测初级转录本和成熟miRNA活性的报告基因构建
图A中:miR23P639/Fluc构建中,将位于miR23a;27a;24-2基因簇转录起始位点上游603至36个碱基对的片段插入到含有无启动子Fluc基因的pGL3_basic(Promega)载体中。图B中:CMV/Gluc/3xPT_mir23构建中,CMV/Gluc在其3'非翻译区(3' UTR)携带3个与miR-23a完全互补的靶序列(3xPT_mir23)。
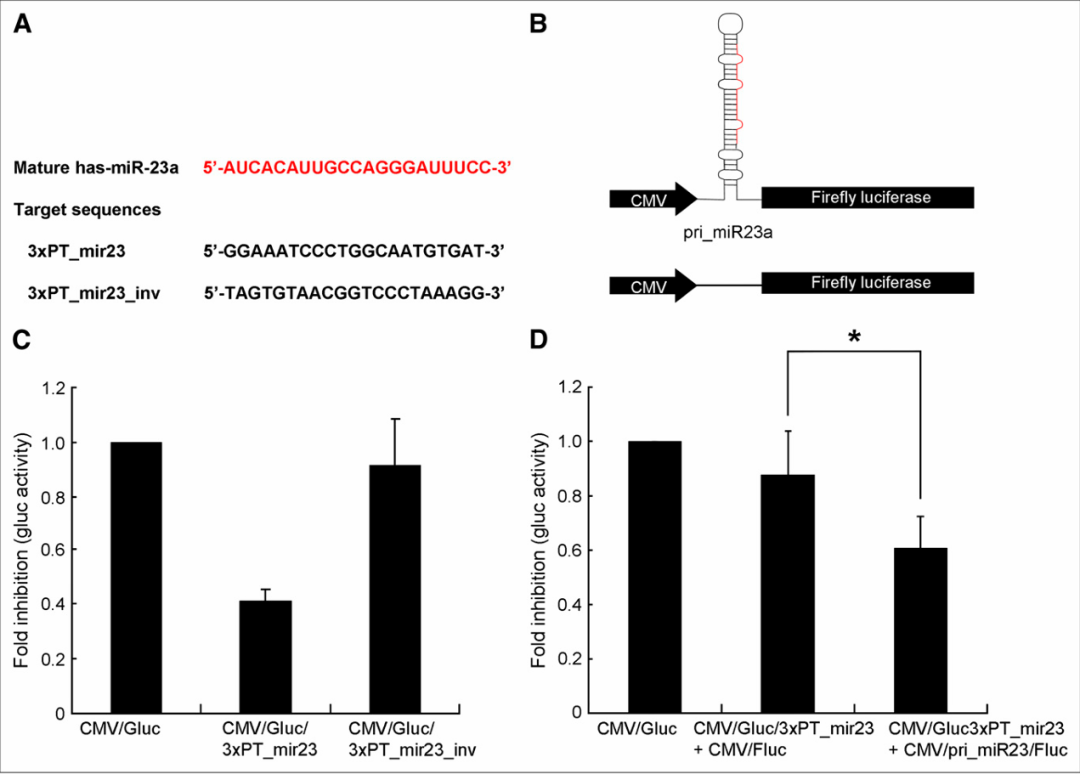
图2:展示了用于验证CMV/Gluc/3xPT mir23构建以代表成熟miR-23a活性的实验结果
图A中:成熟miR-23a序列及其相关的靶序列被插入到Gluc报告基因的3'非翻译区(3' UTR)中。构建了两个3xPT_mir23序列的靶标;一个是完美互补序列,另一个是倒序序列,用作阴性对照。图B中:构建了CMV/pri-miR-23a/Fluc和CMV/Fluc,分别作为pri-miR-23a的外源来源及其阴性对照。图C中:CMV/Gluc/3xPT mir23和CMV/Gluc/3xPT mir23 inv被转染到HeLa细胞中。HeLa细胞中内源性成熟的miR-23a抑制了转染的CMV/Gluc/3xPT_mir23构建的Gluc活性,但未抑制转染的CMV/Gluc/3xPT mir23 inv构建的Gluc活性。图D中:CMV/pri-miR-23a/Fluc和CMV/Gluc/3xPT mir23被共转染到293细胞中,分别使用CMV/Fluc和CMV/Gluc作为对照。外源性表达的pri-miR-23a应被加工成成熟的miR-23a,从而部分抑制293细胞中共转染CMV/pri-miR23a/Fluc和CMV/Gluc/3xPT mir23的Gluc活性。共转染的CMV/Fluc,不表达pri-miR-23a,未抑制293细胞转染CMV/Gluc/3xPT mir23的Gluc活性。*P < 0.001。
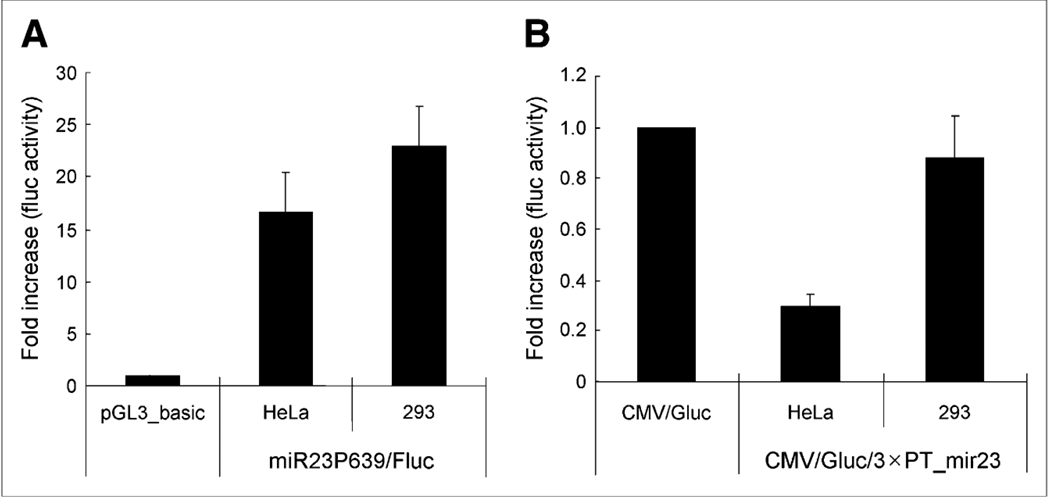
图3:展示了HeLa和293细胞中Fluc和Gluc活性的变化,以评估miR-23a的内源性表达和成熟活性
图A中:与pGL_basic载体相比,miR23P639/Fluc转染在HeLa和293细胞中使萤火虫荧光素酶(Fluc)活性增加了10倍。Fluc活性的增加代表了这些细胞中内源性pri-miR-23a表达的增加。
图B中:与CMV/Gluc转染相比,CMV/Gluc/3xPT_mir23转染在HeLa细胞中使高斯荧光素酶(Gluc)活性下降,但在293细胞中没有变化。Gluc活性的抑制代表了成熟miR-23a活性的存在,从而表明HeLa细胞中miR-23a的协调表达,而293细胞中pri-miR-23a的表达和成熟miR-23a的活性则不一致。数据以三份重复的均值±标准差表示。
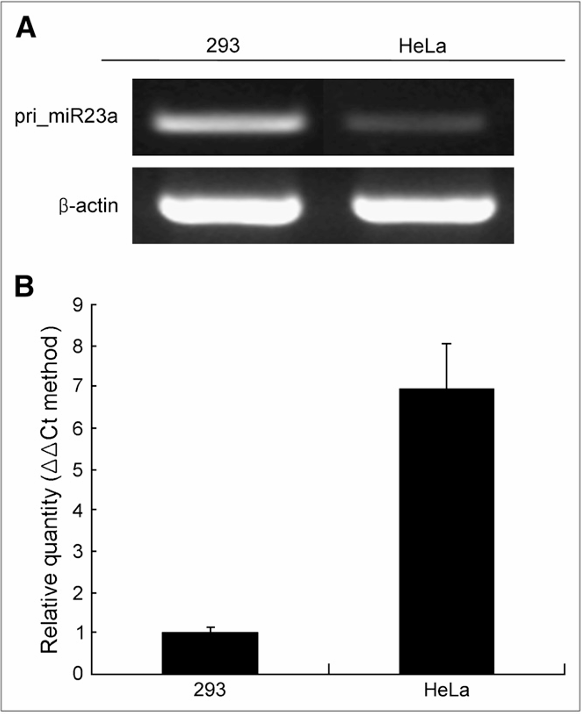
图4:展示了HeLa和293细胞中内源性pri-miR-23a和成熟miR-23a的水平
图A中:通过RT-PCR测定HeLa和293细胞中内源性pri-miR-23a的水平,以β-actin作为对照。图B中:通过实时qRT-PCR测定HeLa和293细胞中成熟miR-23a的相对量。数据以三份重复的均值±标准差表示,U6 snRNA用作内源性对照。ΔΔCt计算公式为ΔΔCt = ΔCt(miRNA) - ΔCt(U6 RNA),其中ΔCt = Ct(miRNA) - Ct(U6 RNA),ΔΔCt293 = ΔCt293 - ΔCt293,ΔΔCtHeLa = ΔCtHeLa - ΔCt293。
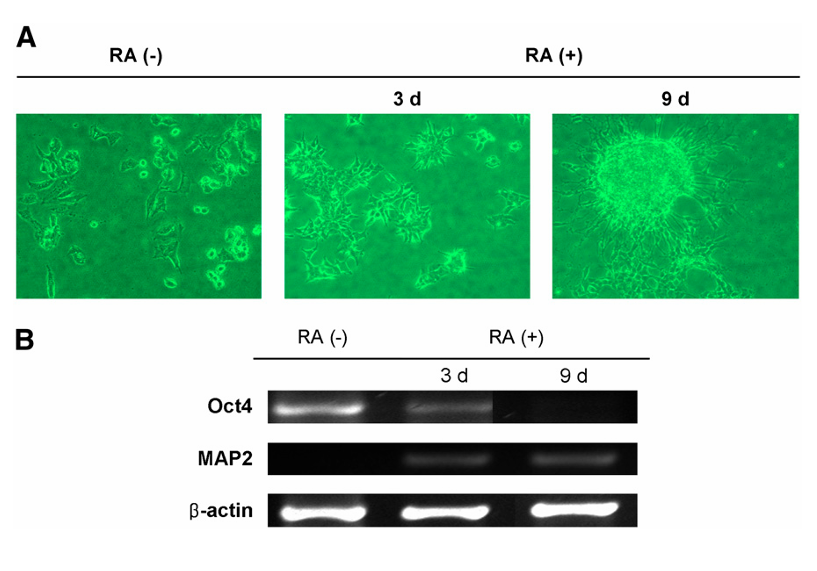
图5:展示了P19细胞经视黄酸(RA)处理后的神经元分化过程
图A中:通过相位差显微镜拍摄的序列图像显示P19细胞的神经发生过程。细胞首先通过变圆形成神经元形态,然后产生突起,最终形成带有生长神经突的类神经球状聚集体。图B中:从未经分化或经RA处理3天和9天后的P19细胞中提取RNA,并通过RT-PCR分析。结果显示,RA处理后Oct4表达降低,P19细胞分化为MAP2阳性的神经元细胞。
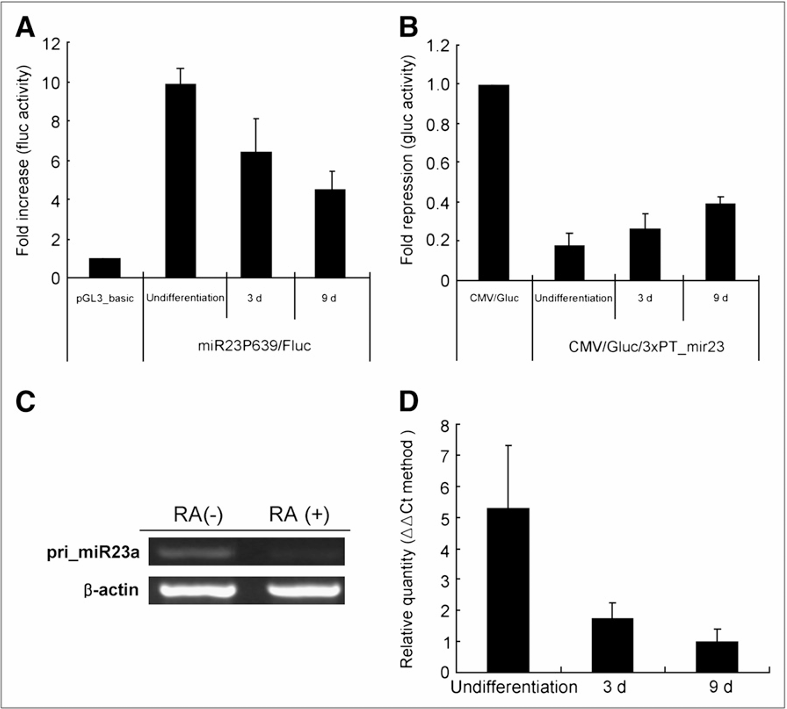
图6:展示了P19细胞在神经发生过程中pri-miR-23a的表达和成熟miR-23a的活性变化
图A中:miR23P639/Fluc转染在未分化的P19细胞中显著增加了Fluc活性,表明pri-miR-23a表达增强,而在分化后的P19细胞中,这种活性在第3天和第9天逐渐降低。
图B中:CMV/Gluc/3xPT_mir23转染在未分化的P19细胞中显著降低了Gluc活性,表明成熟miR-23a活性增强,而在分化后的P19细胞中,这种活性在第3天和第9天逐渐恢复。
图C和图D:通过RT-PCR和qRT-PCR验证了这些变化,显示在P19细胞神经发生过程中,pri-miR-23a和成熟miR-23a的表达均减少。数据以三份重复的均值±标准差表示。
图7:展示了在裸鼠中通过活体成像技术可视化HeLa细胞(A)、293细胞(B)和未分化的P19细胞(C)中pri-miR-23a转录本的表达和成熟miR-23a的活性 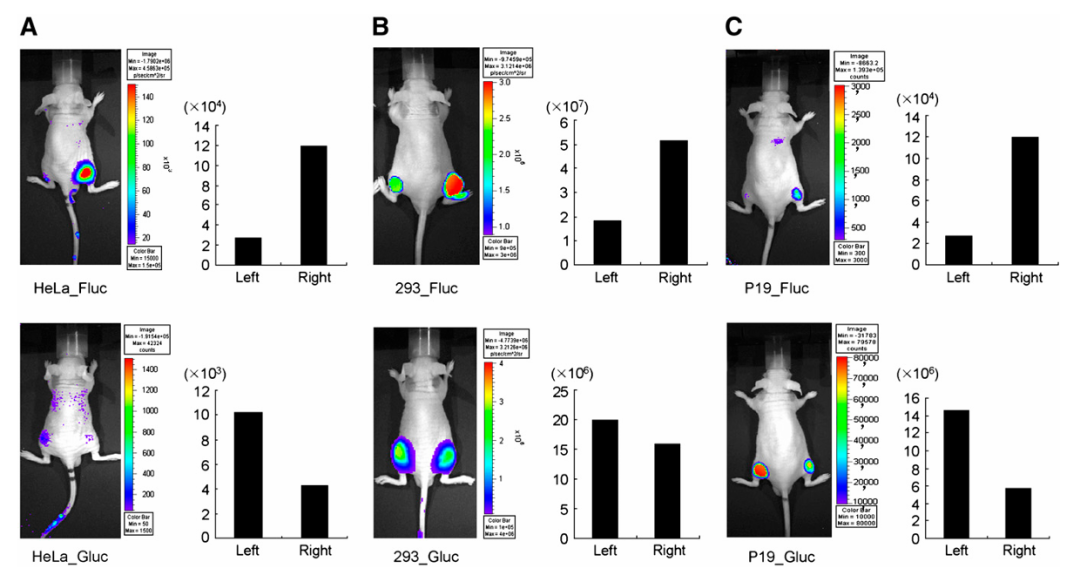
图7:展示了在裸鼠中通过活体成像技术可视化HeLa细胞(A)、293细胞(B)和未分化的P19细胞(C)中pri-miR-23a转录本的表达和成熟miR-23a的活性
这些细胞被转染了miR23P639/Fluc和CMV/Gluc/3xPT_mir23,并移植到小鼠的右侧(1×107个细胞)。作为对照,相同细胞被转染了pGL3_basic和CMV/Gluc,并移植到小鼠的左侧。通过感兴趣区域(ROI)分析从活体成像中获得的定量数据,并显示在每张小鼠图片旁边。首先使用coelenterazine获取Gluc图像,然后使用D-luciferin获取Fluc图像。在查看Fluc图像时,我们关注移植细胞右侧表达pri-miR-23a转录本的生物发光增加。在查看Gluc图像时,我们寻找右侧与左侧CMV/Gluc对照组相比生物发光减少的情况,揭示成熟miR-23a的活性。所有动物右侧的Fluc活性增加,而HeLa和P19细胞的Gluc活性减少,但293细胞中CMV/Gluc/3xPT_mir23转染的右侧减少最少。
在HeLa细胞和未分化的P19细胞中,代表初级miR-23a转录本水平的增加的Fluc活性反映了代表成熟miR-23a活性的Gluc活性的相应增加的抑制。然而,293细胞显示出Gluc活性并没有像Fluc活性增加那样被抑制,表明293细胞中miR-23a转录本的转录后加工过程存在阻断。在用视黄酸处理前后对P19细胞进行神经分化,体外实验中显示出Fluc活性的增加和Gluc活性的相应减少。移植到裸鼠体内的HeLa、293细胞和未分化的P19细胞在体内和体外显示出完全相同的荧光素酶活性模式。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:MicroRNA 130a通过关键代谢途径调控丙型肝炎病毒和乙型肝炎病毒复制