常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-02-11 09:12:38 细胞资源库平台 访问量:499
英文标题:Cuproptosis-related MiR-21-5p/FDX1 axis in clear cell renal cell carcinoma and its potential impact on tumor microenvironment
中文标题:肾透明细胞癌中铜中毒相关MiR-21-5p/FDX1轴及其对肿瘤微环境的潜在影响
发表期刊:《Cells》
影响因子:6
作者单位:西南医科大学基础医学院生物化学与分子生物学系、西南医科大学附属医院泌尿外科等
作者信息:Mingyue Xie ,Bo Cheng ,Shuang Yu ,et al.
细胞死亡在人体内受到精确的分子调控,包括凋亡、坏死性凋亡、焦亡和铁死亡等已知方式。
最近发现一种新型细胞死亡方式——铜死亡(cuproptosis),由铜离子载体介导,且无法被现有细胞死亡抑制剂阻断。
铜死亡与铜离子浓度和蛋白质脂酰化密切相关。
过量铜离子结合脂酰化蛋白,导致蛋白聚集、铁硫簇蛋白丢失,引发蛋白毒性应激和细胞死亡。
已鉴定出10个与铜死亡相关的基因,其中7个促进铜死亡,3个抑制铜死亡。
FDX1是铜死亡的主要调控因子,通过将Cu2+还原为有毒的Cu1+,并调控蛋白质脂酰化,促进铜死亡。
FDX1在多种癌症(如膀胱癌、肝癌、黑色素瘤和乳腺癌)中具有预后指示作用。
ccRCC占肾癌的80%,主要由VHL基因失活引起。
VHL失活导致HIF-1α和HIF-2α积累,促进肿瘤生长、转移和新血管生成。
尽管已有靶向药物(如舒尼替尼和帕唑帕尼),但细胞死亡抗性限制了疗效。
研究探讨铜死亡调控因子的临床价值及FDX1在ccRCC中的作用。
对铜死亡敏感的患者生存期更长,可能与CD4+ T细胞浸润有关。
FDX1抑制ccRCC细胞生长和侵袭,其表达与T分期、肿瘤分级和CD4+ T细胞浸润相关。
FDX1受到miR-21-5p的转录后调控,miR-21-5p通过直接结合降低FDX1表达。
miR-21-5p/FDX1轴与ccRCC微环境中的免疫细胞浸润密切相关。
miR-21-5p/FDX1轴介导的铜死亡抗性及其调控的肿瘤微环境是ccRCC进展的潜在机制。
恢复铜死亡可能成为治疗ccRCC的替代策略。
从癌症基因组图谱(TCGA)和基因表达综合数据库(GEO)下载RNA测序数据集及相关临床信息。
从UCSC Xena获取DNA甲基化数据集(KIRC,Illumina Human 450)。
使用“survival” R包评估TCGA-KIRC中ccRCC患者的总生存期。
使用“tinyarray” R包将TCGA样本分为“肿瘤”组和“正常”组。
使用“ConsensusClusterPlus” R包将TCGA KIRC样本分为两个聚类,并通过主成分分析(PCA)和t-SNE分析进行可视化。
通过多变量Cox回归分析生成铜死亡风险评分,并根据最优截断点将患者分为高评分组和低评分组。
使用GO和KEGG进行功能富集分析,并通过GSEA软件进行基因集富集分析。
使用“minfi”包对DNA甲基化数据进行标准化,并可视化铜死亡调控因子的启动子区域甲基化水平。
使用CIBERSORT算法和LM22特征矩阵评估免疫细胞浸润水平。
使用VHL缺失型(OSRC-2)和VHL野生型(ACHN)肾癌细胞系,在10% FBS DMEM培养基中培养。
使用lipofectamine 3000转染试剂将针对FDX1的siRNA转染至细胞中,siRNA序列由通用生物公司提供。
使用RIPA缓冲液裂解细胞,通过SDS-PAGE分离蛋白质并转移到尼龙膜上,使用FDX1抗体进行检测。
使用TRIzol试剂提取总RNA,并通过逆转录和SYBR Green染料进行实时定量PCR检测FDX1表达。
将RCC细胞接种于96孔板中,使用CCK8试剂盒检测细胞活力。
使用Matrigel包被Transwell上室,将RCC细胞接种于上室中,16小时后固定并染色,计算侵袭细胞数量。
使用铜比色法检测OSRC-2细胞中的Cu2+水平,基于580 nm吸光度值绘制标准曲线。
对ccRCC组织切片进行脱蜡、抗原修复和封闭处理,使用FDX1和CD4抗体进行染色,并通过DAB显色检测信号。
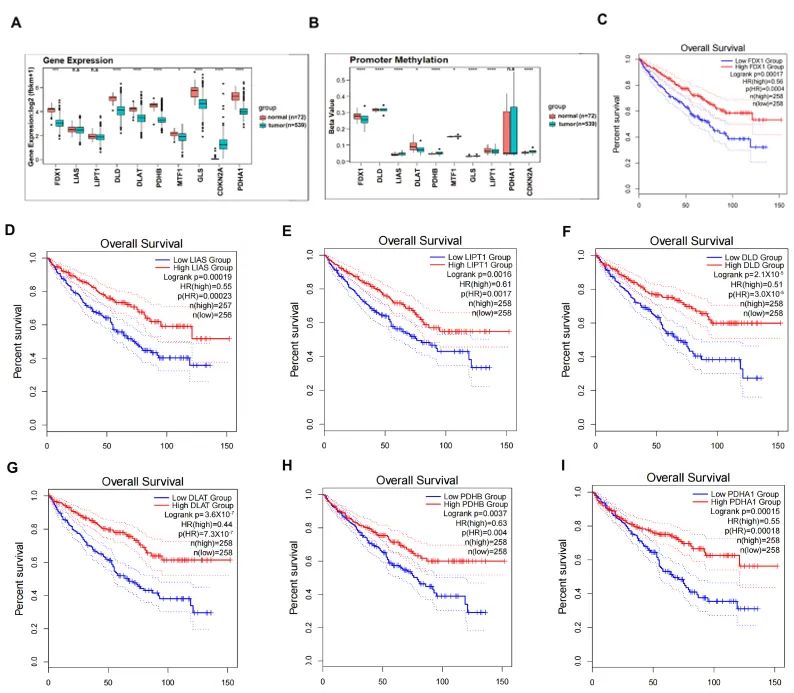
图A展示了ccRCC与正常肾组织中铜死亡调控因子的表达水平差异。
图B比较了ccRCC与正常肾组织中铜死亡调控因子启动子区域的甲基化水平。
图C显示,FDX1高表达的ccRCC患者生存期更长(Kaplan-Meier生存分析)。
图D至图I分别展示了DLAT、DLD、PDHB、LIAS、LIPT1和PDHA1高表达的ccRCC患者生存期显著延长(Kaplan-Meier生存分析)。
图中标注了显著性水平:* p < 0.05,*** p < 0.001,**** p < 0.0001;n.s.表示无显著性差异。
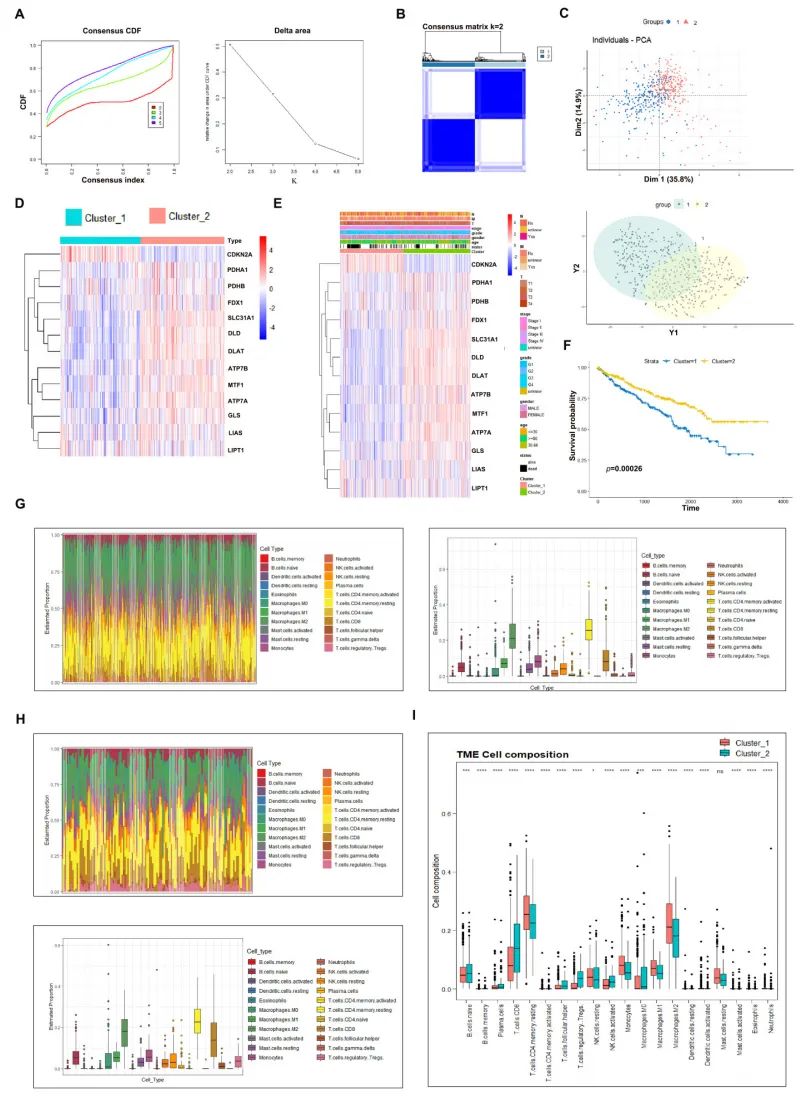
图A展示了类别数k的累积分布函数(CDF)和delta区域分析结果。
图B显示了当k=2时的共识矩阵。
图C通过主成分分析(PCA)对铜死亡敏感组(CSS)和铜死亡抵抗组(CRS)进行了分析。
图D展示了CSS和CRS中铜死亡调控因子的表达热图。
图E比较了CSS和CRS患者的临床病理特征。
图F显示,CSS患者的生存期显著长于CRS患者。
图G展示了CSS患者中免疫细胞的估计比例。
图H展示了CRS患者中免疫细胞的估计比例。
图I比较了CSS和CRS患者之间的免疫细胞浸润情况。
图中标注了显著性水平:* p < 0.05,*** p < 0.001,**** p < 0.0001;n.s.表示无显著性差异。
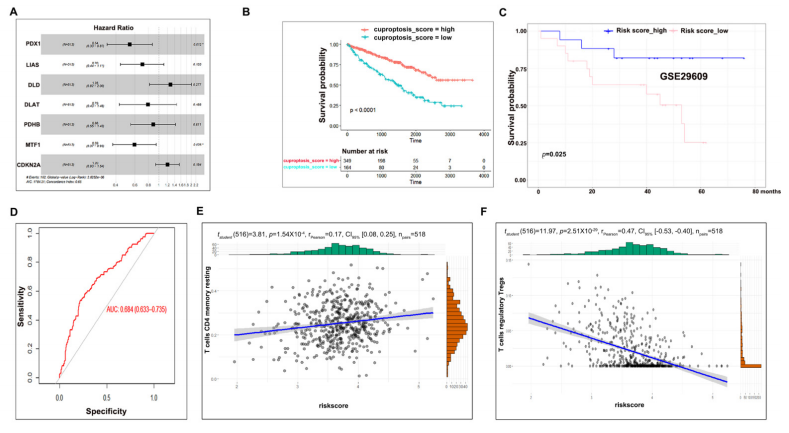
图A展示了七个铜死亡调控因子的多变量Cox回归分析结果。
图B显示,铜死亡评分高的患者生存期显著长于铜死亡评分低的患者。
图C在另一个独立数据集中验证了铜死亡风险评分的适用性。
图D通过AUC分析评估了图C的结果。
图E展示了CD4+ T记忆静息细胞数量与铜死亡风险评分之间的相关性。
图F展示了调节性T细胞(Treg)数量与铜死亡风险评分之间的相关性。
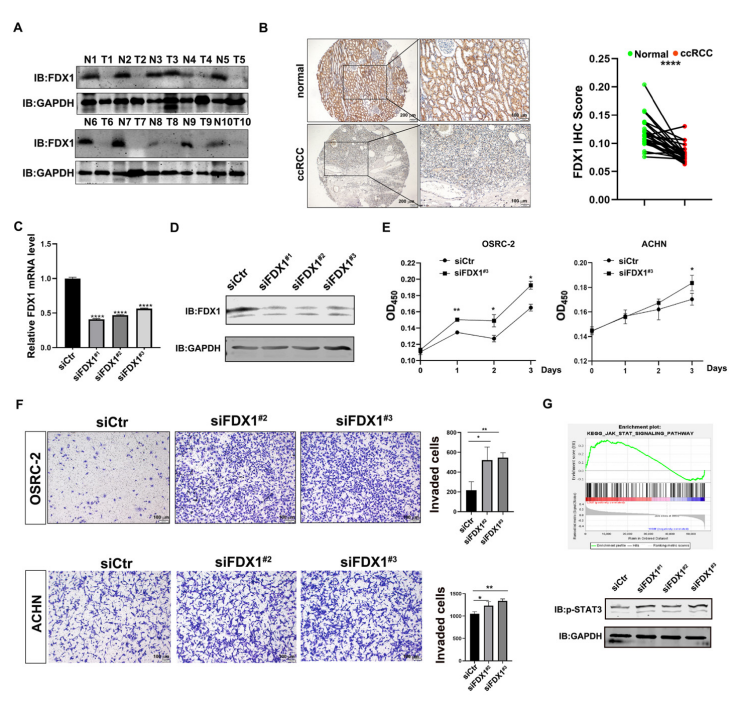
图A通过Western blotting检测了10对ccRCC样本中FDX1的表达水平。
图B展示了ccRCC组织微阵列中FDX1的免疫组织化学(IHC)染色结果(27/62例ccRCC样本及其配对癌旁组织)。左图为IHC染色的代表性图像,右图为IHC染色的统计分析。比例尺:左图200 µm,右图100 µm。
图C和图D分别通过qPCR(C)和Western blotting(D)验证了OSRC-2细胞中FDX1的敲低效率。
图E显示,敲低FDX1显著促进了OSRC-2和ACHN细胞的生长。
图F显示,敲低FDX1显著增强了OSRC-2和ACHN细胞的侵袭能力。左图为侵袭细胞的代表性图像,右图为侵袭细胞的统计分析。比例尺:100 µm。
图G显示,GSEA分析表明JAK-STAT信号通路在FDX1低表达的ccRCC患者中富集(上图);FDX1 siRNA激活了OSRC-2细胞中的STAT3信号通路(下图)。GAPDH作为内参对照。
图中标注了显著性水平:* p < 0.05,** p < 0.01,**** p < 0.0001。
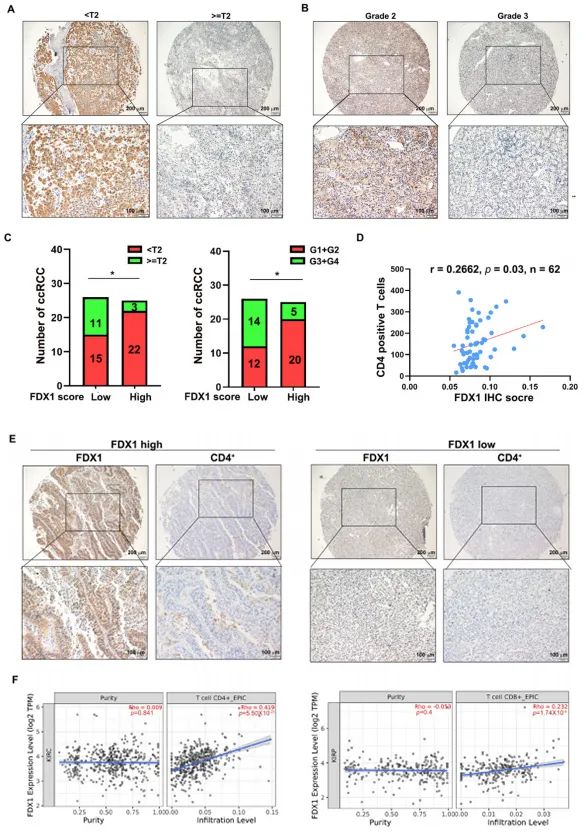
图A展示了不同组织学T分期的ccRCC样本中FDX1的IHC染色代表性图像。比例尺:上图200 µm,下图100 µm。
图B展示了不同分级的ccRCC样本中FDX1的IHC染色代表性图像。比例尺:上图200 µm,下图100 µm。
图C显示,组织学T分期
图D显示,FDX1 IHC评分与ccRCC中CD4+ T细胞浸润呈正相关(r = 0.2662,p = 0.03,n = 62)。
图E展示了FDX1表达强度与CD4+ T细胞浸润相关性的代表性图像。比例尺:上图200 µm,下图100 µm。
图F通过TIMER 2.0对TCGA-KIRC数据集的免疫细胞浸润分析显示,FDX1表达与CD4+和CD8+ T细胞数量呈正相关。
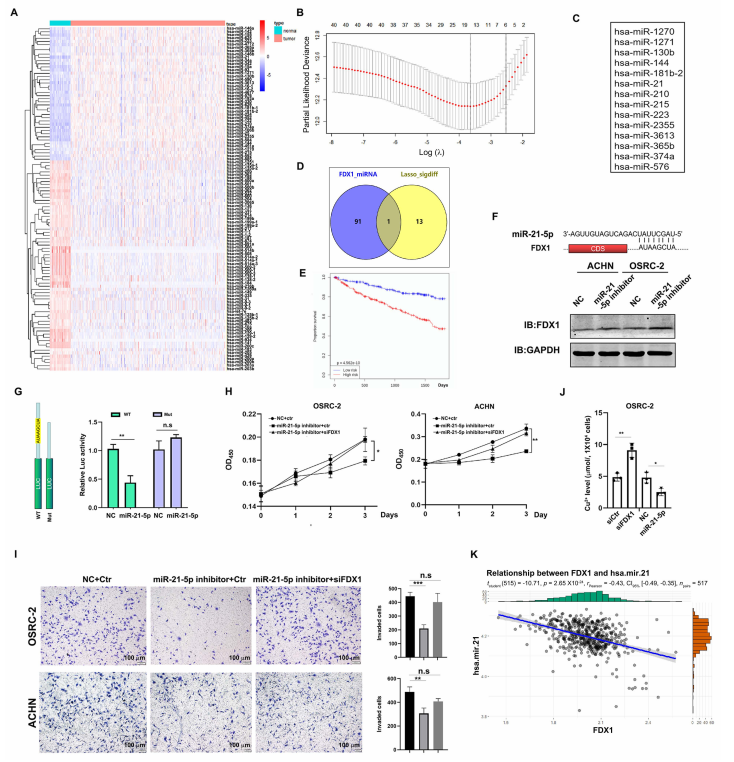
图A展示了正常肾组织与ccRCC之间差异表达的miRNA热图。
图B通过基于预后的LASSO分析筛选了差异miRNA。
图C列出了14个与预后高度相关的miRNA。
图D通过维恩图展示了14个miRNA与FDX1靶向miRNA的交集。
图E显示,miR-21-5p高表达与ccRCC患者较短的总生存期相关。
图F展示了FDX1的3'-UTR与miR-21-5p的预测结合位点(上图),以及miR-21-5p抑制剂处理显著提高了ACHN和OSRC-2细胞中FDX1的表达(下图)。GAPDH作为内参对照。
图G通过荧光素酶报告实验显示,miR-21-5p模拟物显著抑制了FDX1 3'-UTR的活性。
图H显示,miR-21-5p抑制剂抑制ACHN和OSRC-2细胞生长的作用可被FDX1敲低所逆转。
图I显示,miR-21-5p抑制剂抑制OSRC-2细胞侵袭的作用可被FDX1敲低所阻断。左图为侵袭细胞的代表性图像,右图为统计分析。比例尺:100 µm。
图J展示了miR-21-5p抑制剂或siFDX1处理前后OSRC-2细胞中Cu2+水平的变化。
图K显示,TCGA-KIRC数据集中miR-21-5p表达与FDX1呈负相关。
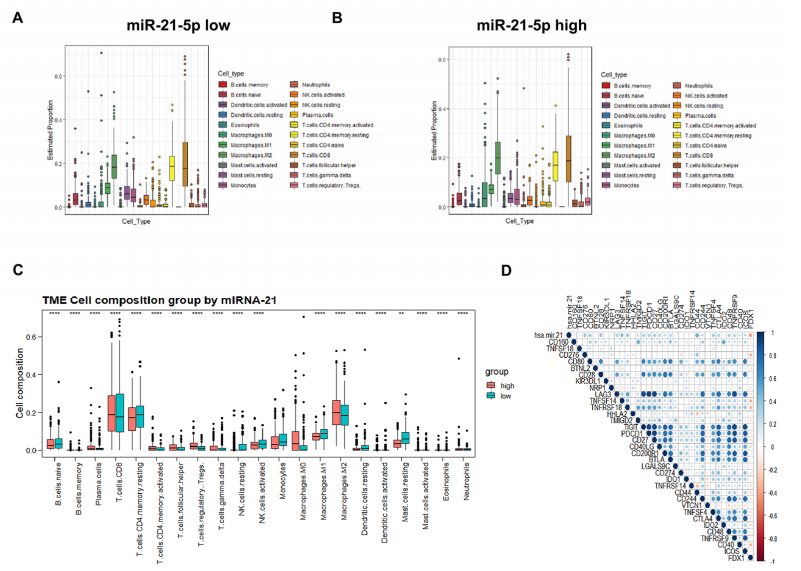
图A展示了miR-21-5p低表达的ccRCC患者中肿瘤微环境成分的估计比例。
图B展示了miR-21-5p高表达的ccRCC患者中肿瘤微环境成分的估计比例。
图C比较了miR-21-5p高表达与低表达ccRCC患者之间肿瘤微环境成分的差异。
图D展示了miR-21-5p/FDX1轴与免疫检查点之间的相关性。
● 铜死亡与ccRCC:铜死亡特征及其相关肿瘤微环境的预后价值已被认识,FDX1在ccRCC中具有肿瘤抑制作用。铜死亡抵抗患者生存率较低,临床病理特征较差。
● miR-21-5p/FDX1轴:研究发现miR-21-5p调控FDX1表达,miR-21-5p/FDX1轴与ccRCC微环境中的免疫细胞浸润(尤其是CD4+ T细胞)密切相关,FDX1具有铜死亡依赖性和独立性的肿瘤抑制功能。
● 癌细胞抗死亡机制:癌细胞通过高表达Bcl-2等机制抵抗凋亡,某些肿瘤细胞低表达焦亡相关基因(如DFNA5和GSDME),使其对焦亡诱导的细胞死亡不敏感。
● FDX1的调控与治疗潜力:ccRCC肿瘤中FDX1表达显著降低,miR-21-5p抑制剂可能具有治疗价值。此外,表观遗传调控(如DNA甲基化)和其他机制(如RNA修饰)可能影响铜死亡调控因子的表达。
FDX1的铜死亡独立性功能:敲低FDX1增加ccRCC细胞的侵袭性,并激活STAT3信号通路,表明FDX1可能通过非铜死亡途径影响肿瘤进展。
总结与治疗前景:研究揭示了miR-21-5p/FDX1轴在ccRCC中的作用,针对该轴的干预可能成为ccRCC治疗的新策略。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:抑制circ_znf512介导的miR-181d-5p通过EGR1/mTORC1通路限制心肌细胞自噬,促进心肌缺血/再灌注损伤
下一篇:MicroRNA 130a通过关键代谢途径调控丙型肝炎病毒和乙型肝炎病毒复制