常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-02-09 12:56:05 细胞资源库平台 访问量:273
英文标题:Circ_ZNF512-mediated miR-181d-5p inhibition limits cardiomyocyte autophagy and promotes myocardial ischemia/reperfusion injury through an EGR1/mTORC1 pathway
中文标题:抑制circ_znf512介导的miR-181d-5p通过EGR1/mTORC1通路限制心肌细胞自噬,促进心肌缺血/再灌注损伤
发表期刊:《Journal of Medicinal Chemistry》
影响因子:7.3
作者单位:郑州大学第一附属医院、天津医科大学生理学与病理生理学教研室
作者信息:Chen Huang,Liliang Shu,Hualu Zhang,Xiaohua Zhu,Gongcheng Huang,Jing Xu.
● 心肌缺血/再灌注(I/R)损伤是全球最致命的心血管疾病之一。
● Circular RNAs (circRNAs) 是内源性转录本,在多种生物、发育阶段和病理条件下表达。
● circRNAs 被证实参与心血管疾病的发病机制,包括I/R损伤和心肌梗死。
● circRNAs 在这些疾病中被视为潜在的治疗靶点。
● 微阵列基因表达谱 从GEO数据库中检索到与心肌I/R损伤相关的mRNA数据集GSE4105和miRNA数据集GSE50885。构建了小鼠心肌I/R损伤模型,并对心肌组织进行了circRNA测序。
● 小鼠心肌I/R损伤模型的建立 使用了104只雄性C57BL/6小鼠,其中88只用于构建心肌I/R损伤模型,76只建模成功,其余16只进行了假手术。
● 心肌组织circRNA测序 建立了两个小鼠心肌I/R损伤模型用于测序,并使用两个正常心脏样本作为对照。
● 心脏功能指数测定 建模后7天,通过超声检测小鼠的心脏功能指数。
● Evans Blue/TTC双重染色 通过Evans Blue/TTC双重染色来确定心肌缺血和梗死的面积。
● HE染色 对石蜡包埋的心肌组织进行HE染色,以观察组织结构。
● 透射电镜(TEM) 使用透射电镜观察小鼠心肌组织的超微结构。
● H/R细胞模型的开发和细胞处理 从1-2天大的C57BL/6小鼠中分离出心肌细胞,并在缺氧/复氧条件下处理。
● 免疫荧光检测 通过免疫荧光检测LC3荧光斑点的数量和分布。
● Hoechst 33258染色 使用Hoechst 33258染色来观察细胞核形态。
● 双荧光素酶报告基因检测 通过双荧光素酶报告基因检测来验证circ_ZNF512和miR-181d-5p之间的结合。
● 细胞质/核分离试验 使用PARIS试剂盒分离细胞质和核成分。
● RIP实验 使用RIP试剂盒来分析circ_ZNF512/miR-181d-5p和Ago2的结合。
● RNA下拉实验 通过RNA下拉实验来检测circ_ZNF512的富集。
● RNA分离和定量 从心肌组织和细胞中分离并定量总RNA。
● Western Blot分析 通过Western Blot分析来检测蛋白表达。
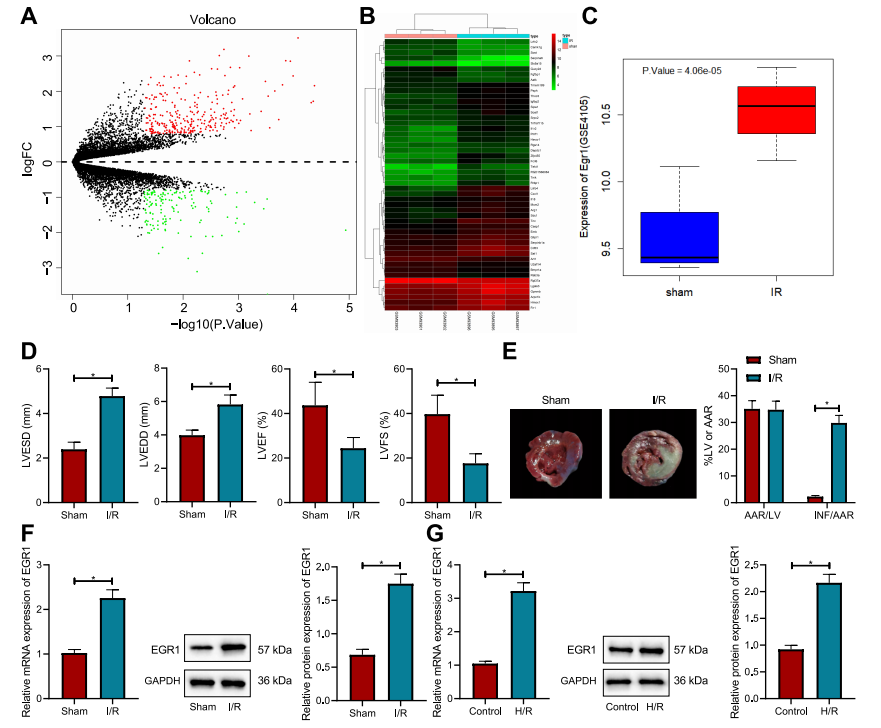
图1: I/R小鼠心肌组织和H/R诱导细胞中EGR1表达的升高
(A) GSE4105数据集中与心肌I/R损伤相关的差异表达mRNA火山图。黑色点表示没有显著差异的基因,红色点表示显著上调的基因,绿色点表示显著下调的基因。
(B) GSE4105数据集中前50个基因的热图。
(C) GSE4105数据集中EGR1表达数据的箱型图。左侧的蓝色箱表示对照组样本的表达,右侧的红色箱表示心肌I/R损伤样本的表达。
(D) 通过超声心动图检测的心脏功能相关指标(LVESD和LVEDD)。
(E) I/R小鼠心肌组织的Evans Blue/TTC双重染色。
(F) 通过RT-qPCR和Western Blot分析I/R小鼠心肌组织中EGR1的mRNA和蛋白表达。
(G) 通过RT-qPCR和Western Blot分析确定的H/R诱导细胞中EGR1的mRNA和蛋白表达。*与假手术小鼠或对照组细胞相比,p < 0.05。每组小鼠n=8。
实验独立进行了三次。
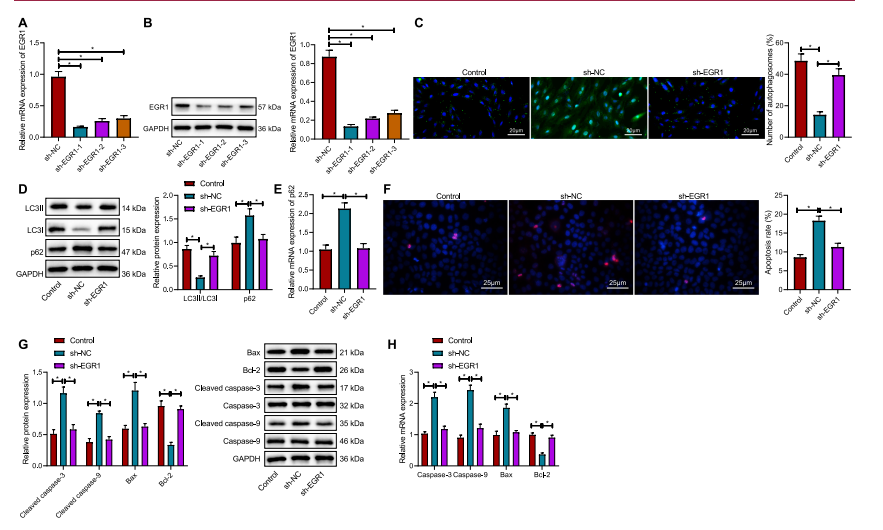
图2:敲除EGR1增强体外心肌细胞自噬并阻碍凋亡
(A) 通过RT-qPCR在心肌细胞中验证sh-EGR1-1、sh-EGR1-2和sh-EGR1-3序列的沉默效率。
(B) 通过Western Blot分析在心肌细胞中验证sh-EGR1-1、sh-EGR1-2和sh-EGR1-3序列的沉默效率。
(C) 通过免疫荧光GFP-LC3实验检测转染sh-EGR1的心肌细胞中自噬体的形成。4′,6-二脒基-2-苯基吲哚(DAPI)染色的细胞核为蓝色,GFP-LC3信号为绿色。
(D) 通过Western Blot分析在转染sh-EGR1的心肌细胞中检测LC3II/LC3I和p62的蛋白表达。
(E) 通过RT-qPCR分析在转染sh-EGR1的心肌细胞中检测LC3II/LC3I和p62的mRNA表达。
(F) 通过Hoechst 33258染色评估转染sh-EGR1的心肌细胞的凋亡情况。
(G) 通过Western Blot分析在心肌细胞中检测与凋亡相关的基因(Cas3、Cas9、Bax和Bcl-2)的蛋白表达。
(H) 通过RT-qPCR分析在心肌细胞中检测与凋亡相关的基因(Cas3、Cas9、Bax和Bcl-2)的mRNA表达。*与转染sh-NC的心肌细胞相比,p < 0.05。
实验独立进行了三次。
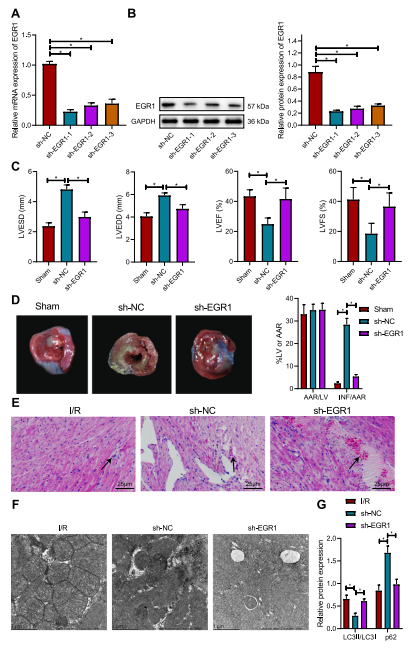
图3:敲除EGR1增强I/R小鼠心肌细胞的自噬,从而延迟心肌损伤
(A) 通过RT-qPCR在小鼠心肌组织中验证sh-EGR1-1、sh-EGR1-2和sh-EGR1-3序列的沉默效率。
(B) 通过Western Blot分析在小鼠心肌组织中验证sh-EGR1-1、sh-EGR1-2和sh-EGR1-3序列的沉默效率。
(C) 通过超声心动图检测在sh-EGR1处理的I/R小鼠中心脏功能的相关指标。
(D) 通过Evans Blue/TTC双重染色观察sh-EGR1处理的I/R小鼠心肌组织的梗死面积。
(E) 通过HE染色观察sh-EGR1处理的I/R小鼠心肌组织的病理变化。
(F) 通过透射电镜(TEM,20 000×)观察sh-EGR1处理的I/R小鼠心肌组织中线粒体的肌丝结构。
(G) 通过Western Blot分析检测sh-EGR1处理的I/R小鼠心肌组织中LC3II/LC3I和p62的蛋白表达。*与假手术小鼠或sh-NC处理的相比,p < 0.05。每组小鼠n=8。
实验独立进行了三次。
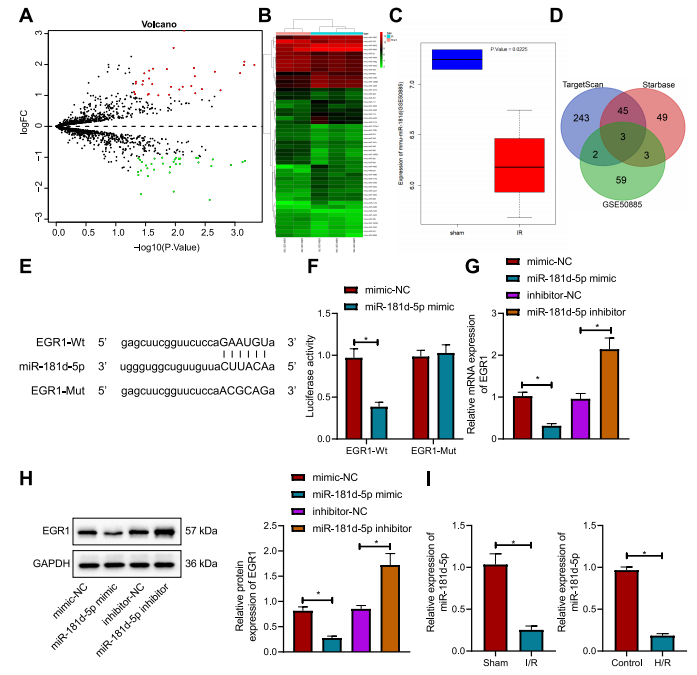
图4:EGR1是心肌细胞中miR-181d-5p的靶基因
(A) GSE50885数据集中与心肌I/R损伤相关的差异表达miRNA火山图。黑色点表示没有显著差异的miRNA,红色点表示显著上调的miRNA,绿色点表示显著下调的miRNA。
(B) GSE50885数据集中前50个miRNA的热图。
(C) 通过TargetScan和starBase数据库预测的EGR1的上游miRNA与GSE50885数据集中下调的miRNA的韦恩图分析。
(D) GSE50885数据集中miR-181d-5p表达数据的箱型图。左侧的蓝色箱表示对照组样本的表达,右侧的红色箱表示心肌I/R损伤样本的表达。
(E) starBase数据库预测的人类和小鼠中miR-181d-5p与EGR1的结合位点。
(F) 在293T细胞中通过双荧光素酶报告基因检测验证miR-181d-5p与EGR1的结合。
(G) 通过RT-qPCR检测转染miR-181d-5p模拟物或抑制剂的心肌细胞中EGR1的表达。
(H) 通过Western Blot检测转染miR-181d-5p模拟物或抑制剂的心肌细胞中EGR1的蛋白表达。
(I) I/R小鼠心肌组织和H/R诱导细胞中miR-181d-5p的表达。*与转染 mimic-NC 的293T细胞、转染 mimic-NC 或 inhibitor-NC 的心肌细胞、假手术小鼠或对照组细胞相比,p < 0.05。
实验独立进行了三次。
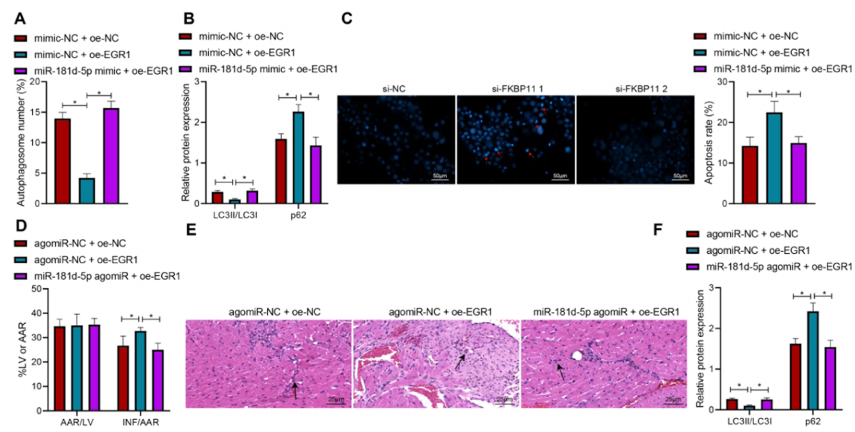
图5:miR-181d-5p通过靶向EGR1在体外和体内促进心肌细胞自噬并改善心肌损伤
(A) 通过免疫荧光GFP-LC3实验检测转染oe-EGR1或与miR-181d-5p模拟物联合处理的心肌细胞中自噬体的形成。
(B) 通过Western Blot分析检测转染oe-EGR1或与miR-181d-5p模拟物联合处理的心肌细胞中LC3II/LC3I和p62的蛋白表达。
(C) 通过Hoechst 33258染色评估转染oe-EGR1或与miR-181d-5p模拟物联合处理的心肌细胞的凋亡情况。
(D) 通过Evans Blue/TTC双重染色观察I/R小鼠心肌组织在处理oe-EGR1或与miR-181d-5p agomiR联合处理后的梗死面积。
(E) 通过HE染色观察I/R小鼠心肌组织在处理oe-EGR1或与miR-181d-5p agomiR联合处理后的病理变化。
(F) 通过Western Blot分析检测I/R小鼠心肌组织在处理oe-EGR1或与miR-181d-5p agomiR联合处理后的LC3II/LC3I和p62的蛋白表达。*与转染mimic-NC + oe-NC或mimic-NC + oe-EGR1的小鼠心肌细胞相比,或与处理agomiR-NC + oe-NC或agomiR-NC + oe-EGR1的I/R小鼠相比,p < 0.05。每组小鼠n=8。
实验独立进行了三次。
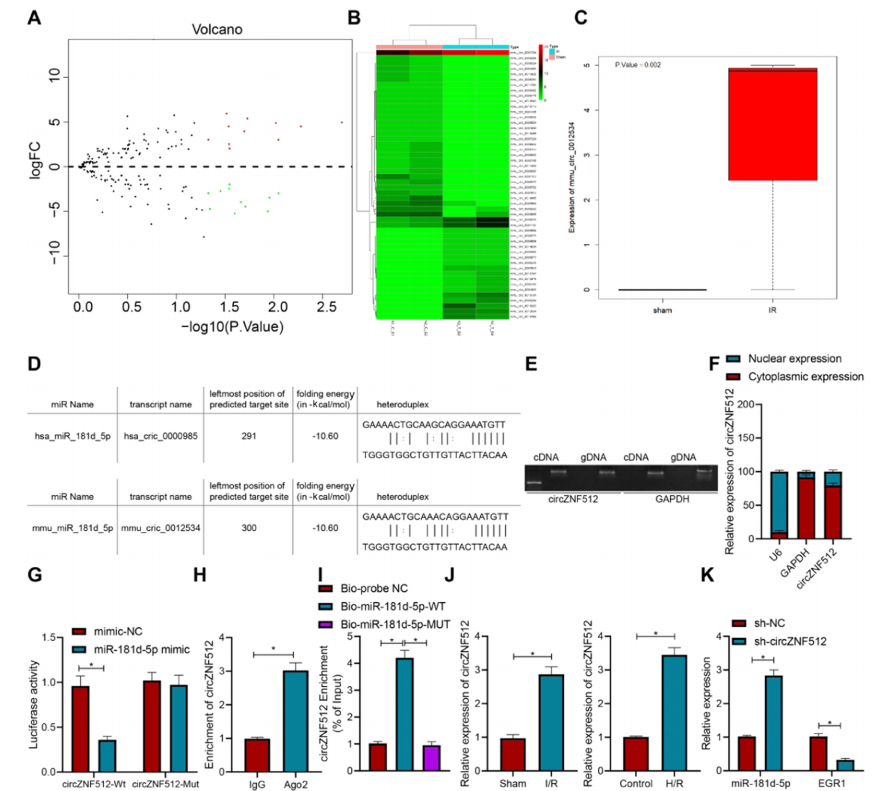
图6:circ_ZNF512与miR-181d-5p竞争性结合并上调EGR1的表达
(A) 序列数据集中与心肌I/R损伤相关的差异表达circRNA火山图。黑色点表示没有显著差异的circRNA,红色点表示显著上调的circRNA,绿色点表示显著下调的circRNA。
(B) 序列数据集中前50个circRNA的热图。
(C) 序列数据集中mmu_circ_0012534表达数据的箱型图。左侧的蓝色箱表示对照组样本的表达,右侧的红色箱表示心肌I/R损伤样本的表达。
(D) RNA22数据库预测的circ_ZNF512与miR-181d-5p在人类和小鼠中的结合位点。
(E) 通过琼脂糖凝胶电泳检测circ_ZNF512在cDNA和gDNA中的扩增。
(F) 通过细胞质/核分离试验分析circ_ZNF512的亚细胞定位。GAPDH作为细胞质标记,U6作为核标记。
(G) 通过双荧光素酶报告基因检测验证circ_ZNF512与miR-181d-5p的结合。
(H) 通过RIP实验评估circ_ZNF512与miR-181d-5p的结合。
(I) 通过RNA下拉实验评估circ_ZNF512与miR-181d-5p的结合。
(J) 通过RT-qPCR检测I/R小鼠心肌组织和H/R诱导细胞中circ_ZNF512的表达。
(K) 通过RT-qPCR检测转染sh-circ_ZNF512的细胞中miR-181d-5p和EGR1的表达。*与假手术小鼠、对照组细胞或转染sh-NC的细胞或处理Bio-probe NC或IgG的细胞相比,p < 0.05。
实验独立进行了三次。
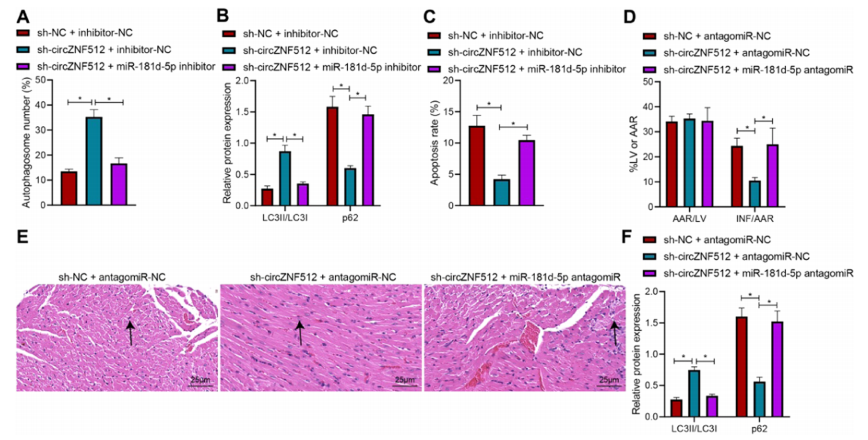
图7:circ_ZNF512与miR-181d-5p竞争性结合并上调EGR1的表达,促进细胞自噬并减轻心肌损伤
(A) 通过免疫荧光GFP-LC3实验检测转染sh-circ_ZNF512或与miR-181d-5p抑制剂联合处理的心肌细胞中自噬体的形成。
(B) 通过Western Blot分析检测转染sh-circ_ZNF512或与miR-181d-5p抑制剂联合处理的心肌细胞中LC3II/LC3I和p62的蛋白表达。
(C) 通过Hoechst 33258染色评估转染sh-circ_ZNF512或与miR-181d-5p抑制剂联合处理的心肌细胞的凋亡情况。
(D) 通过Evans Blue/TTC双重染色观察I/R小鼠心肌组织在处理sh-circ_ZNF512或与miR-181d-5p antagomiR联合处理后的梗死面积。
(E) 通过HE染色观察I/R小鼠心肌组织在处理sh-circ_ZNF512或与miR-181d-5p antagomiR联合处理后的病理变化。
(F) 通过Western Blot分析检测I/R小鼠心肌组织在处理sh-circ_ZNF512或与miR-181d-5p antagomiR联合处理后的LC3II/LC3I和p62的蛋白表达。*与转染sh-NC + inhibitor-NC或sh-circ_ZNF512 + inhibitor-NC的细胞相比,或与处理sh-NC + antagomiR-NC或sh-circ_ZNF512 + antagomiR-NC的I/R小鼠相比,p < 0.05。每组小鼠n=8。
实验独立进行了三次。
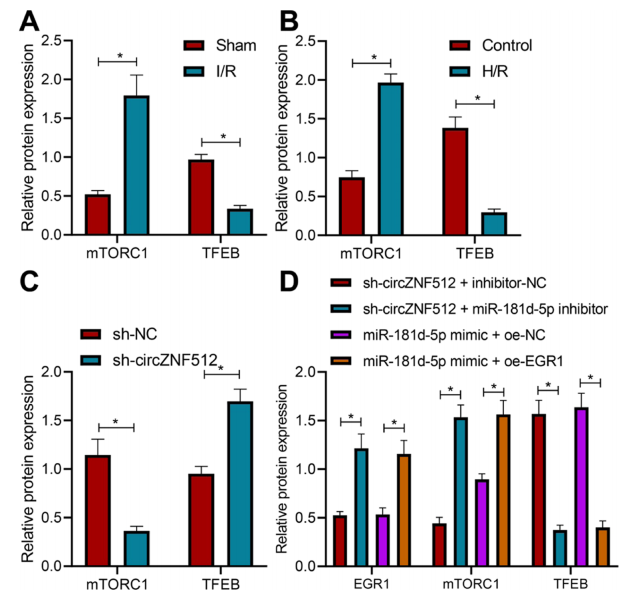
图8:circ_ZNF512/miR-181d-5p/EGR1交互作用激活心肌细胞中的mTORC1/TFEB信号通路
(A) 通过Western Blot分析确定I/R小鼠心肌组织中mTORC1和TFEB的表达。
(B) 通过Western Blot分析确定H/R诱导的心肌细胞中mTORC1和TFEB的表达。
(C) 通过Western Blot分析确定H/R诱导的心肌细胞在处理sh-circ_ZNF512后的mTORC1和TFEB的表达。
(D) 通过Western Blot分析确定H/R诱导的心肌细胞在处理sh-circ_ZNF512、sh-circ_ZNF512 + miR-181d-5p抑制剂、miR-181d-5p模拟物或miR-181d-5p模拟物 + oe-EGR1后的EGR1、mTORC1和TFEB的表达。*与假手术小鼠、对照组细胞、转染sh-NC的细胞、sh-circ_ZNF512 +抑制剂-NC或miR-181d-5p模拟物 + oe-NC的细胞相比,p < 0.05。
实验独立进行了三次。
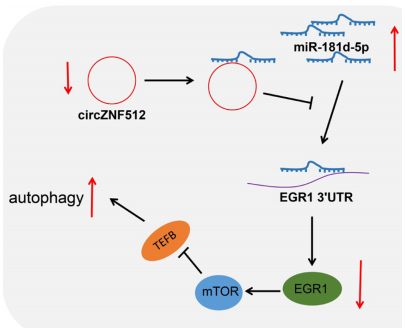
图9. 心肌I/R损伤中circ_ZNF512沉默保护作用的分子机制
circ_ZNF512的沉默减弱了其与miR-181d-5p的竞争性结合,从而下调了miR-181d-5p靶基因EGR1的表达。
circ_ZNF512的沉默激活了mTORC1/TFEB信号通路,从而促进了心肌细胞自噬。
通过促进心肌细胞自噬,circ_ZNF512的沉默预防了心肌I/R损伤。
● 当前研究表明,circ_ZNF512的沉默能够促进心肌细胞自噬并保护心脏免受I/R损伤。
● 这种保护作用可能与miR-181d-5p的上调、EGR1基因的下调以及mTORC1/TFEB信号通路的激活有关。
● circ_ZNF512/miR-181d-5p/EGR1/mTORC1/TFEB轴可能是心肌I/R损伤的未来治疗策略。
● 需要进一步研究mTORC1/TFEB信号通路在心肌细胞自噬和心肌I/R损伤中的作用,以验证研究的发现。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:新型GP-新抗原肿瘤疫苗在多种肿瘤模型中表现出强大抗肿瘤效果
下一篇:肾透明细胞癌中铜中毒相关MiR-21-5p/FDX1轴及其对肿瘤微环境的潜在影响