常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-02-07 17:15:28 细胞资源库平台 访问量:350
英文标题:A fish-scale derived multifunctional nanofiber membrane for infected wound healing
中文标题:用于感染伤口愈合的鱼鳞衍生多功能纳米纤维膜
发表期刊:《Biomaterials Science》
影响因子:6.6
作者单位:福建泉州师范学院化学与材料工程学院、华侨大学生物医学学院等
作者信息:Hailing Li,Zewen Kang,Enxue He et al.
皮肤由表皮、真皮和皮下组织组成,具有保护身体、维持体液平衡和调节体温的功能。皮肤的自我修复过程包括止血、炎症、血管生成、细胞增殖和迁移、肉芽组织生长以及再上皮化。创伤部位易受细菌、真菌等微生物感染,导致愈合延迟和全身性感染风险增加。感染性创伤在临床医学中是一个重大挑战,尤其在欧美国家,创伤是导致死亡的主要原因之一。糖尿病患者因血液循环和免疫功能问题,伤口愈合能力差,且缺乏有效的敷料或治疗技术。传统敷料无法有效预防感染或促进愈合,现有技术难以满足抗感染和促进愈合的双重需求。
未来研究方向包括开发多功能敷料、针对糖尿病患者的个性化治疗方案以及探索生物材料和干细胞技术。
鱼鳞、化学试剂(硝酸铜、硫代乙酰胺等)、细菌(E. coli、S. aureus)、聚合物(PVP、PVB)及ICR小鼠。
表征:通过UV-vis、TEM、FT-IR和Zetasizer分析其光学、形貌、化学结构和粒径分布。
将不同浓度FSC/CuS纳米颗粒溶液暴露于1080 nm近红外光下,记录温度变化。
通过最小杀菌浓度(MBC)和菌落计数法评估FSC/CuS纳米颗粒对E. coli和S. aureus的杀菌效果。
制备:将FSC/CuS纳米颗粒与PVP/PVB混合,静电纺丝制备纳米纤维。
表征:通过SEM、TEM、FT-IR和接触角仪分析其形貌、化学结构和亲水性。
透气性:测试水蒸气透过率(WVTR)。
细菌屏障:评估纳米纤维对细菌的屏障效果。
抗菌活性:测试纳米纤维对E. coli和S. aureus的抑制作用。
细胞毒性:使用CCK-8试剂检测FSC/CuS纳米纤维对L929细胞的毒性。
细胞迁移:通过划痕实验观察纳米纤维对细胞迁移的影响。
止血实验:评估FSC/CuS纳米纤维对小鼠尾部的止血效果。
伤口愈合:在小鼠背部制作感染性伤口模型,观察纳米纤维结合近红外光对伤口愈合的促进作用。
愈合机制:通过H&E染色、Masson染色和免疫组化分析组织病理学变化。
使用t检验或单因素方差分析对实验数据进行统计分析。
以上为研究方法的概括整理,涵盖了从材料制备到动物实验的关键步骤。
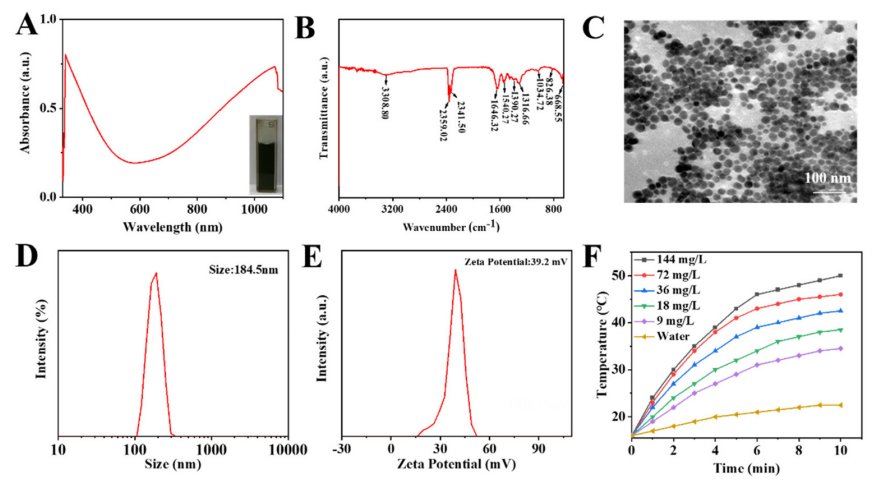
图1:FSC/CuS纳米颗粒的表征与光热性能
(A) UV–vis–NIR吸收光谱:展示了FSC/CuS纳米颗粒在紫外-可见-近红外范围内的吸收特性。
(B) FT-IR光谱:通过傅里叶变换红外光谱分析FSC/CuS纳米颗粒的化学结构。
(C) TEM图像:透射电子显微镜图像显示FSC/CuS纳米颗粒的形貌和尺寸。
(D) 水合粒径:测量FSC/CuS纳米颗粒在水溶液中的粒径分布。
(E) Zeta电位:测定FSC/CuS纳米颗粒的表面电位,反映其稳定性。
(F) 升温曲线:不同浓度的FSC/CuS纳米颗粒溶液在1080 nm近红外光照射下的温度变化曲线,评估其光热性能。
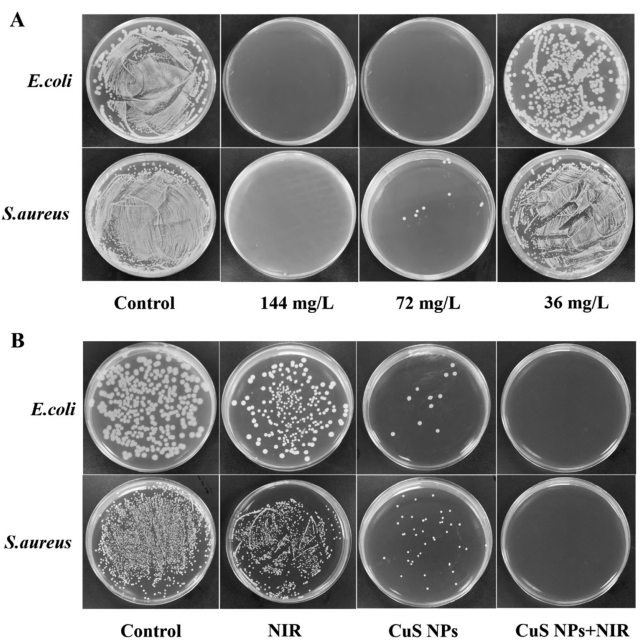
图2:FSC/CuS纳米颗粒的抗菌效果
(A) 最小杀菌浓度(MBC)测定:通过实验确定FSC/CuS纳米颗粒对大肠杆菌(E. coli)和金黄色葡萄球菌(S. aureus)的最小杀菌浓度。
(B) 细菌生长实验:展示不同处理条件下(如FSC/CuS纳米颗粒、近红外光照射等)对E. coli和S. aureus细菌生长的影响。
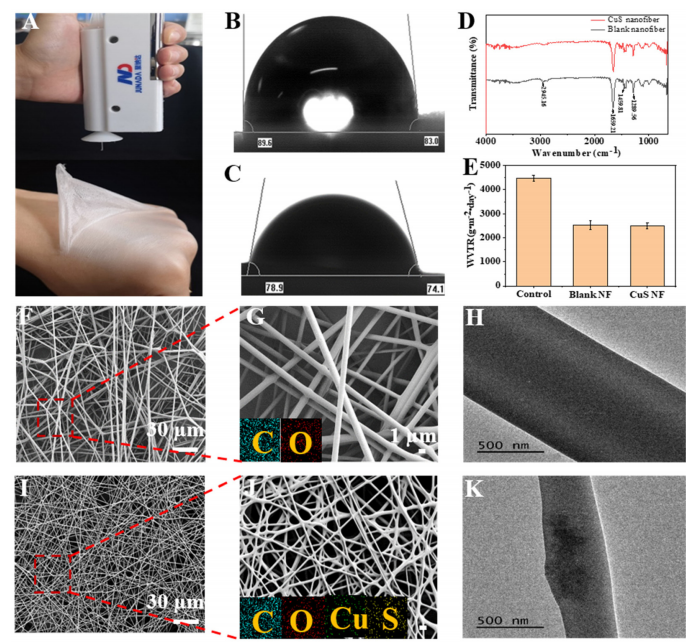
图3:空白纳米纤维与FSC/CuS纳米纤维的表征
(A) FSC/CuS纳米纤维形貌:展示FSC/CuS纳米纤维的整体形貌。
(B) 空白纳米纤维的水接触角:测量空白纳米纤维的亲水性。
(C) FSC/CuS纳米纤维的水接触角:测量FSC/CuS纳米纤维的亲水性。
(D) FT-IR光谱:通过傅里叶变换红外光谱分析空白纳米纤维和FSC/CuS纳米纤维的化学结构。
(E) 水蒸气透过率(WVTR):比较空白纳米纤维和FSC/CuS纳米纤维的水蒸气透过性能。
(F, G) 空白纳米纤维的SEM表征:通过扫描电子显微镜观察空白纳米纤维的表面形貌。
(I, J) FSC/CuS纳米纤维的SEM表征:通过扫描电子显微镜观察FSC/CuS纳米纤维的表面形貌(J图比例尺为1 µm),并展示EDS能谱分析的元素分布。
(H) 空白纳米纤维的TEM图像:通过透射电子显微镜观察空白纳米纤维的内部结构。
(K) FSC/CuS纳米纤维的TEM图像:通过透射电子显微镜观察FSC/CuS纳米纤维的内部结构。
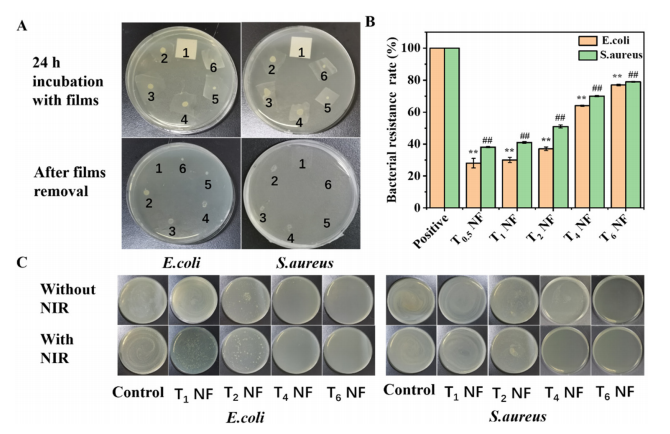
图4:FSC/CuS纳米纤维的抗感染性能
(A) 细菌生长实验:展示在移除0.22 µm微孔膜和FSC/CuS纳米纤维前后,细菌(E. coli和S. aureus)的生长情况。
(B) 细菌屏障率:FSC/CuS纳米纤维对E. coli和S. aureus的屏障效果,数据以均值±标准差表示,**p < 0.01表示与对照组E. coli的显著差异,##p < 0.01表示与对照组S. aureus的显著差异。
(C) 抗菌活性与光热性能:FSC/CuS纳米纤维及其光热性能对E. coli和S. aureus的抗菌效果(1为0.22 µm微孔膜,2、3、4、5、6和T0.5 NF、T1 NF、T2 NF、T4 NF、T6 NF分别表示静电纺丝0.5、1、2、4、6分钟制备的FSC/CuS纳米纤维)。
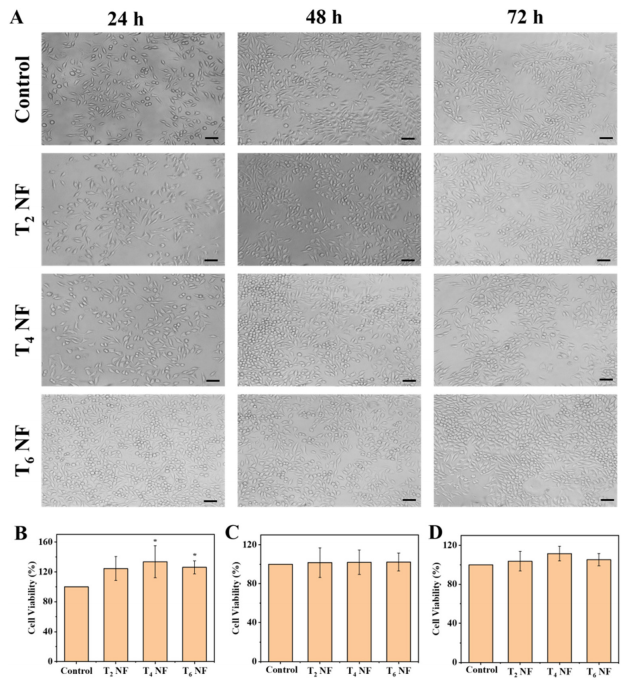
图5:细胞活力实验
(A) L929细胞形态:展示L929细胞在FSC/CuS纳米纤维浸提液中培养24、48、72小时后的形态变化(比例尺为50 µm)。
(B) 24小时细胞活力:L929细胞在FSC/CuS纳米纤维浸提液中培养24小时后的细胞活力,数据以均值±标准差表示,*p < 0.05表示与对照组的显著差异。
(C) 48小时细胞活力:L929细胞在FSC/CuS纳米纤维浸提液中培养48小时后的细胞活力,数据以均值±标准差表示,*p < 0.05表示与对照组的显著差异。
(D) 72小时细胞活力:L929细胞在FSC/CuS纳米纤维浸提液中培养72小时后的细胞活力,数据以均值±标准差表示,*p < 0.05表示与对照组的显著差异。
注:T2 NF、T4 NF、T6 NF分别表示静电纺丝2、4、6分钟制备的FSC/CuS纳米纤维。
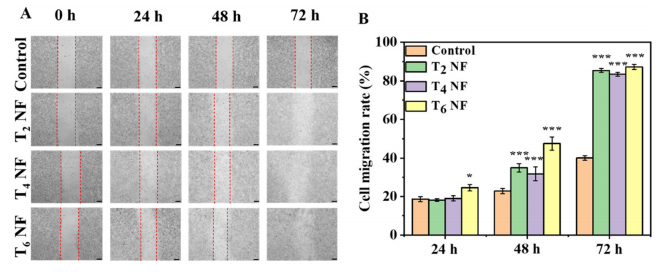
图6:细胞划痕实验
(A) 细胞划痕照片:展示用不同时间静电纺丝制备的FSC/CuS纳米纤维浸提液处理后,L929细胞划痕的愈合情况(比例尺为50 µm)。
(B) 细胞划痕闭合率:不同时间静电纺丝制备的FSC/CuS纳米纤维浸提液处理后,L929细胞划痕的闭合率(n = 5),数据以均值±标准差表示,*p < 0.05、***p < 0.001表示与对照组的显著差异。
注:T2 NF、T4 NF、T6 NF分别表示静电纺丝2、4、6分钟制备的FSC/CuS纳米纤维。
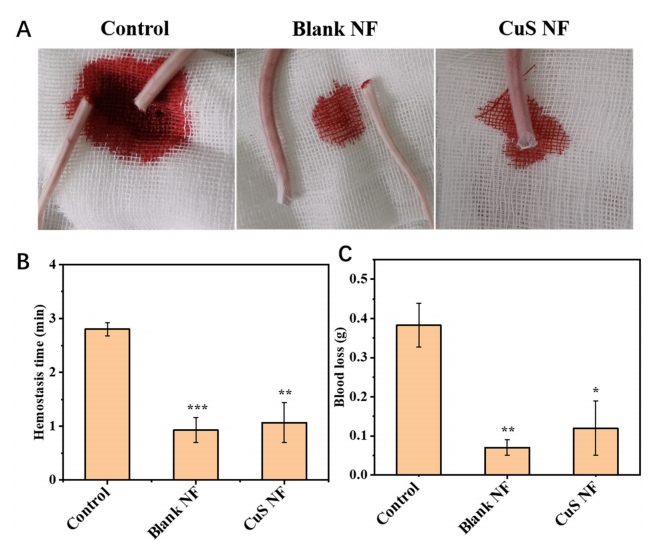
图7:止血实验
(A) 小鼠尾部止血照片:展示不同处理组(对照组、空白纳米纤维组、FSC/CuS纳米纤维组)小鼠尾部断裂后的止血情况。
(B) 止血时间:各组小鼠的止血时间,数据以均值±标准差表示,*p < 0.05、**p < 0.01、***p < 0.001表示与对照组的显著差异。
(C) 失血量:各组小鼠的失血量,数据以均值±标准差表示,*p < 0.05、**p < 0.01、***p < 0.001表示与对照组的显著差异。
注:Blank NF表示空白纳米纤维,CuS NF表示原位静电纺丝制备的FSC/CuS纳米纤维。
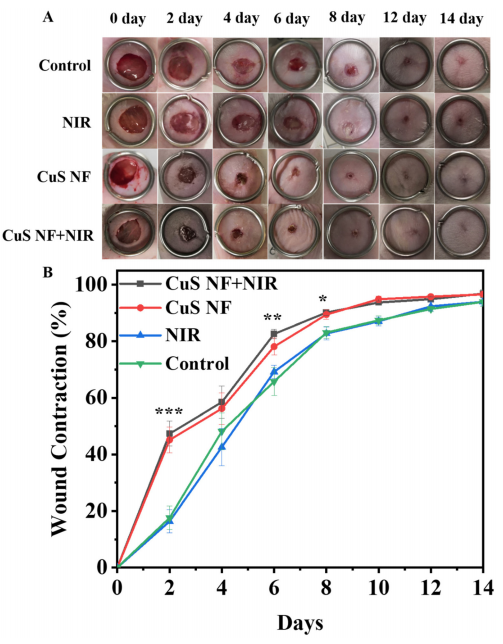
图8:感染性伤口愈合的体内评估
(A) 不同治疗方法在第0、2、4、6、8、10、12和14天处理感染伤口的照片;
(B) 小鼠感染伤口的愈合率(n = 6)。数值为平均值±标准差。*p < 0.05,**p < 0.01,***p < 0.001,与对照组相比。
CuS NF 表示通过静电纺丝4分钟原位制备的FSC/CuS纳米纤维。
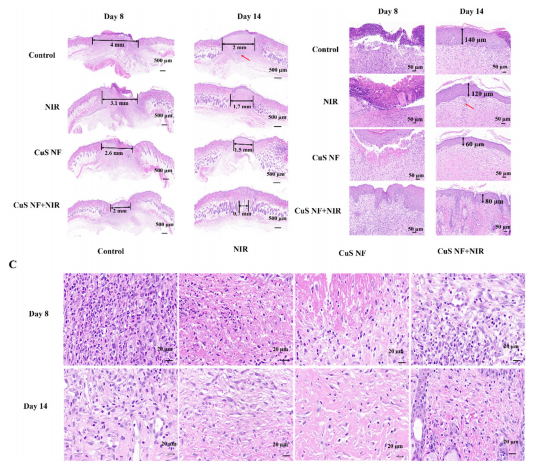
图9:感染性伤口愈合的组织学评估
(A) 各组在第8天和第14天的H&E染色(比例尺 = 500 µm,黑色箭头表示愈合程度);
(B) H&E染色放大图显示表皮愈合(比例尺 = 50 µm,黑色箭头表示表皮厚度,红色箭头表示瘢痕组织);
(C) 肉芽组织的放大图(比例尺 = 20 µm)。
CuS NF 表示原位沉积4分钟的FSC/CuS纳米纤维。
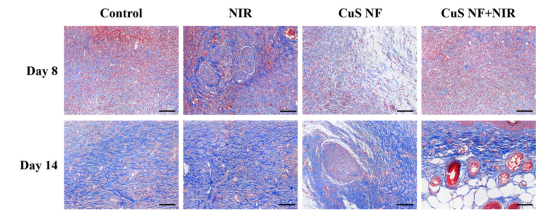
图10:各组小鼠感染伤口组织在第8天和第14天的Masson染色结果(n = 3)
CuS NF 表示原位沉积4分钟的FSC/CuS纳米纤维,蓝色部分为胶原纤维,比例尺 = 100 µm。
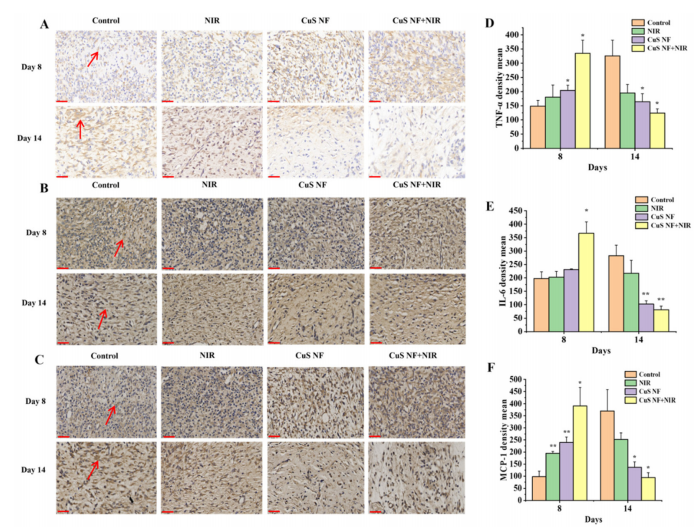
图11:感染伤口组织中炎症相关因子的表达
(A) 各组在第8天和第14天伤口肉芽组织中TNF-α的免疫组化染色结果。比例尺 = 50 µm。
(B) 各组在第8天和第14天伤口肉芽组织中IL-6的免疫组化染色结果。比例尺 = 50 µm。
(C) 各组在第8天和第14天伤口肉芽组织中MCP-1的免疫组化染色结果。比例尺 = 50 µm。
(D) 各组在第8天和第14天形成肉芽组织中心的伤口边缘TNF-α表达的定量分析(n = 3)。
(E) 各组在第8天和第14天形成肉芽组织中心的伤口边缘IL-6表达的定量分析(n = 3)。
(F) 各组在第8天和第14天形成肉芽组织中心的伤口边缘MCP-1表达的定量分析(n = 3)。
数据以平均值±标准差表示;*p < 0.05,**p < 0.01,与对照组相比。红色箭头指示的棕色区域表示相应细胞因子的阳性表达。
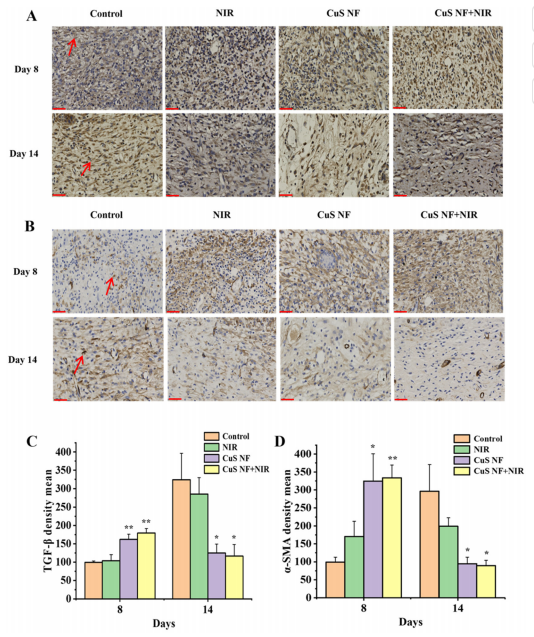
图12:感染伤口组织中TGF-β通路相关因子的表达
(A) 各组在第8天和第14天伤口肉芽组织中TGF-β的免疫组化染色结果。比例尺 = 50 µm。
(B) 各组在第8天和第14天伤口肉芽组织中α-SMA的免疫组化染色结果。比例尺 = 50 µm。
(C) 各组在第8天和第14天形成肉芽组织中心的伤口边缘TGF-β表达的定量分析(n = 3)。
(D) 各组在第8天和第14天形成肉芽组织中心的伤口边缘α-SMA表达的定量分析(n = 3)。
数据以平均值±标准差表示;*p < 0.05,**p < 0.01,与对照组相比。红色箭头指示的棕色区域表示相应细胞因子的阳性表达。
开发了一种负载FSC/CuS纳米颗粒的抗菌纳米纤维,具有优异的润湿性、透气性、抗感染性、光热性能、生物相容性和促进细胞迁移的能力。
在体外实验中,该纳米纤维在细胞水平上加速划痕愈合,并在约1分钟内实现有效止血。
在小鼠全层感染伤口模型中,FSC/CuS纳米纤维通过原位静电纺丝制备,其光热效应促进伤口愈合并提高愈合质量。
通过组织学评估发现,原位沉积的FSC/CuS纳米纤维结合近红外光能够限制炎症反应,加速组织愈合速度,并缩短伤口修复时间。
该策略在临床应用中具有巨大潜力,可用于有效治疗感染伤口并预防感染伤口的形成。
研究存在局限性,例如未与已知的感染伤口治疗药物进行比较。
未来计划跟进与已知药物的比较研究,进一步完善该策略的应用价值。
总结:FSC/CuS纳米颗粒与聚合物纳米纤维的结合使用可显著加速感染伤口的愈合,具有重要的临床应用前景。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:生物发光和PET分子成像揭示病毒溶瘤动力学和肿瘤活性
下一篇:新型GP-新抗原肿瘤疫苗在多种肿瘤模型中表现出强大抗肿瘤效果