常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2024-06-07 15:35:47 细胞资源库平台 访问量:279
今天推荐的是华南理工大学医学院《纳米粒子介导的CXCL12/CXCR4信号阻断增强胶质母细胞瘤的免疫治疗:用MRI影像组学监测早期反应》,影响因子:9.7。
英文标题:Nanoparticle-mediated blockade of CXCL12/CXCR4 signaling enhances
glioblastoma immunotherapy: Monitoring early responses with MRI radiomics
中文标题:纳米粒子介导的CXCL12/CXCR4信号阻断增强胶质母细胞瘤的免疫治疗:用MRI影像组学监测早期反应
发表期刊:《Acta Biomaterialia》
影响因子:9.7
作者单位:华南理工大学医学院、广东食品药品职业学院医疗器械学院等
作者信息:Ruili Wei, Jiamin Li, Wanxian Lin, Xinrui Pang, Huikang Yang et al。
胶质母细胞瘤(GBM)是一种难以治疗且致命的脑肿瘤,至今尚未从新兴的免疫治疗中受益。针对CXCL12/CXCR4信号通路的治疗策略被认为是缓解免疫抑制的一个有前景的方法。本研究开发了一种iRGD配体修饰的聚合物纳米平台,用于共输送CXCR4拮抗剂AMD3100和小分子免疫检查点抑制剂BMS-1。
研究者开发了iRGD配体修饰的聚合物纳米粒子,用于共输送AMD3100和BMS-1。通过体外和体内实验评估了这种纳米平台的血脑屏障穿透能力和肿瘤靶向能力。在携带原位GL261-Luc肿瘤的小鼠模型中,研究了AMD3100和BMS-1的共给药对肿瘤增殖的抑制作用及其对免疫抑制微环境的重编程效应。此外,研究还探讨了MRI放射组学在监测免疫治疗后肿瘤免疫微环境早期变化的能力。
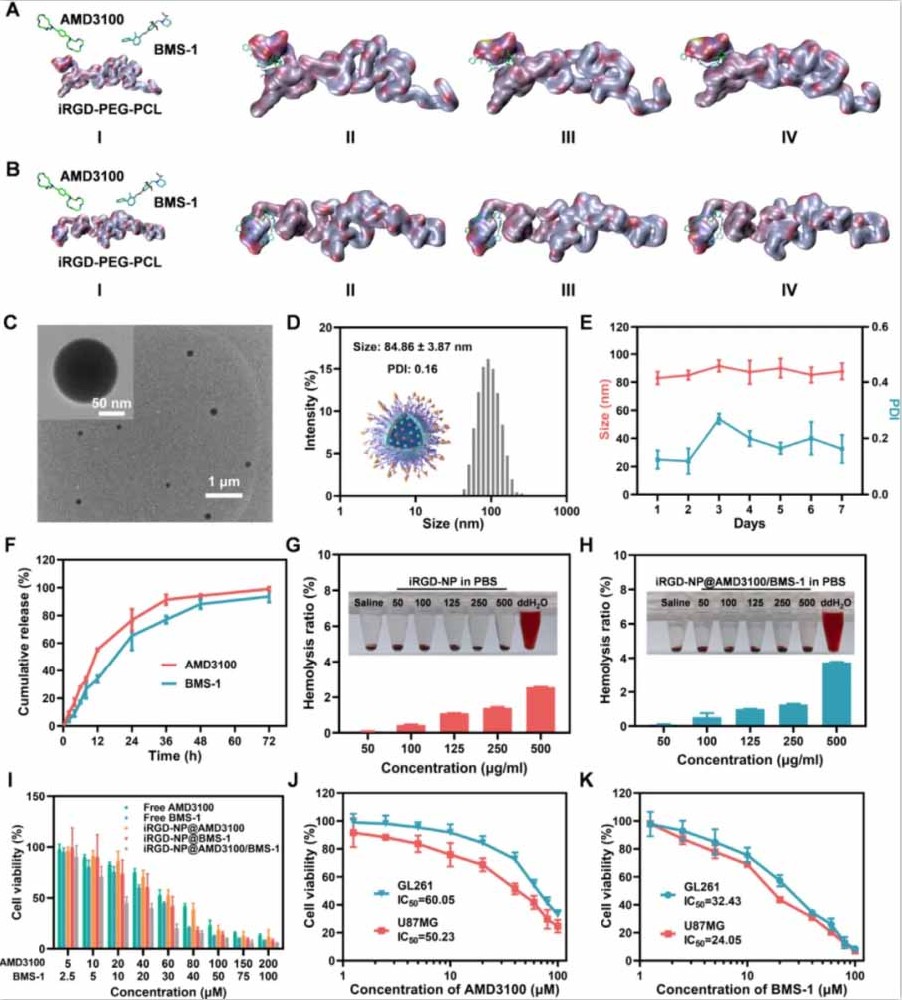
图1:iRGD-NP@AMD3100/BMS-1的制备与特性
(A)iRGD-PEG-PCL、AMD3100和BMS-1在水相(pH 7.0)和肿瘤模拟环境(pH 6.5)中的相互作用。
(B)AMD3100和BMS-1在体内的作用机制,通过抑制生存相关的PI3K/Akt/mTOR和MAPK通路来抑制肿瘤生长和侵袭,并通过促进M2向M1亚型的巨噬细胞极化以及减轻MDSCs和Tregs的浸润来重塑抑制性的肿瘤微环境,从而增加CD8+T淋巴细胞的比例。
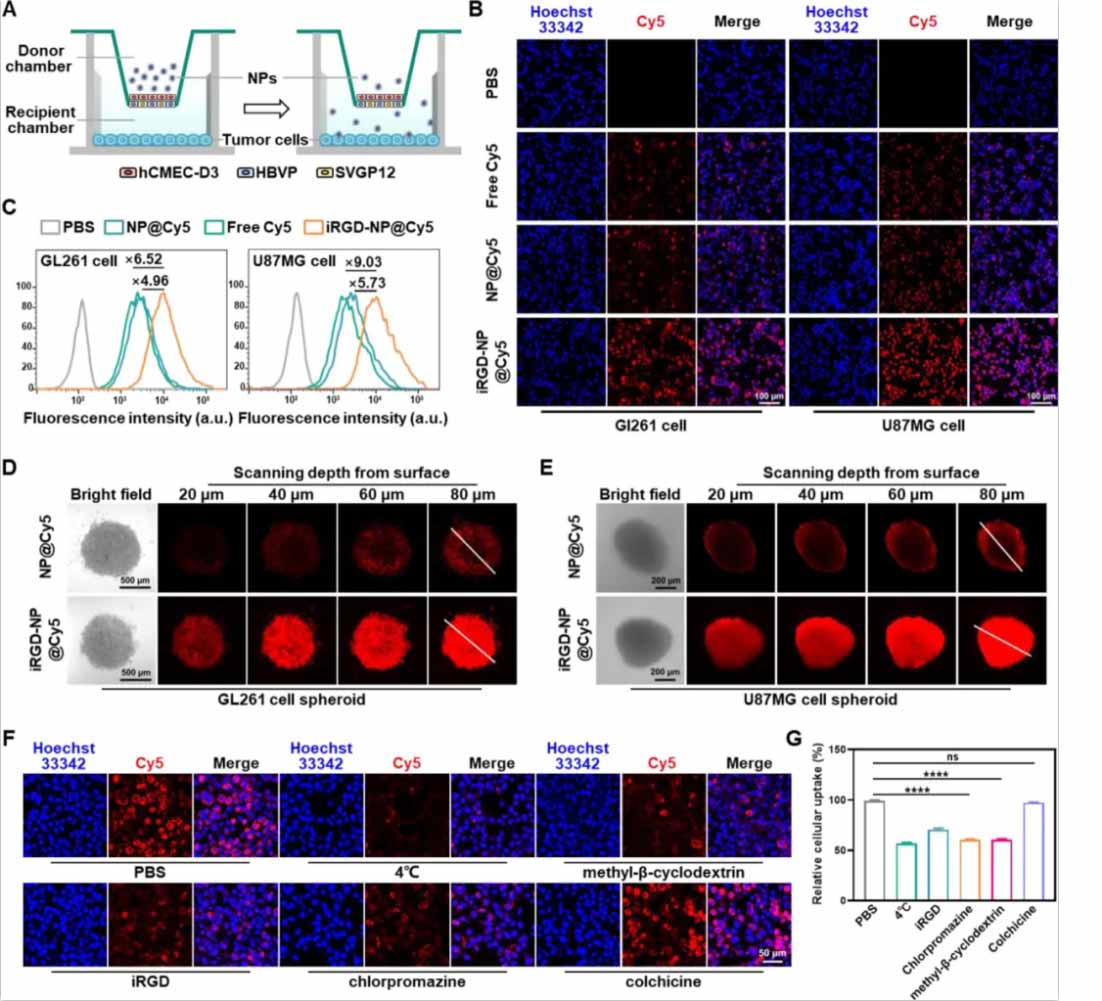
图2:iRGD-NP@AMD3100/BMS-1在体外的BBB穿越能力和细胞摄取
(A)体外三重模型用于研究纳米颗粒的BBB穿越能力。
(B)GL261和U87MG细胞中iRGD-NP@Cy5的积累,通过CLSM观察。
(C)Cy5标记的iRGD-NP@AMD3100/BMS-1的细胞摄取量。
(D)GL261和U87MG球体中Cy5标记的iRGD-NP@AMD3100/BMS-1的渗透能力。
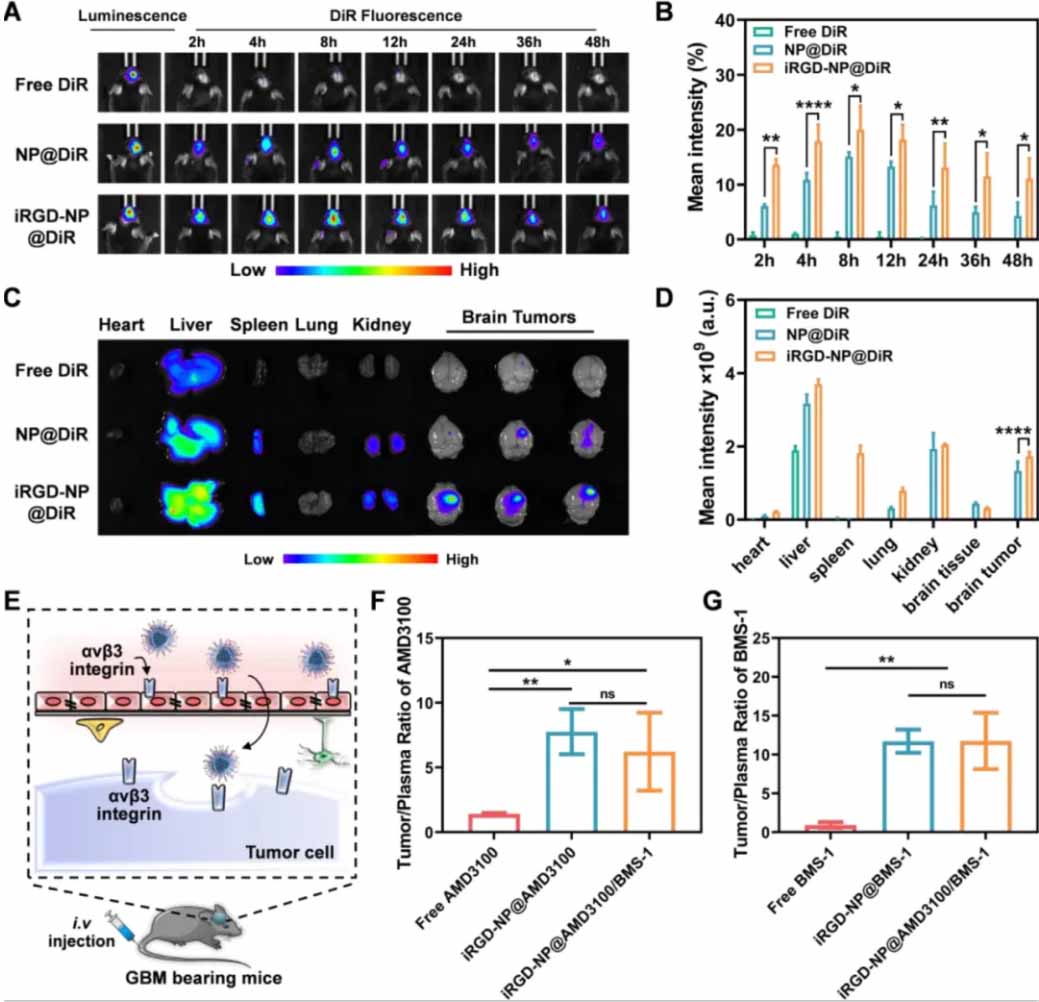
图3:iRGD-NP@AMD3100/BMS-1在体内的靶向大脑交付
(A)使用DiR负载的iRGD-NP@DiR、NP@DiR和自由DiR处理后的GL261-Luc orthotopic小鼠的体内成像和定量结果。
(B)处理后切除的组织包括大脑组织的体外成像和定量结果。
(C)iRGD介导的BBB穿越和肿瘤靶向的示意图。
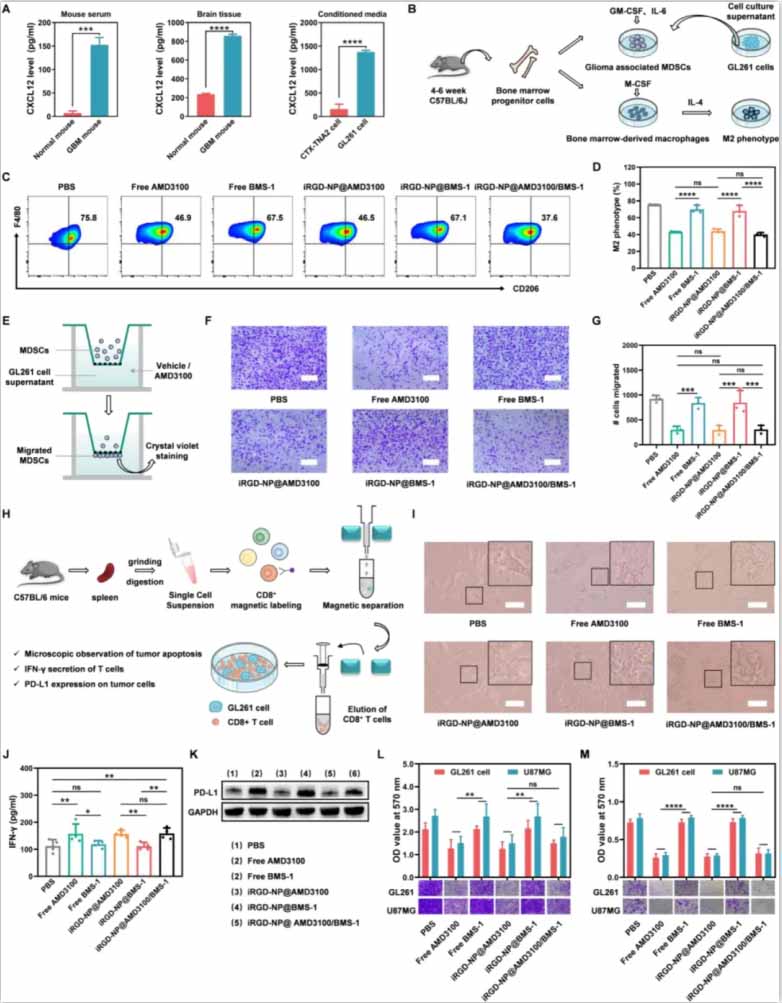
图4:iRGD-NP@AMD3100/BMS-1在体外的免疫调节效应。
(A)小鼠血清中CXCL12水平的定量ELISA。
(B)体外生成M2表型巨噬细胞和GL261胶质瘤相关MDSCs的示意图。
(C)不同处理后巨噬细胞的极化状态的流式细胞术和定量分析。
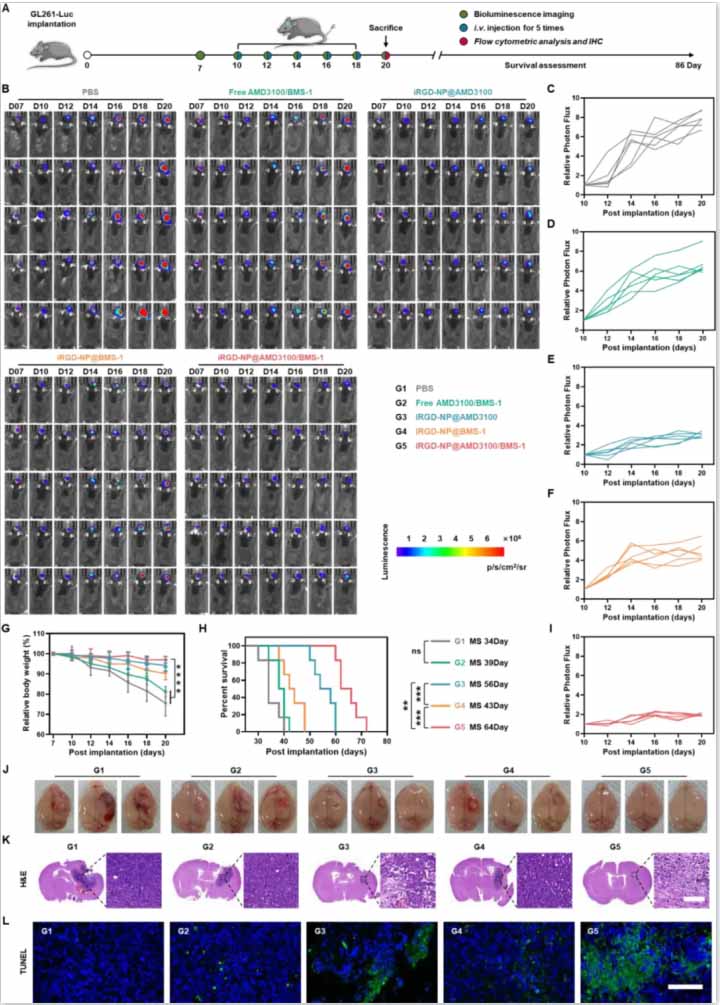
图5:iRGD-NP@AMD3100/BMS-1在GL261-Luc GBM异种移植物小鼠中的协同抗肿瘤效应。
(A)抗肿瘤治疗时间表。
(B)GL261-Luc异种移植物小鼠的肿瘤负担,通过生物发光成像确定。
(C)自由AMD3100/BMS-1、iRGD-NP@AMD3100、iRGD-NP@BMS-1和iRGD-NP@AMD3100/BMS-1处理后的相对肿瘤负担。
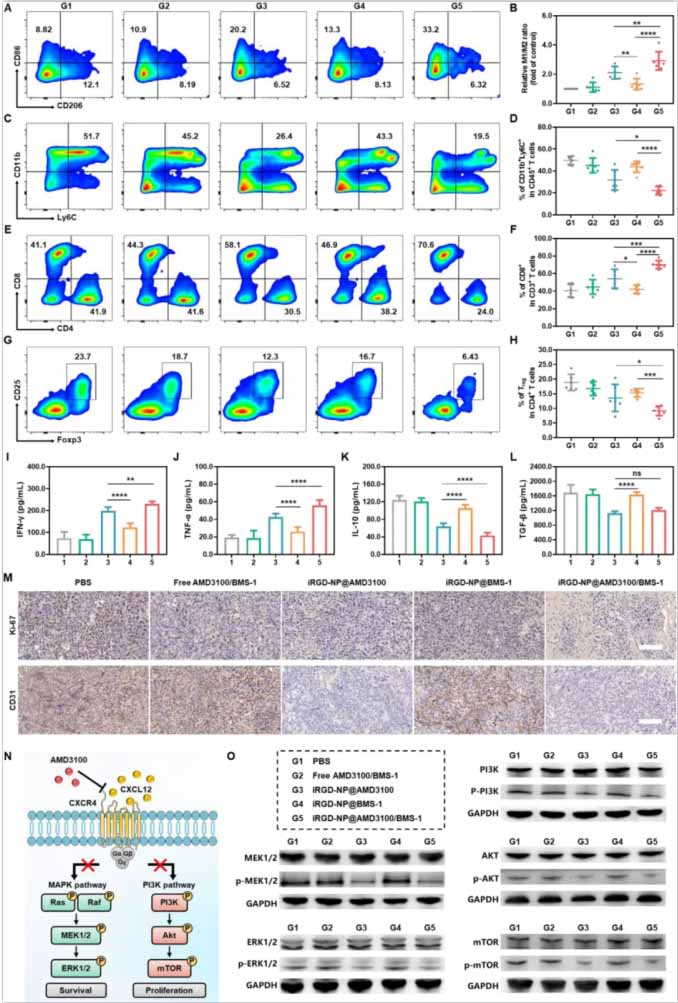
图6:各种处理后肿瘤免疫微环境的变化。
(A)肿瘤组织中M1样表型(CD86+细胞在CD45+CD11b+F4/80+细胞中)和M2样表型巨噬细胞百分比的代表性流式细胞术图像。
(B)肿瘤组织中相对M1/M2比值(对照组的倍数)的定量统计分析。
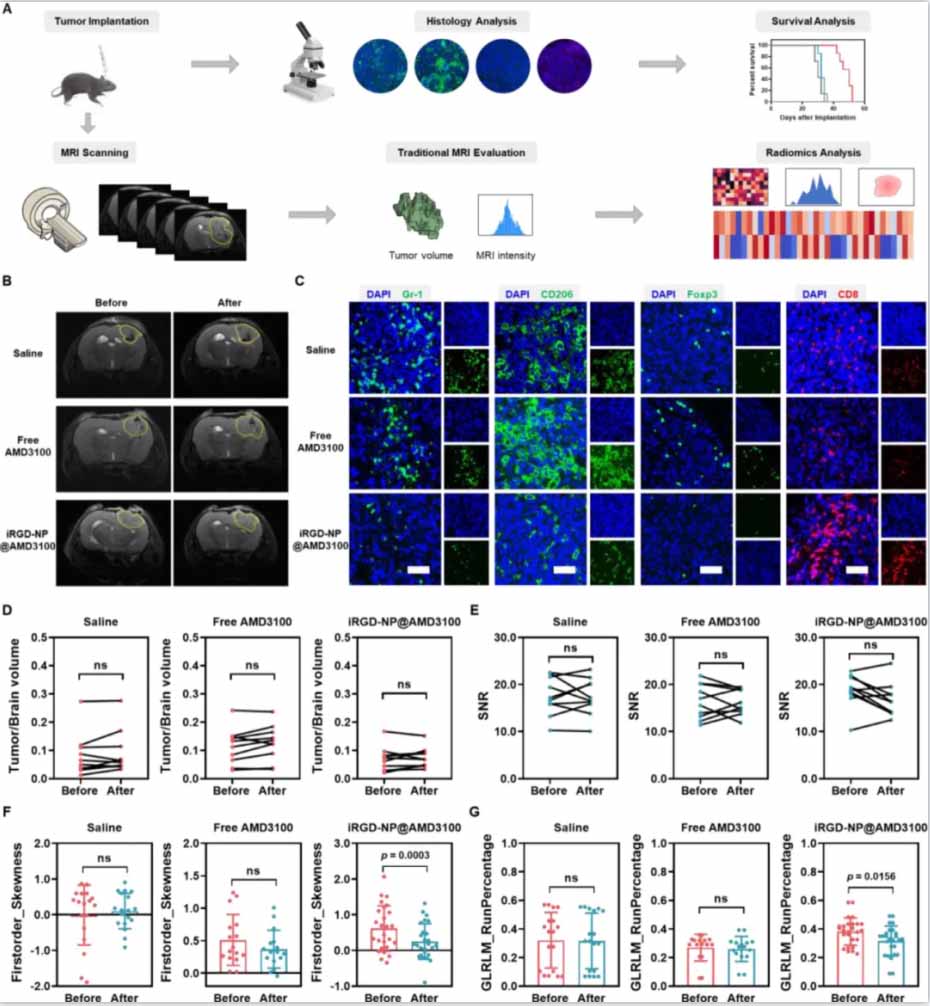
图7:基于MRI的放射组学特征与CXCL12/CXCR4信号阻断介导的免疫抑制微环境早期变化的相关性。
(A) orthotopic GBM小鼠模型中预测CXCR4靶向治疗反应的MRI放射组学的流程图。
(B)治疗前后的T2加权成像。
(C)治疗后的免疫荧光检查,包括Gr-1、CD206、Foxp3和CD8的染色。
(D)治疗前后的肿瘤体积。
(E)治疗前后的肿瘤信噪比。
(F)治疗前后的Firstorder_Skewness特征分析。
(G)治疗前后的GLRLM_RunPercentage特征分析。
研究结果显示,iRGD修饰的纳米粒子在体外和体内都表现出优越的血脑屏障穿透和肿瘤靶向能力。在小鼠模型中,AMD3100和BMS-1的共给药显著抑制了肿瘤增殖且没有不良影响。CXCL12/CXCR4信号通路的阻断导致了免疫抑制微环境的重编程,特征是减少肿瘤相关髓样细胞(TAMCs)和调节性T细胞,增加CD8+ T淋巴细胞的比例。激活的免疫细胞分泌的干扰素-γ(IFN-γ)上调了肿瘤细胞中PD-L1的表达,强调了BMS-1在对抗PD-1/PD-L1途径中的协同作用。研究还揭示了MRI放射组学在揭示免疫治疗后肿瘤免疫微环境早期变化的能力,为监测治疗反应提供了强有力的工具。
该研究强调了双重阻断CXCL12/CXCR4和PD-1/PD-L1途径作为最大化GBM治疗效果的补充策略的潜力。此外,研究揭示了MRI放射组学提供了一种临床上可转化的评估免疫治疗效果的手段。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
下一篇:钠盐p-全氟壬氧基苯磺酸通过直接靶向催化酶在HepG2细胞中诱导ROS介导的坏死