常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2023-10-31 14:34:25 细胞资源库平台 访问量:579
今天推荐的是由澳大利亚维多利亚州帕克维尔墨尔本大学医学生物学系在2018年5月15日发表的一篇文章,通讯作者是Eicke Latz教授,研究主要阐述了小鼠骨髓来源巨噬细胞的永生化。
巨噬细胞是一种特化的吞噬细胞,对宿主免疫系统具有多种重要功能。它们对识别外源性和内源性危险信号尤为重要,是先天性免疫反应的防御前线。因此,小鼠巨噬细胞常用于基于体外细胞的试验,以研究先天性免疫激活的机制,这需要不断培育和饲养大量转基因小鼠品系。
在这里,研究人员介绍了一种从原代小鼠骨髓细胞中生成永生化骨髓源性巨噬细胞(iBMDMs)的稳健方案。研究人员还提供了收获、冷冻和解冻骨髓细胞、维持iBMDMs培养以及通过单细胞克隆生成单克隆iBMDMs群体的一般方案。
1. 巨噬细胞在免疫反应中发挥着多种关键作用
这些功能包括吞噬微生物、宿主衍生物质、细胞碎片和凋亡细胞以进行消化;通过模式识别受体(PRR)识别危险信号;向适应性免疫细胞展示抗原;最重要的可能是产生对宿主免疫反应和修复局部组织损伤至关重要的炎症介质(图1)。巨噬细胞和其他免疫细胞表达的PRRs家族识别危险信号,如微生物成分或修饰过的宿主分子,构成了先天性免疫系统的基础。PRRs通常根据其在细胞质膜和溶酶体内膜或细胞膜内的定位进行分类。Toll样受体(TLRs)和C型凝集素受体(CLRs)存在于细胞膜上,而视黄酸诱导基因I(RIG-I)样受体(RLRs)、核苷酸结合寡聚结构域(NOD)样受体(NLRs)和几种细胞膜DNA受体(CDRs)则表达于细胞膜上(图1)。大多数PRRs的激活会导致细胞因子(如TNF、IL-6)、趋化因子和I型干扰素(IFNs)的转录和产生。一些PRRs形成大型寡聚信号平台,称为炎性体。炎性体的激活不是引发转录反应,而是导致细胞因子IL-1家族成员(如IL-1和IL-18)被caspase-1蛋白质分解和成熟,并启动炎症形式的程序性细胞死亡,即所谓的"热噬"。形成炎症体的PRRs包括一些NLRs(如NLRP1、NLRP3、NLRC4)以及PYRIN和黑色素瘤缺失2(AIM2)。先天性免疫途径下游炎症介质的最终分泌动员了宿主免疫细胞大军的招募,并促进了急性炎症反应。
先天性免疫系统十分复杂,涉及大量蛋白质。因此,对先天性免疫激活机制的研究往往在很大程度上依赖于获得各种转基因小鼠。体外研究通常使用这些小鼠品系产生的巨噬细胞。由于动物饲养和繁殖的持续成本和空间要求很高,这种对众多小鼠品系的依赖会严重影响研究人员在该领域的工作。另一种替代方法是使用Cre-J2逆转录病毒感染法对特定小鼠品系的巨噬细胞群进行永生化。永生化的小鼠巨噬细胞在表型上与原代巨噬细胞相似,具有巨噬细胞的许多标志性功能。Cre-J2逆转录病毒感染永生化方法已被证明可有效作用于多种小鼠巨噬细胞群,包括骨髓衍生巨噬细胞、胎肝巨噬细胞、脾脏巨噬细胞和小胶质细胞。这种永生化方法的基础是用J2重组逆转录病毒感染细胞,该病毒来源于复制缺陷的3611-Moloney肉瘤病毒(MSV),携带v-raf和v-myc癌基因。由于没有编码必要的病毒包装蛋白(gag-pol、env),J2病毒本身存在复制缺陷。因此,研究人员使用病毒包装辅助细胞系Psi-Cre-J2(以NIH3T3成纤维细胞为背景)来生产重组Cre-J2逆转录病毒。该细胞系表达两个突变的莫隆尼鼠白血病病毒衍生的前病毒基因组,在gag-pol或env区域携带互补突变。每个基因组都删除了Psi序列,从而防止在复制过程中将逆转录病毒RNA基因组大量包装到病毒外壳中。因此,这种设计能够生产Cre-J2逆转录病毒,而不会产生辅助病毒,这是一个重要的安全特性。研究人员和其他许多人已经有效地利用Cre-J2方法使大量转基因小鼠的巨噬细胞永生,这有助于研究与先天性免疫领域相关的许多机制,例如检查细胞因子和IFN的转录控制,以及研究炎性体和TLR生物学。这些细胞还非常适合通过逆转录或慢病毒转导系统引入修饰蛋白来生成报告细胞系。
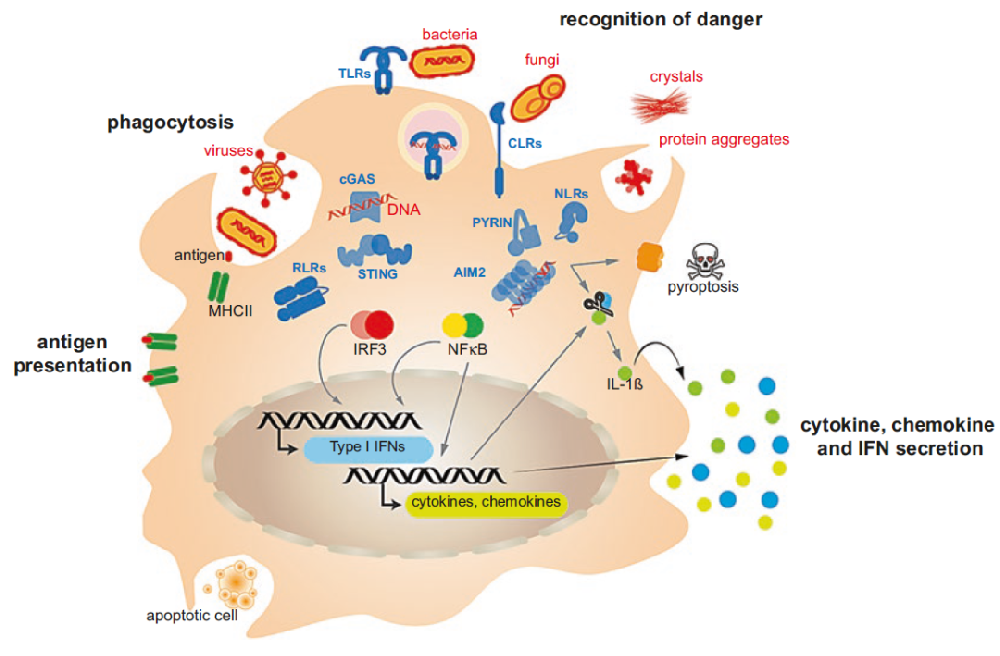
图1. 巨噬细胞在免疫反应中发挥着多种关键作用
研究结论:巨噬细胞是一种吞噬性白细胞,遍布于人体的大多数组织中,在免疫反应中发挥着关键作用,对宿主的生理和病理炎症反应具有重要功能。
2. Cre-J2永生化病毒的生产和收获,用于生成单克隆iBMDM群体的单细胞克隆
在本章中,研究人员介绍了小鼠骨髓源性巨噬细胞(BMDMs)永生化的综合方法。这包括具体的方案,如Cre-J2永生化病毒的生产和收获(见图2)、骨髓(BM)细胞到BMDMs的收获和分化、用Cre-J2感染BM细胞,以及选择iBMDMs的长期培养方法(见图3)。此外,研究人员还提供了一些有助于开展这项工作的通用方法,包括冷冻和解冻原代BM细胞、iBMDMs的一般培养以及用于生成单克隆iBMDM群体的单细胞克隆(见图3),这些方法可用于下游应用,如筛选方法。
以下方案需要生成 Cre-J2 逆转录病毒。尽管 Cre-J2 是一种生态型(小鼠特异性)逆转录病毒,但在生产和处理过程中仍需谨慎。在使用生物危险材料和生成转基因生物时,请始终遵循您所在机构的指导原则,并确认所需的生物安全级别(或当地同等级别),同时始终穿戴适当的个人防护设备 (PPE)。
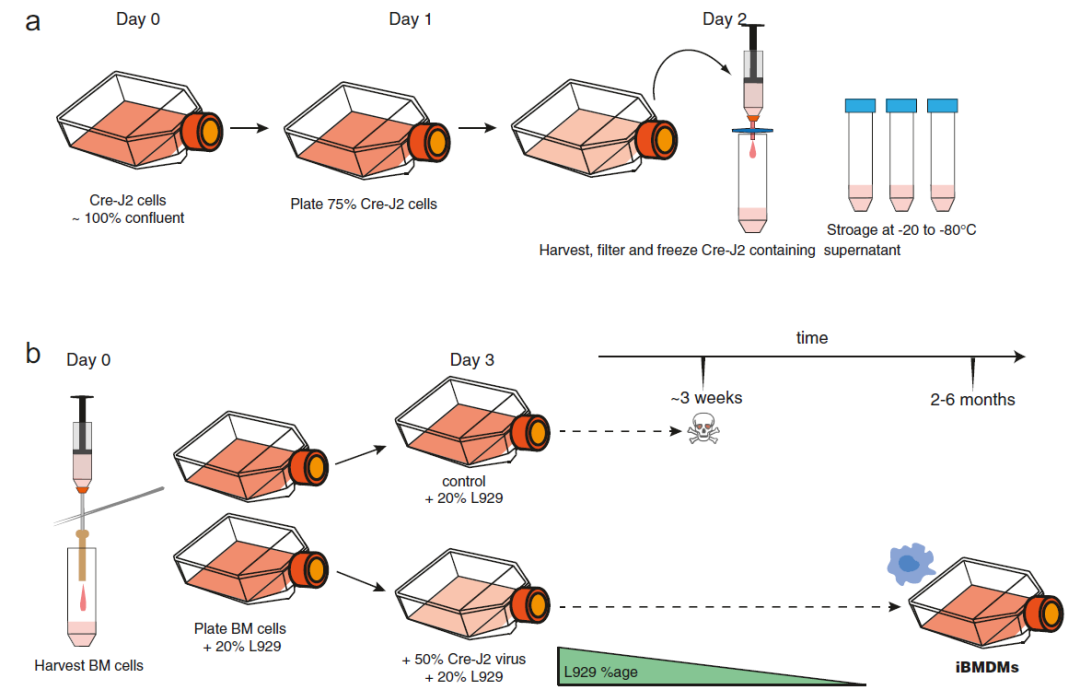
图2. 小鼠巨噬细胞的永生化
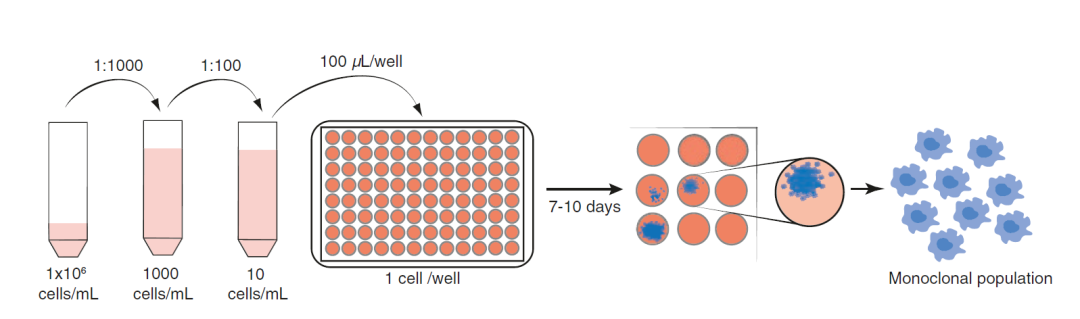
图3. 通过单细胞克隆生成单克隆iBMDM细胞
研究结论:介绍了小鼠骨髓源性巨噬细胞(BMDMs)永生化的综合方法。
1)生产含 Cre-J2 逆转录病毒的上清液
1. 在 37 °C、5% CO2 的加湿培养箱中,用 T150 cm2 的 TC 烧瓶,在完全 DMEM 中培养 Cre-J2 病毒生产细胞,直到细胞达到 ~100% 的融合度。
2. 吸出细胞中的全 DMEM,用 10 mL 无菌 PBS 轻轻清洗,收获 Cre-J2 病毒产生的细胞。
3. 在加入 5 mL 胰蛋白酶-EDTA 之前吸干 PBS,然后在 37 °C 下孵育细胞 5 分钟。
4. 4. 经胰蛋白酶-EDTA 处理后,用 15 mL 完全 DMEM 将 Cre-J2 病毒产生的细胞收集到 50 mL 试管中,最终细胞体积为 20 mL。
5. 5. 在新的 T150 cm2 TC 烧瓶中加入 15 mL(75%)收获的 Cre-J2 病毒产生细胞和 5 mL 新鲜的全 DMEM,最后得到 20 mL 细胞体积。
6. 将装有 Cre-J2 病毒产生细胞的 T150 cm2 TC 烧瓶置于 37 °C、5% CO2 的加湿培养箱中培养。
7. 24 小时后,可收获含有 Cre-J2 逆转录病毒的上清液。
8. 用 25 mL 血清学移液管从 Cre-J2 细胞中收集细胞上清,并加入 50 mL 无菌试管中。
9. 取一个 50 毫升鲁尔锁无菌注射器,取下活塞,将其放在一边。
10. 将 0.45 μm 过滤器连接到注射器管端。
11. 将装有 0.45 μm 过滤器的注射器放在新的 50 mL 无菌试管上。
12. 非常小心地将 Cre-J2 细胞的上清液倾入针筒,然后重新插入活塞。
13. 通过 0.45 μm 过滤器将病毒过滤到 50 mL 锥形管中。
14. 以一次性使用的形式分取病毒,并冷冻在 80 °C。
2) 收获小鼠骨髓细胞
1. 开始之前,将手术镊子和剪刀放入装有约 35 毫升 70-80% 乙醇的 50 毫升试管中,并为每只小鼠准备一个装有 5 毫升 PBS 的 10 平方厘米培养皿。
2. 按照动物伦理指导原则对小鼠实施安乐死。
3. 用 70-80% 乙醇浸湿小鼠皮毛。
4. 用镊子夹起腹膜上方的皮肤,然后用剪刀做一个小切口。
5. 5. 从切口处开始剥离后腿上的皮肤,并向下剥至脚部。
6. 用剪刀在髋关节上方切除后腿,保留股骨。
7. 用剪刀从踝关节下方切除脚,保持胫骨完整。
8. 将股骨和胫骨放入之前准备好的装有 PBS 的 10 平方厘米培养皿中。
9. 在无菌条件下,在层流净化罩中继续进行操作。
10. 用剪刀和镊子尽可能多地去除骨骼周围的组织,使骨骼保持完整。
11. 每次用纸巾夹住一根骨头,用拇指和食指轻轻滚动,去除残留组织。这样做之后,骨头上应该就几乎没有组织了。
12. 在 10 平方厘米培养皿的盖子上注入 70-80% 的乙醇。
13. 将骨头放入 70-80% 的乙醇中约 30 秒,然后将骨头放回 PBS 中。
14. 用剪刀从四根骨头的两端各剪下少量。
15. 在连接 10 毫升注射器的 25-G 注射针中注入无血清 DMEM,然后将针头插入骨的骨髓腔。
16. 用无血清 DMEM 冲洗每个骨腔,将其装入 50 mL 试管中,直到骨头大部分呈白色。从另一端再次冲洗骨髓腔可获得更多细胞。
17. 重复上述步骤 15,将一只小鼠的所有骨骼放入同一 50 mL 试管中。
18. 在 RT 下以 ~500 × g 离心细胞 5 分钟,然后吸出培养基。
19. 此时可将 BM 细胞冷冻,以便日后使用或运输。
20. 20. 用 1-2 mL RBC 裂解缓冲液重悬细胞团,并在 RT 条件下培养 10 分钟。
21. 用无菌 PBS 使试管中的容量达到 50 mL。
22. 在 RT 条件下以 ~500 × g 离心细胞 5 分钟,吸出细胞团中的液体。
23. 用 10 mL 完全 DMEM 重悬 BM 细胞。
24. 将一只小鼠的 BM 细胞培养到 4× 无菌 T75 cm2 TC 烧瓶中,加入 15 mL 补充有 20% L929 条件培养基的全 DMEM。或者,也可以解冻冷冻的 BM 细胞,然后进行培养。
25. 将烧瓶置于 37 °C、5% CO2 的加湿培养箱中。
3)冷冻原始小鼠骨髓细胞
1. 在造粒 BM 细胞之前,配制新鲜的细胞冻存液并标记无菌冷冻瓶。
2. 将 1 只小鼠(即 2× 胫骨和 2× 股骨)的 BM 重悬于 1 mL 冷冻液中。
3. 在无菌冷冻瓶中加入 1 毫升冷冻溶液中重新悬浮的 BM 细胞。
4. 将冷冻瓶加入可控速率的冷冻仪器中,在 80 °C的温度下培养至少 24 小时。
5.将含有冷冻的 BM 细胞的冷冻瓶移至液氮容器中长期保存。
4. 解冻原代小鼠骨髓细胞。
1. 从液氮储存器中收集含有冷冻 BM 细胞的冷冻瓶,放在干冰上保存。
2. 在无菌条件下的层流净化罩中,向 50 mL 试管中加入 9 mL 预热的全 DMEM。
3. 3. 将冻存管置于 37 °C 水浴中,快速解冻 BM 细胞,直至只剩下少量冰块。
5. 用 CreJ2 病毒感染巨噬细胞祖细胞。
1. 培养 BM 细胞 3 天后,巨噬细胞祖细胞就可以感染 CreJ2 病毒了。确保有另外一管第 3 天的细胞作为无 CreJ2 病毒的阴性对照。
2. 取所需数量的含有 Cre-J2 病毒上清液的冷冻等分试管,将试管放在 37 °C 水浴中解冻,直到没有冰块为止。
3. 吸出烧瓶中的培养基。
4. 在含有粘附的巨噬细胞祖细胞的烧瓶中加入 3 mL 完全 DMEM、2 mL L929 条件培养基(20%)和 5 mL 解冻的含 Cre-J2 病毒的上清液(50%)。
5. 对无 Cre-J2 病毒阴性对照烧瓶执行步骤 3-4,用完全 DMEM 代替 5 mL 解冻的含 Cre-J2 病毒上清液。
6. 将烧瓶放入 37 °C、5% CO2 的加湿培养箱中。
7. 感染 24 小时后,从含有 Cre-J2 病毒细胞的烧瓶和对照烧瓶中吸取培养基,并用 20% L929 条件培养基取代 15 mL 完全 DMEM。
8. 将烧瓶放入 37 °C、5% CO2 的加湿培养箱中。
9. 24 小时后,重复步骤 3-7 进行第二轮 Cre-J2 感染。
10. 将平板放入 37 °C、5% CO2 的加湿培养箱中培养。
6. 用于筛选骨髓来源巨噬细胞的长期培养方法。
1. 第二轮 Cre-J2 感染约 7 天后,吸出细胞上的培养基。
2. 加入新鲜的完全 DMEM,将 L929 条件培养基的浓度降至 10%。
3. 在接下来的 2 周内逐渐降低 L929 的浓度。
4. 在这 2 周内,任何未感染的 BMDMs 都将死亡,来自无 Cre-J2 病毒阴性对照烧瓶的 BMDMs 也将死亡。
5. 继续逐渐降低 L929 条件培养基的浓度,直到 BMDMs 能够在没有任何 L929 条件培养基的情况下存活和增殖。这一断奶过程通常需要 2 到 6 个月才能获得完全永生化的 BMDMs(iBMDMs)。
6. 现在可以直接将 iBMDMs 与原代 BMDMs 进行表型评估,包括通过流式细胞术(如 F4/80、Mac-1、MHC-II)和功能测试(吞噬/细菌摄取、对免疫刺激的反应)检查巨噬细胞表面标记物的表达。
7. 骨髓来源巨噬细胞的培养。
1. 当 iBMDM 融合时,从 T75 cm2 TC 烧瓶中吸走培养基。
2. 用 10 mL 无菌 PBS 冲洗粘附的细胞单层,然后再吸出。
3. 向粘附的细胞单层加入 3 mL 胰蛋白酶-EDTA,并在 37 °C 下孵育 5 分钟。
4. 37 °C 孵育 5 分钟后,用一只手的手掌用力拍打烧瓶,去除粘附的 iBMDM。
5. 用 7 mL 完全 DMEM 收获 iBMDM。
6. 将一定比例的 iBMDMs 加入一个新的 T75 cm2 TC 烧瓶中,烧瓶中装有
15 mL 新鲜的完全 DMEM。
7. 每 2-3 天传代一次 iBMDMs。
8. 单细胞克隆骨髓衍生巨噬细胞。
1. 按小标题 3.7 步骤 1-5 收获细胞。
2. 用血细胞计数器对细胞/特里潘蓝试剂(用于染色死细胞)进行 1:10 稀释,计数细胞。
3. 将 iBMDMs 的浓度调整为每毫升 1 × 106 个细胞。
4. 取 50 μL iBMDMs(每毫升 1 × 106 个细胞),将其加入 50 mL 完全 DMEM(相当于每毫升 1000 个细胞),以 1:1000 的比例稀释细胞。
5. 取 500 μL 1:1000 稀释液,将细胞进一步稀释至 1:100,并加入 50 mL 完全 DMEM 中,相当于每毫升 10 个细胞(或每 100 μL 1 个细胞)。
6. 按每毫升 10 个细胞的比例将 50 毫升细胞加入 10 平方厘米的无菌培养皿或无菌移液管中。
7. 使用 P200 多通道移液器,以每孔 100 μL(相当于每孔 ~1 个细胞)的量装入 5 × 96 孔板。
8.在 37 °C 下培养平板。
9. 7-10 天后,使用明视野显微镜检查各孔中的单克隆细胞生长情况。
10. 选择一些克隆细胞并将这些细胞扩增(例如,从 96 孔扩增到 48 孔,再从 48 孔扩增到 24 孔),直到有合适的细胞数量用于进行功能测试。根据 iBMDM 的用途,测试克隆最合适的功能,如生长速度和对特定配体的反应。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000