常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2026-02-08 09:00:00 细胞资源库平台 访问量:16
皮肤作为人体最大器官,具有屏障保护、体温调节、免疫防御等重要功能,其结构复杂,包含表皮、真皮、毛囊、血管及免疫细胞等。现有皮肤类器官模型(SKO)虽能模拟表皮分化和毛囊形成,但缺乏血管和免疫细胞,难以复现皮肤的代谢交换和免疫应答,限制了对炎症性皮肤病、创伤修复等机制的研究。此外,临床皮肤移植中,移植物因血管化不足导致的感染和坏死仍是关键挑战。本研究通过将人诱导多能干细胞(hiPSC)来源的皮肤类器官与血管类器官(VO)融合,构建出含血管、毛囊及免疫细胞的血管化皮肤类器官(VSKO),解决了传统模型的局限性,为皮肤生物学研究和再生医学提供了新工具。
来自澳大利亚昆士兰大学的团队在《Advanced Healthcare Materials》(2025 年)发表了题为Coordinated Development of Immune Cell Populations in Vascularized Skin Organoids from Human Induced Pluripotent Stem Cells的研究。
研究方法:
皮肤类器官(SKO)构建:从 hiPSC 诱导形成含表皮、真皮和毛囊的 3D 结构,通过气液界面(ALI)培养促进角化和毛囊成熟;
血管类器官(VO)构建:hiPSC 经中胚层分化,添加 Chir99021、BMP4 等因子诱导形成含内皮细胞、周细胞、造血细胞的血管结构;
VSKO 构建:将 1 个 SKO 与 2 个 VO 在 Matrigel 中融合,通过 ALI 培养促进血管侵入皮肤类器官,形成功能性血管网络;
表征手段:免疫荧光检测血管标记(CD31、CD34)、毛囊标记(SOX2、K14)及免疫细胞标记(CD45、CD68),流式细胞术分析细胞组成,组织学染色观察结构。
关键结果:
两种血管化策略对比:用胎盘内皮集落形成细胞(ECFCs)血管化 SKO 会抑制毛囊形成和表皮角化,而 VO 融合法则无此问题;
VSKO 结构:含完整表皮(K10+)、真皮、毛囊(SOX2+),血管网络由 CD31+/NG2 + 的动脉和静脉毛细血管组成,周细胞(α-SMA+)支持血管结构;
免疫细胞整合:VO 来源的 CD45 + 造血细胞迁移至 VSKO,分化为 CD68 + 巨噬细胞、CD207 + 朗格汉斯细胞前体及 CD66b + 中性粒细胞,分布于真皮层;
功能优势:VSKO 中血管围绕毛囊形成周毛血管,模拟体内皮肤的生理关联,且两种 hiPSC 系(P111 和 C32)均能稳定构建 VSKO,验证了方法的可重复性;
应用价值:VSKO 可用于研究炎症性皮肤病(如银屑病)、毛囊 - 血管互作机制,以及筛选促血管化药物,为皮肤移植和创伤修复提供体外模型。
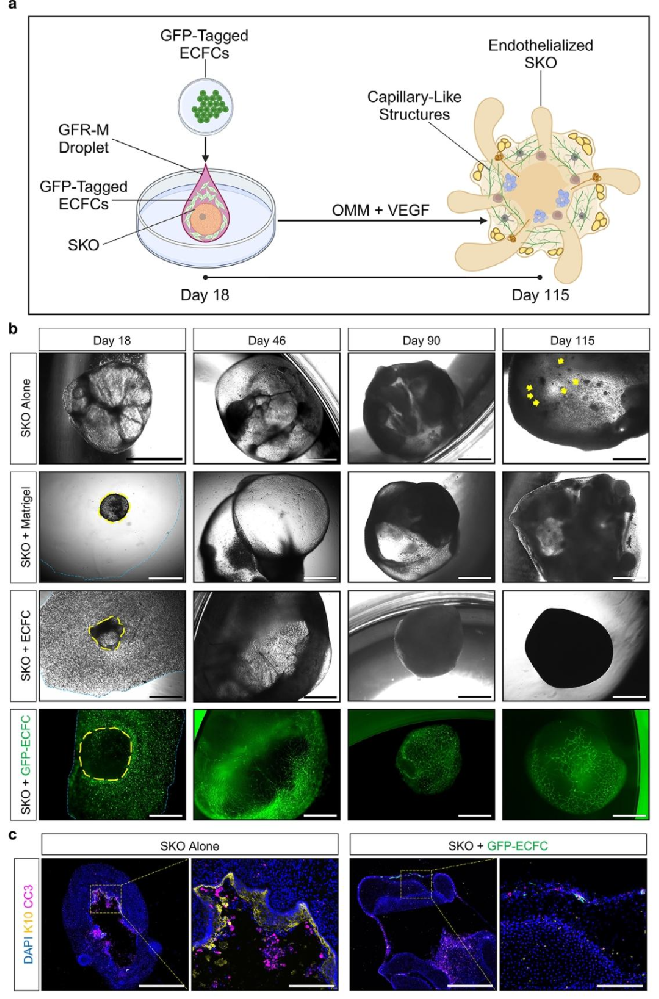
图 1:内皮化皮肤类器官的构建过程
该图展示 ECFCs 与 SKO 共培养的实验设计。(A)流程示意图:第 18 天的 SKO 与 GFP 标记的 ECFCs 在含 VEGF 的培养基中共培养,利用 GFR-M 基质支持血管形成,持续至第 115 天;(B)不同时间点的明场图像显示,ECFCs 形成毛细血管样结构包裹 SKO,但毛囊发育受抑;(C)免疫荧光证实,SKO+ECFC 组无坏死核心(CC3-),但缺乏角质形成细胞成熟标记 K10,表明 ECFCs 抑制表皮角化。图示揭示 ECFCs 血管化策略的局限性。
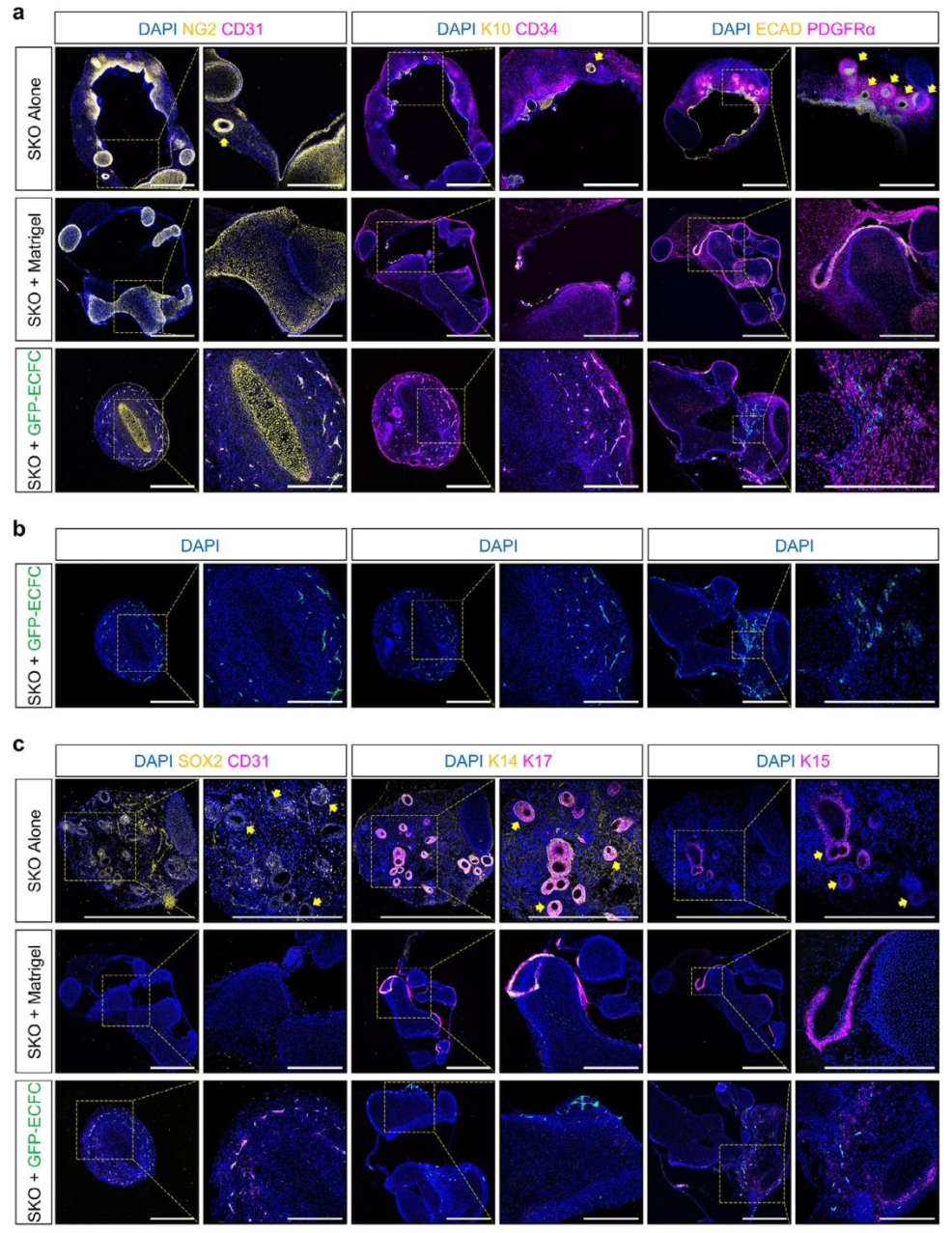
图 2:内皮化皮肤类器官的细胞组成
该图通过免疫荧光分析细胞类型。(A)SKO+ECFC 组中,CD31+/CD34 + 毛细血管与 GFP+ECFCs 共定位,证实血管形成,但出现 NG2 + 软骨结构,提示间充质分化异常;(B)GFP 通道单独显示 ECFCs 在 SKO 周围的分布;(C)毛囊标记 SOX2、K14 仅在 SKO 单独组中表达,SKO+ECFC 组无毛囊,验证 ECFCs 对毛囊发育的抑制作用。
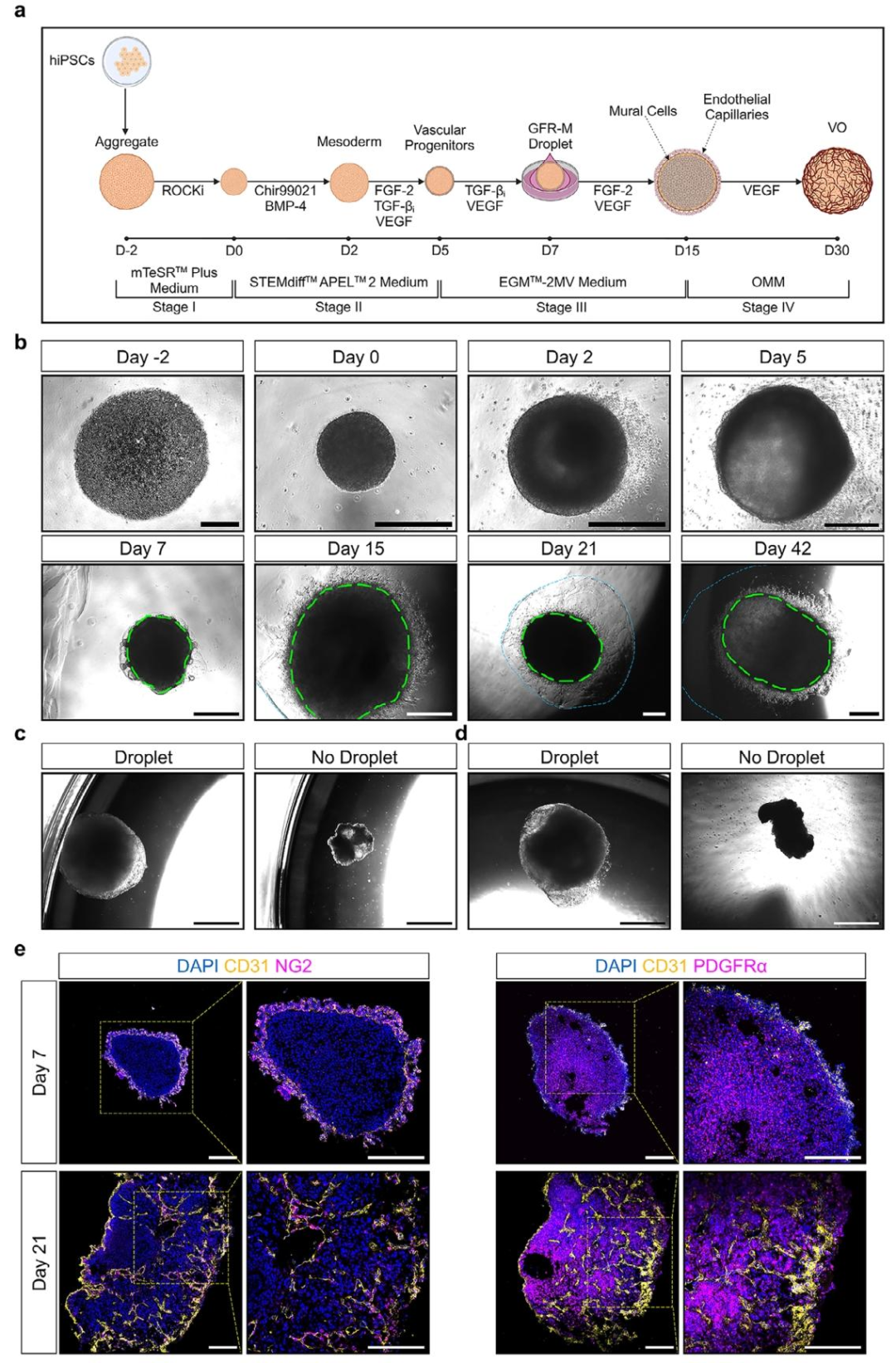
图 3:血管类器官(VO)的分化过程
该图展示 VO 的构建方法与形态变化。(A)分化流程:hiPSC 经中胚层诱导(添加 Chir99021、BMP4),第 7 天加入 GFR-M 促进血管成熟,全程用 VEGF 和 FGF-2 维持;(B)不同时间点的明场图像显示 VO 从细胞聚集体逐步形成毛细血管结构;(C-D)第 21 天的 VO 在含 GFR-M 时体积更大,结构更完整;(E)免疫荧光显示,第 7 天 CD31+/NG2 + 细胞分布于 VO 边缘,第 21 天侵入中心,PDGFRα+ 细胞广泛分布,证实血管结构的成熟。
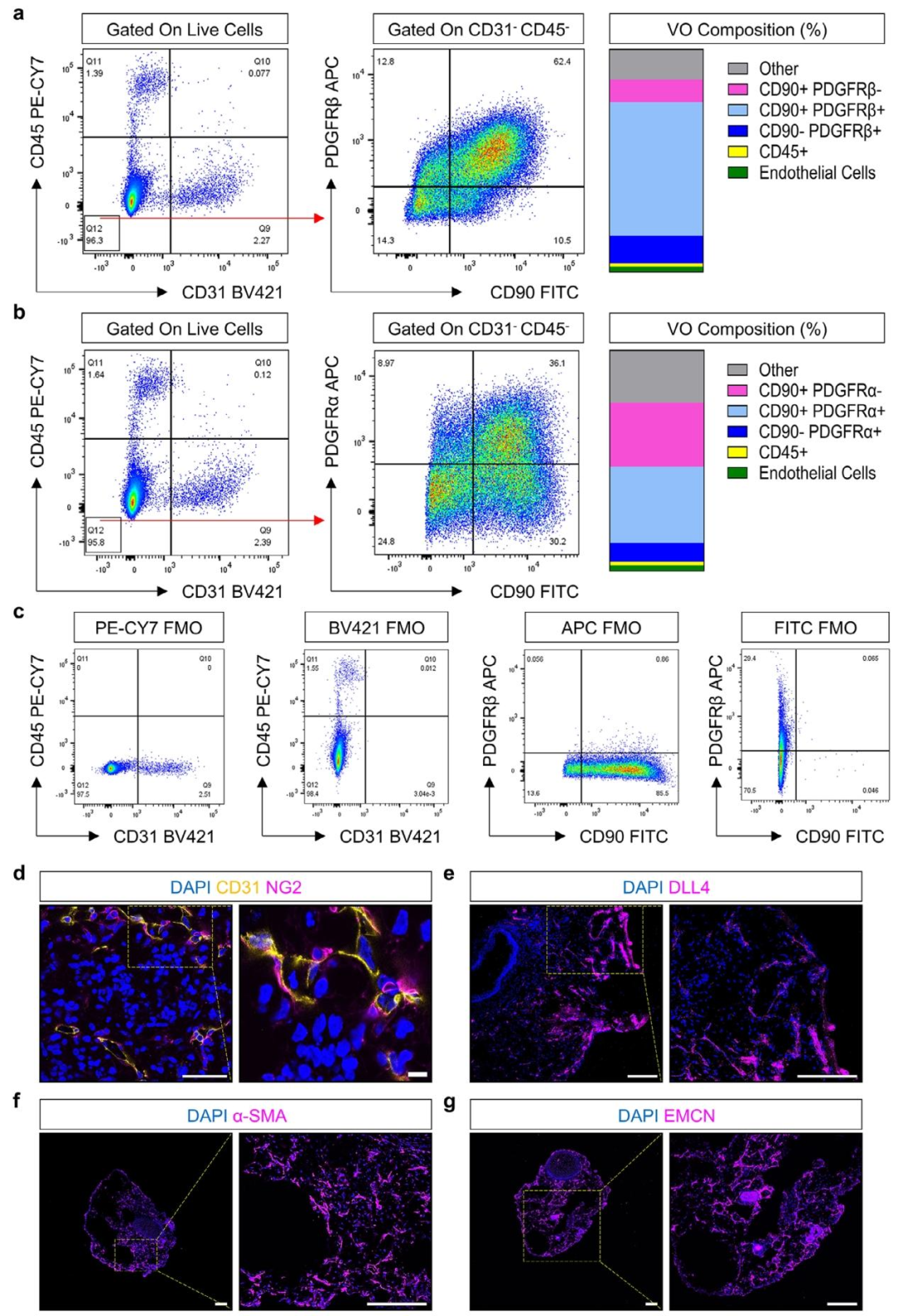
图 4:血管类器官的细胞异质性
该图通过流式细胞术和免疫荧光解析 VO 的细胞组成。(A-B)流式分析显示,第 42 天的 VO 含 CD31 + 内皮细胞、CD45 + 造血细胞、CD90 + 间充质细胞及 PDGFRβ+ 周细胞,其中 CD90+/PDGFRβ+ 细胞占比约 60%;(C)荧光减一对照(FMO)验证抗体特异性;(D)免疫荧光显示 CD31 + 内皮细胞被 NG2 + 周细胞包裹,模拟血管壁结构;(E-G)VO 中存在 DLL4 + 动脉毛细血管、α-SMA + 血管平滑肌细胞及 EMCN + 静脉毛细血管,证实血管类型的多样性。
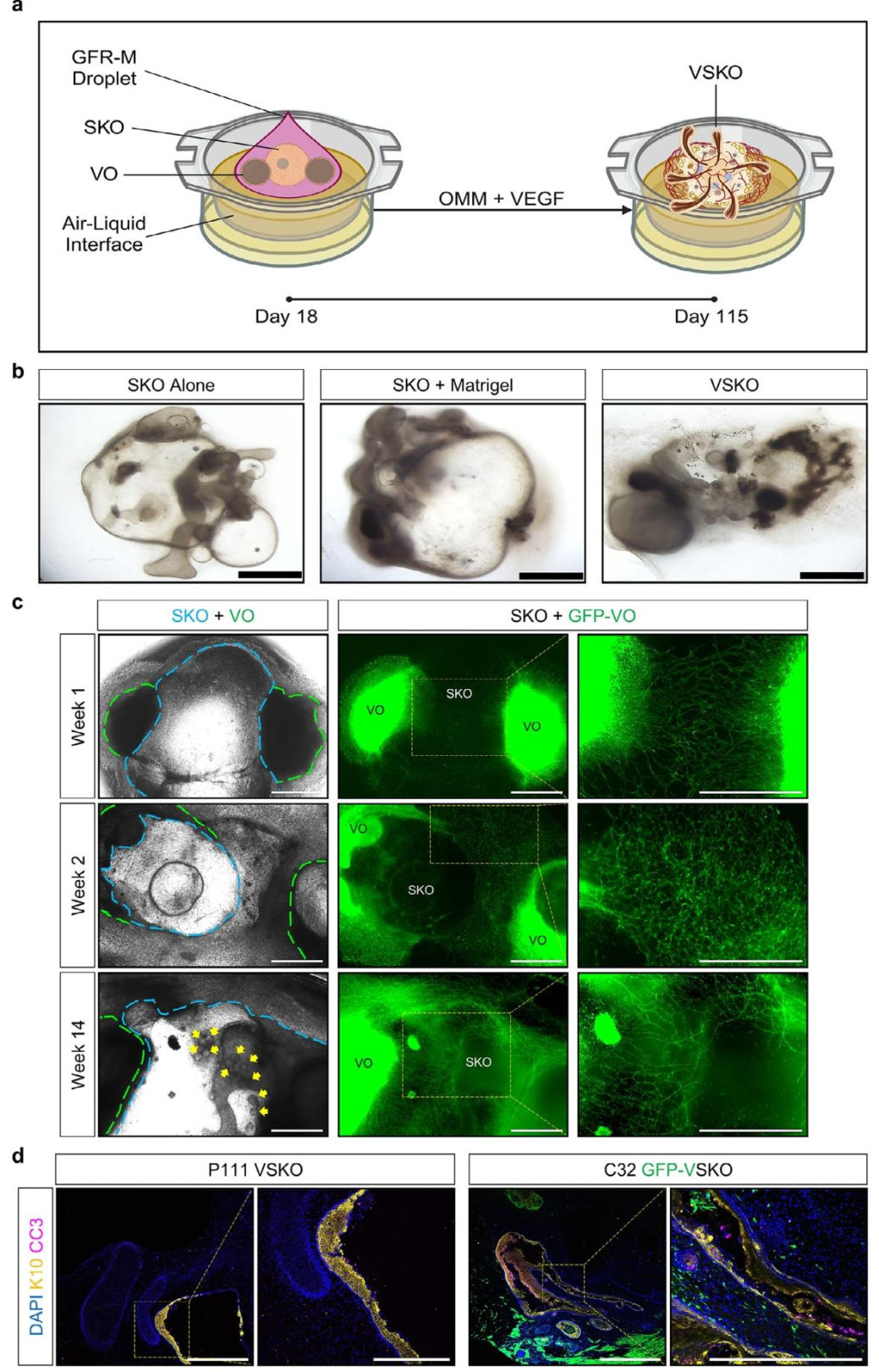
图 5:血管化皮肤类器官(VSKO)的构建
该图展示 VO 与 SKO 融合的策略。(A)流程示意图:第 18 天的 SKO 与 2 个 VO 在气液界面(ALI)的 GFR-M 中融合,利用 Transwell 系统模拟皮肤与空气接触的微环境;(B)明场图像显示,VSKO 组第 115 天形成厚表皮和毛囊,而 SKO+Matrigel 组无血管且毛囊发育差;(C)GFP 标记的 VO 与 SKO 共培养显示,血管芽从 VO 向 SKO 迁移;(D)免疫荧光证实,VSKO 无坏死核心(CC3-),含 K10 + 厚表皮,GFP + 血管细胞侵入真皮,验证血管与皮肤的整合。
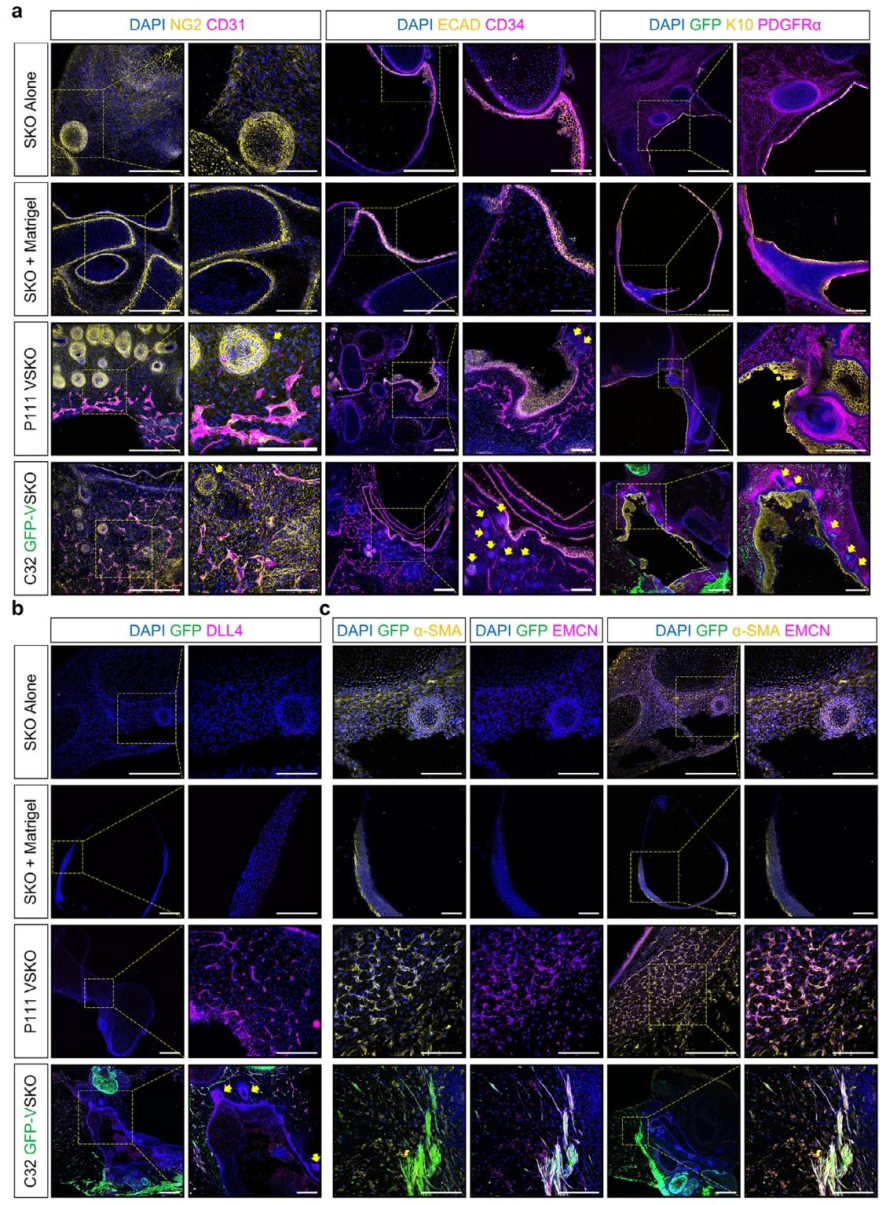
图 6:VSKO 的血管结构表征
该图验证 VSKO 中血管的成熟度。(A)免疫荧光显示,VSKO 含 CD31+/NG2 + 毛细血管、CD34 + 血管内皮,与 ECAD + 表皮层界限清晰,模拟体内皮肤的血管分布;(B-C)VO 来源的血管表达 DLL4(动脉标记)和 EMCN(静脉标记),且被 α-SMA + 平滑肌细胞包裹,证实血管的功能性结构,而对照组(SKO 单独、SKO+Matrigel)无血管形成。
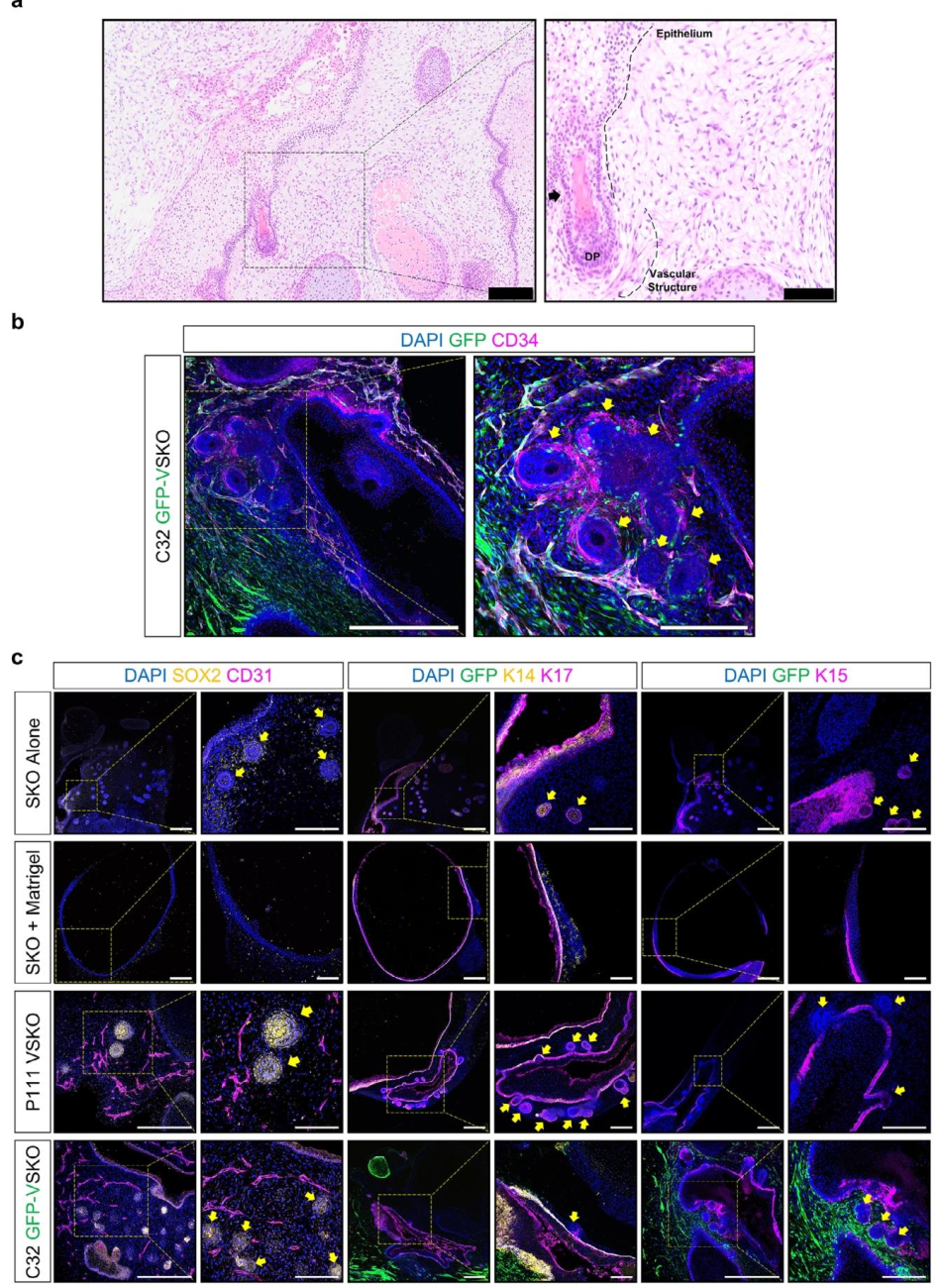
图 7:VSKO 的毛囊与血管互作
该图展示毛囊与血管的空间关系。(A)HE 染色显示 VSKO 含厚表皮、毛囊及真皮乳头;(B)免疫荧光显示,CD34 + 血管围绕毛囊形成周毛血管,GFP + 细胞来源于 VO;(C)毛囊标记 SOX2、K14、K15 在 VSKO 中表达,证实毛囊正常发育,而 SKO+Matrigel 组无毛囊,凸显 VO 融合策略的优势。
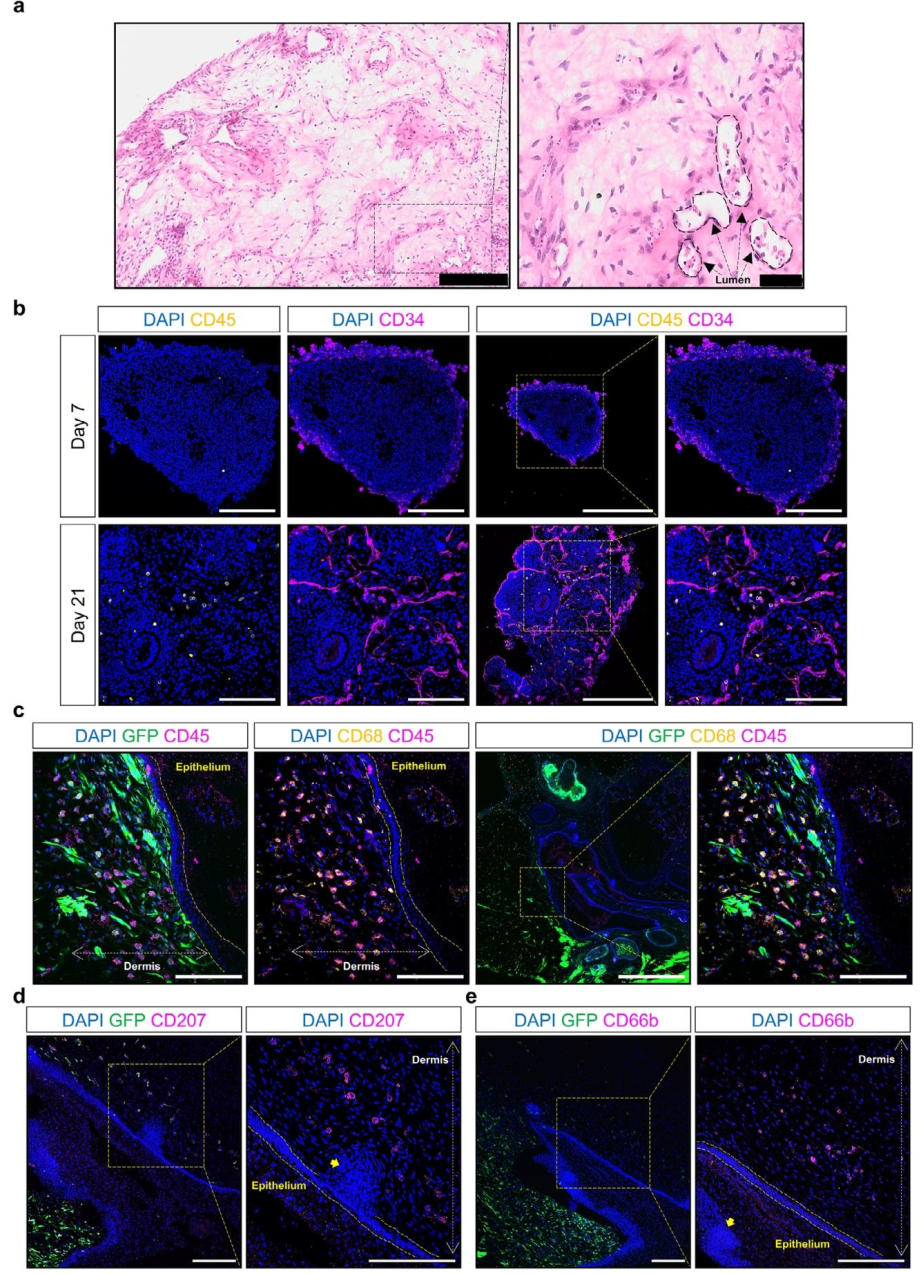
图 8:VSKO 中的免疫细胞迁移
该图揭示免疫细胞从 VO 向 VSKO 的迁移。(A)HE 染色显示 VO 的血管样结构中含免疫样细胞;(B)免疫荧光显示,VO 在第 7 天无 CD45 + 细胞,第 21 天出现 CD45+/CD34 + 造血细胞;(C)VSKO 中,GFP+VO 来源的 CD45 + 细胞分布于真皮,且多数为 CD68 + 巨噬细胞;(D-E)VSKO 的真皮层存在 CD207 + 朗格汉斯细胞前体和 CD66b + 中性粒细胞,证实免疫细胞的多样性。
本研究成功构建了含血管、毛囊和免疫细胞的血管化皮肤类器官(VSKO),通过将 hiPSC 来源的皮肤类器官(SKO)与血管类器官(VO)融合,克服了传统 ECFCs 血管化策略抑制毛囊发育的缺陷。VSKO 不仅重现了表皮角化、毛囊形成等皮肤结构,还形成了含动脉、静脉及周细胞的功能性血管网络,且 VO 来源的造血细胞可分化为巨噬细胞、朗格汉斯细胞前体等免疫细胞,迁移至皮肤类器官发挥免疫功能。
该模型的创新点在于:利用同一 hiPSC 系构建 SKO 和 VO,避免异源性排斥;气液界面培养促进皮肤成熟与血管 - 毛囊互作;首次实现免疫细胞与血管的协同整合。局限性包括类器官成熟度接近胎儿皮肤、缺乏神经支配等,未来可通过延长培养时间或共培养神经细胞优化。VSKO 为炎症性皮肤病建模、促血管化药物筛选及皮肤移植研究提供了生理相关性高的平台,推动皮肤再生医学的发展。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:人类神经类器官微生理系统具备基本学习与记忆的结构基础研究
下一篇:利用人类脑类器官识别胸腺素 β4 作为阿尔茨海默病的干预靶点研究