常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2026-01-29 17:04:15 细胞资源库平台 访问量:19
乙肝病毒(HBV)感染是全球主要公共卫生问题之一,有超过2.5亿人慢性感染HBV。而其中有超三分之一的人口集中在我国,人数接近1亿人。NTCP工具细胞,特别是外源表达NTCP的肝癌细胞系如HepG2-NTCP和Huh7-NTCP,因其易操作、短周期、重现性佳的特点,在乙肝病毒(HBV)研究中扮演着至关重要的角色。这些细胞模型能够有效模拟HBV的感染过程,为研究HBV的生命周期、宿主限制因子、病毒复制以及药物筛选提供了一个强大而便捷的体外平台。它们不仅有助于揭示HBV感染的分子机制,如DDX3作为宿主限制因子阻碍cccDNA转录,GPC5作为附着因子在感染入胞过程中的作用,还能通过直接与NTCP相互作用或下调NTCP表达来筛选和验证抗病毒药物的活性,例如环孢菌素A及其衍生物、雷帕霉素及其衍生物等。此外,这些工具细胞还促进了对HBV宿主特异性分子的发现,为发展支持HBV感染的小动物模型提供了可能,这对于乙肝相关研究和药物开发具有重大意义。
英文标题:Dual Agonist of Farnesoid X Receptor and G Protein-coupled Receptor TGR5 Inhibits Hepatitis B Virus Infection in Vitro and in Vivo
中文标题:法尼醇 X 受体(FXR)与 G 蛋白偶联受体 TGR5 双激动剂在体外和体内抑制乙型肝炎病毒感染
发表期刊:《Hepatology》
影响因子:15.8
作者单位:
1.Department of Gastroenterology, Aichi Medical University School of Medicine, Nagakute, Japan;
2.Department of Virology II, National Institute of Infectious Diseases, Tokyo, Japan;
3.Faculty of Pharmaceutical Sciences, Hiroshima International University, Kure, Japan;
4.Department of Molecular Target Medicine Screening, Aichi Medical University School of Medicine, Nagakute, Japan
作者信息:
Kiyoaki Ito1*(通讯作者)、Akinori Okumura、Junko S. Takeuchi、Koichi Watashi
慢性乙型肝炎病毒(HBV)感染是全球主要健康问题,全球超 2.4 亿人受影响,且面临肝硬化、肝衰竭和肝癌风险。目前一线治疗药物为核苷(酸)类似物(NAs)和干扰素(IFNs),但无法根治,需终身用药,且难以有效降低乙肝表面抗原(HBsAg)水平,HBsAg 清除率极低。抑制 HBV 进入肝细胞是防治急慢性感染的新策略,牛磺胆酸钠共转运多肽(NTCP)已被证实为 HBV 受体,多种化合物可通过抑制 NTCP 阻断 HBV 进入。法尼醇 X 受体(FXR)激活可通过诱导小异源二聚体伙伴(SHP)下调 NTCP 表达,因此推测 FXR 激动剂(如胆汁酸衍生物)可能具有抗 HBV 潜力。本研究旨在探讨多种胆汁酸衍生物(包括 FXR/TGR5 双激动剂 INT-767、FXR 激动剂奥贝胆酸(OCA)、TGR5 激动剂 INT-777)及其他 NTCP 抑制剂的抗 HBV 作用及机制。
本研究采用 HepG2-hNTCP-C4、HepG2.2.15.7、Hep38.7-Tet 细胞及人源化肝脏 uPA/SCID 嵌合小鼠来源的 PXB 细胞,按相应标准培养;所用化合物包括 OCA、INT-767、INT-777(由 Intercept Pharmaceuticals 提供或商业采购)及环孢素 A(CsA)、厄贝沙坦、GW4064 等对照药物。体外实验中,HepG2-hNTCP-C4 细胞和 PXB 细胞经化合物预处理 2 小时后,感染 HBV(基因型 D 或 C),培养后收集上清液和细胞,通过化学发光酶免疫分析检测 HBsAg、HBeAg 水平,实时荧光定量 PCR 检测 HBV DNA 和细胞内共价闭合环状 DNA(cccDNA),免疫荧光检测乙肝核心抗原(HBcAg),Western Blot 检测相关蛋白表达;体内实验将 9 只人源化肝脏嵌合小鼠分为对照组、A 组、B 组,尾静脉注射 HBV 后,从第 3 天开始口服给予载体或不同剂量 INT-767 至第 56 天,定期采集血清检测病毒标志物,处死小鼠后检测肝内 cccDNA。通过荧光标记 preS1 肽探针评估化合物对 preS1 与 NTCP 结合的影响,采用超滤法验证 INT-767 的作用靶点;统计分析采用 Student t 检验(两组)或单因素方差分析结合 Dunnett/Tukey 检验(多组),以 P<0.05 为差异有统计学意义,所有实验重复 3 次。
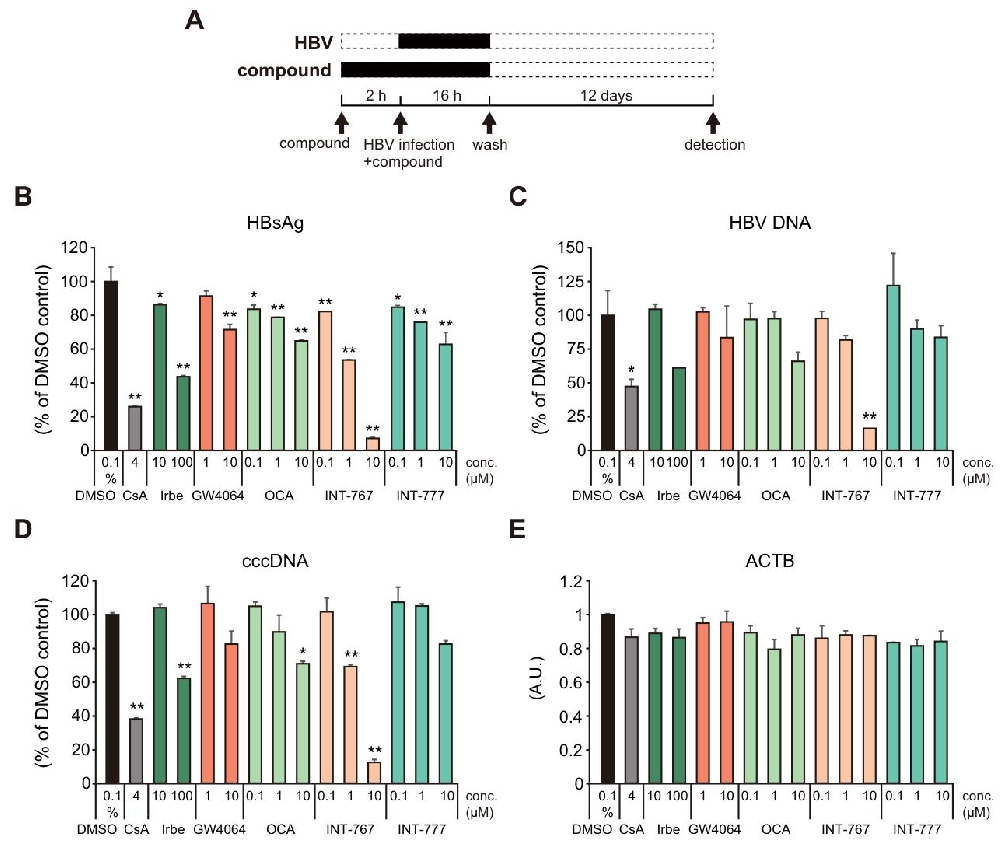
图 1:NTCP 抑制剂对 HepG2-hNTCP-C4 细胞中 HBsAg、HBV DNA 和 cccDNA 的影响HepG2-hNTCP-C4 细胞经化合物预处理并感染 HBV 后,4μM CsA 可降低上清液中 HBsAg、HBV DNA 及细胞内 cccDNA 水平;厄贝沙坦、GW4064、OCA、INT-777 均能剂量依赖性降低 HBsAg 水平;INT-767 抑制效果最显著,分别降低 92.9% 的 HBsAg、83.6% 的 HBV DNA 和 87.7% 的 cccDNA,且所有化合物均不影响内参基因 ACTB 的表达,无明显细胞毒性相关的基因表达异常。
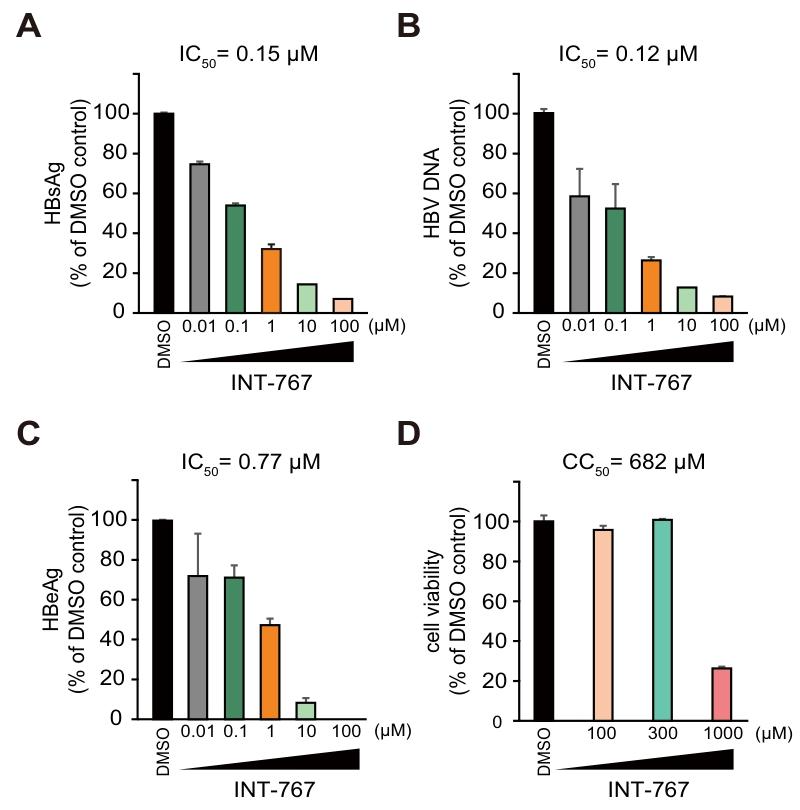
图 2:INT-767 抑制 HBV 感染的剂量效应及细胞毒性PXB 细胞中,INT-767 对 HBsAg、HBV DNA、HBeAg 的半数抑制浓度(IC50)分别为 0.15μM、0.12μM、0.77μM;半数细胞毒性浓度(CC50)为 682μM,对 HBsAg、HBeAg、HBV DNA 的选择性指数(CC50/IC50)分别达 4547、886、5683,显示出高选择性和低细胞毒性。
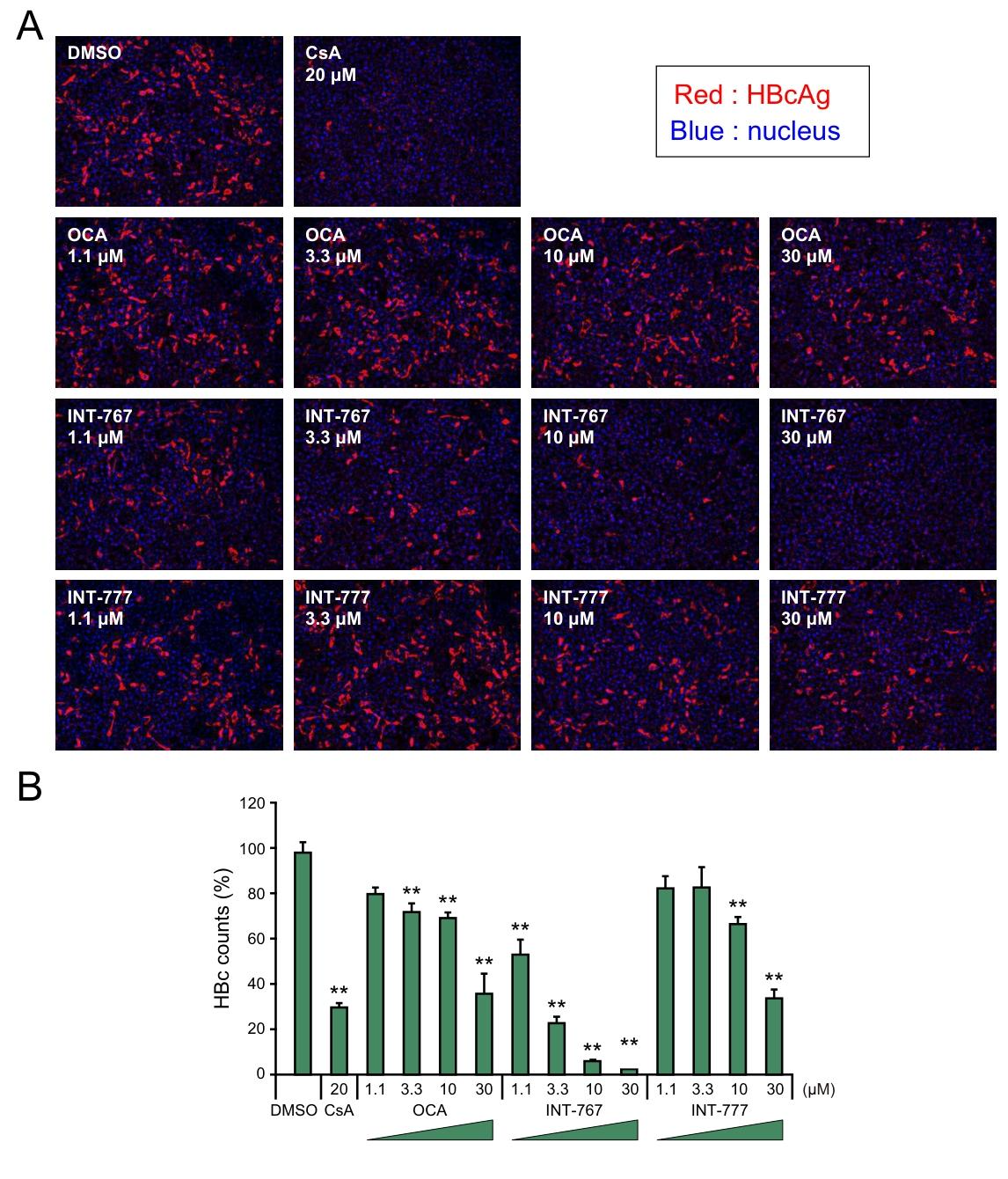
图 3:INT-767 降低 HepG2-hNTCP-C4 细胞中 HBcAg 的表达免疫荧光结果显示,20μM CsA 可明显降低 HBcAg 水平;OCA 和 INT-777 呈弱剂量依赖性降低 HBcAg;INT-767 则呈强剂量依赖性抑制,在 1.1μM、3.3μM、10μM、30μM 浓度下均能显著减少 HBcAg 阳性细胞数量,进一步证实其抗 HBV 感染作用。
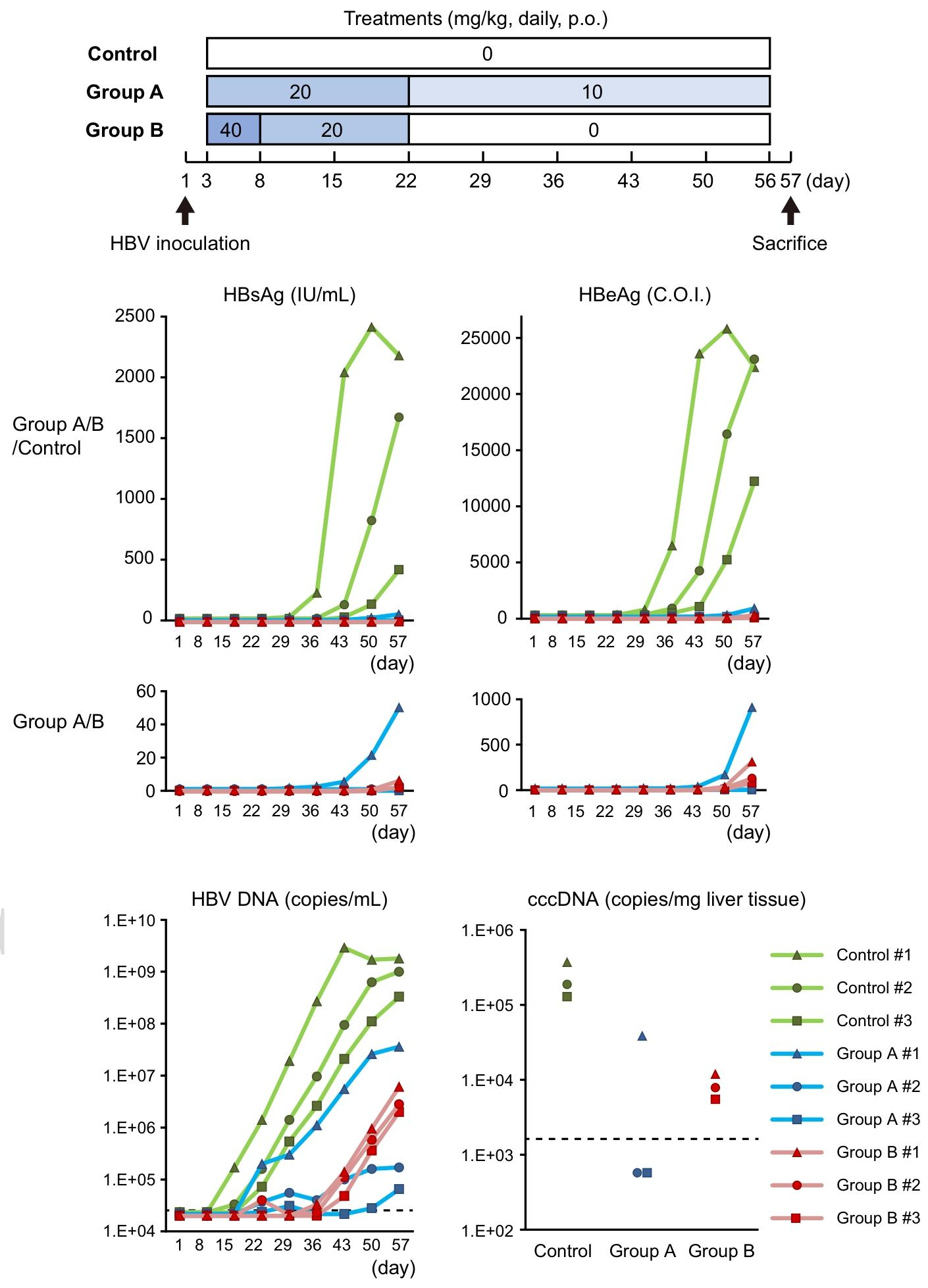
图 4:INT-767 在人源化肝脏嵌合(PXB)小鼠中抑制 HBV 感染对照组小鼠 HBsAg、HBeAg 从第 36 天开始快速升高;A 组(20mg/kg 起始,第 22 天降至 10mg/kg)1 只小鼠第 43 天检测到低滴度 HBsAg 和 HBeAg,其余 2 只病毒标志物初始升高明显延迟,HBV DNA 显著降低;B 组(40mg/kg 起始,第 8 天降至 20mg/kg,第 21 天停药)所有小鼠 HBsAg、HBeAg 初始升高显著延迟,第 57 天仅检测到极低滴度,给药期间 HBV DNA 被显著抑制,停药后略有回升;两组小鼠肝内 cccDNA 水平均低于对照组,证实 INT-767 在体内的抗 HBV 效果。
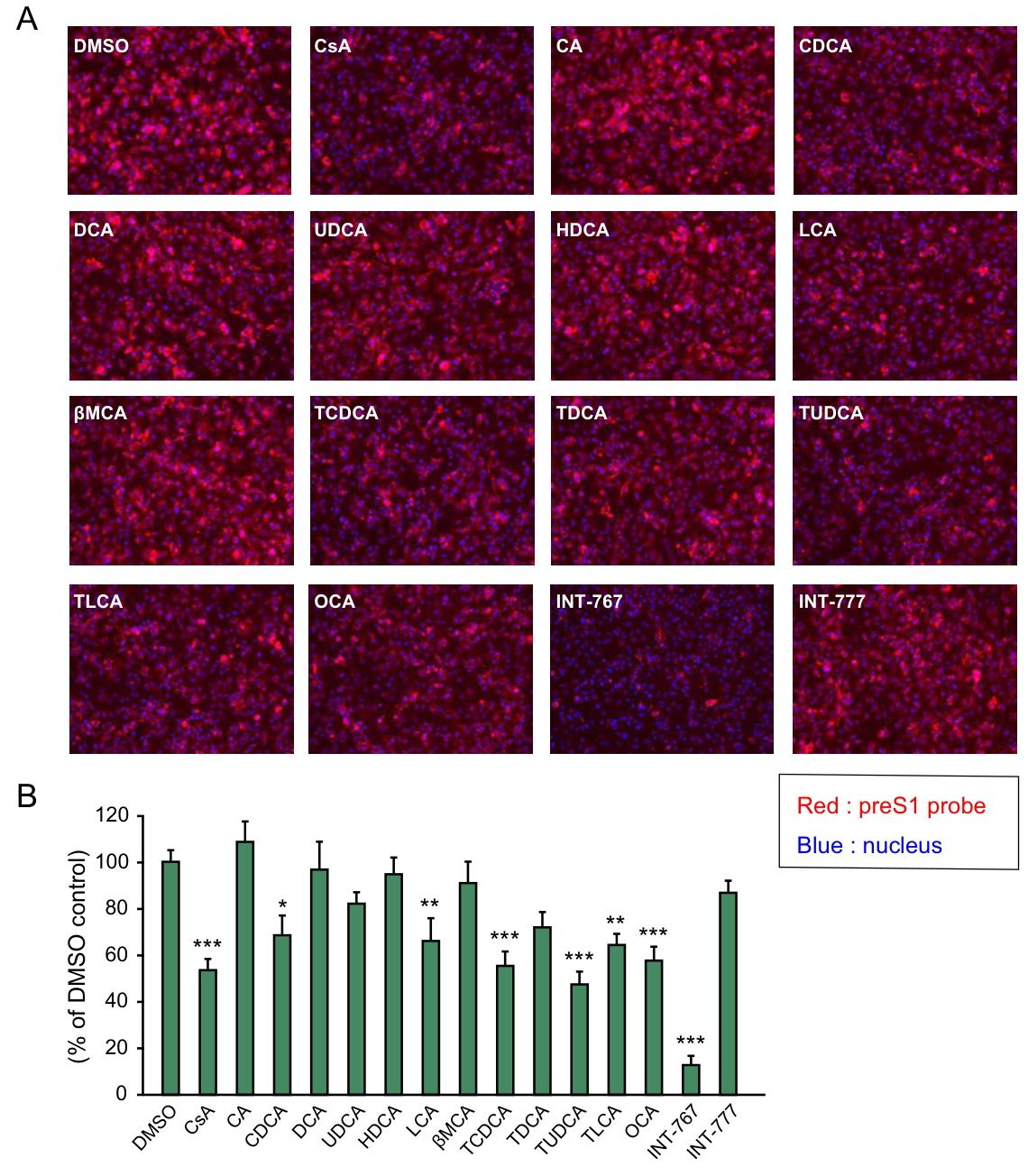
图 5:天然胆汁酸与胆汁酸衍生物对 preS1-NTCP 结合的抑制作用天然胆汁酸中,鹅去氧胆酸(CDCA)、石胆酸(LCA)等可轻微抑制 preS1 与 NTCP 的结合,但效果较弱;OCA 和 INT-777 对该结合的抑制作用较弱,而 INT-767 的抑制效果显著强于所有天然胆汁酸及其他胆汁酸衍生物,提示其在阻断 HBV 进入靶点结合环节的优势。
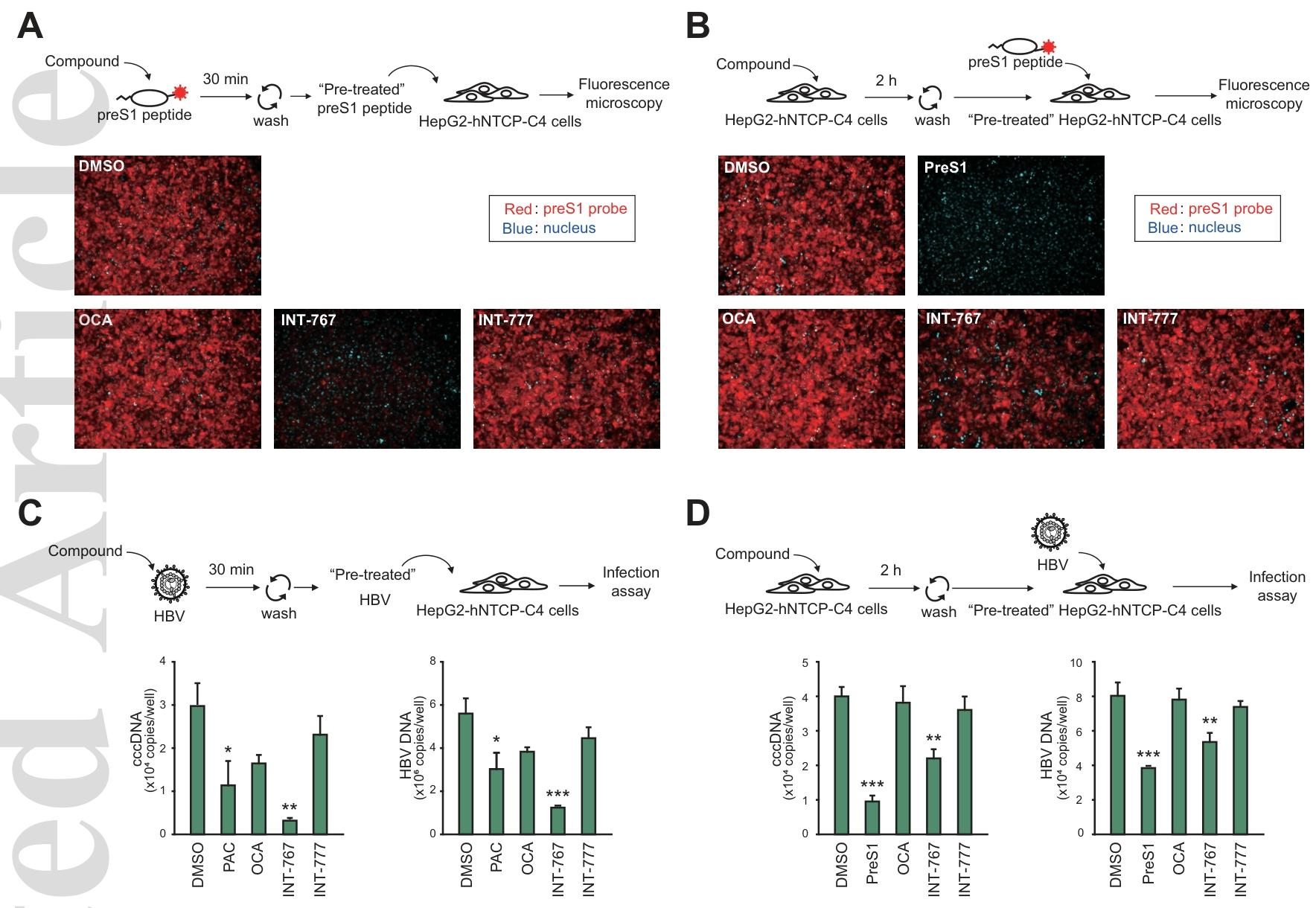
图 6:INT-767 通过靶向 HBV 颗粒抑制感染超滤实验显示,INT-767 预处理的 preS1 肽或 HBV 颗粒,在去除游离化合物后仍能强烈抑制 preS1 与 NTCP 的结合及 HBV 感染,效果显著强于 INT-767 预处理宿主细胞的方式;与已知靶向 HBV 颗粒的进入抑制剂原花青素(PAC)相比,INT-767 的抑制作用更强,证实 INT-767 优先结合 HBV 颗粒而非肝细胞上的 NTCP。
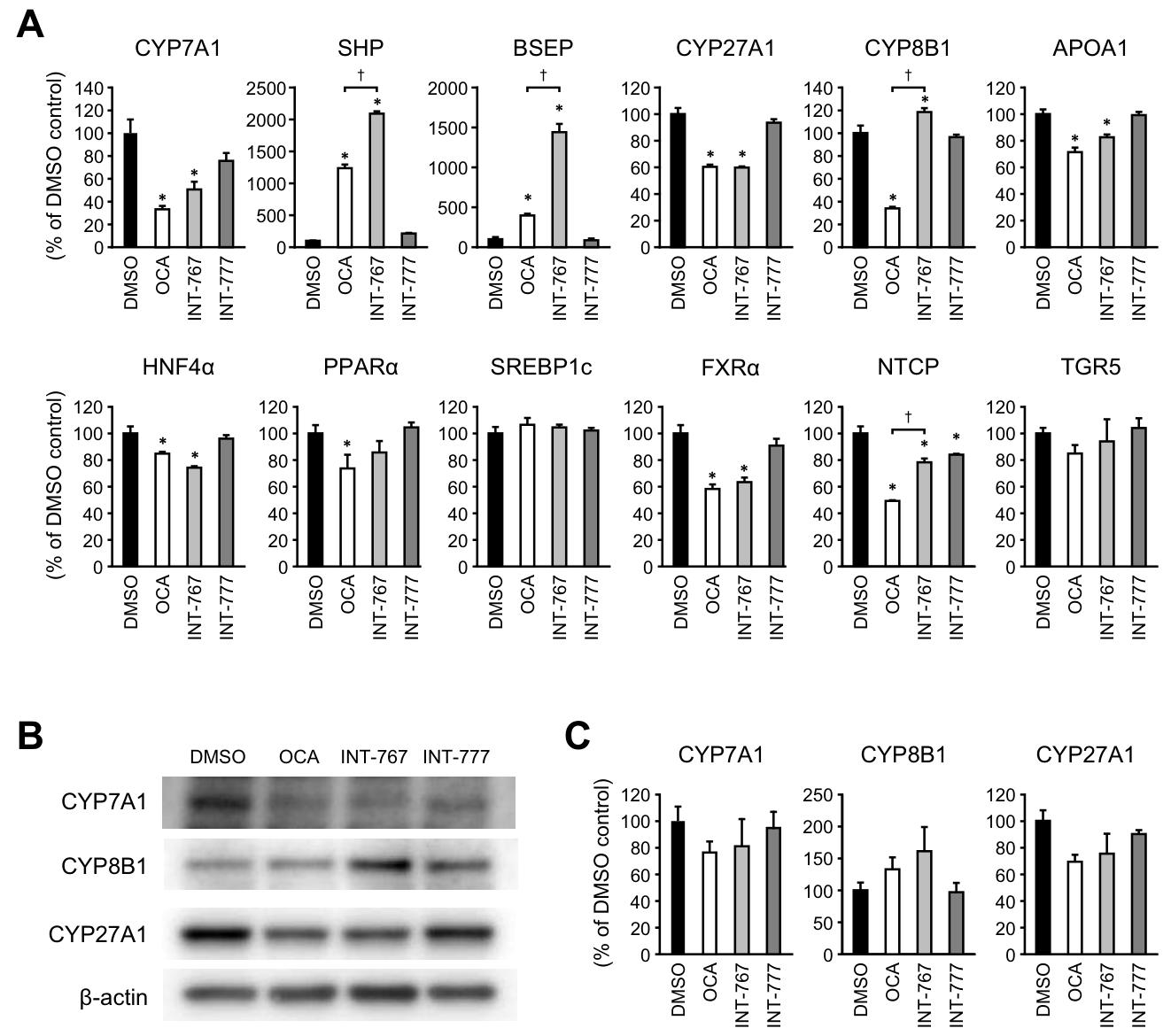
图 7:胆汁酸衍生物对 FXR 和 TGR5 下游信号通路的影响PXB 细胞中,OCA 和 INT-767 均能显著降低 CYP7A1、CYP27A1、APOA1 等基因表达,升高 SHP 和 BSEP 表达;INT-767 诱导的 SHP 和 BSEP 表达水平显著高于 OCA,且对 CYP8B1 的调控与 OCA 相反(INT-767 升高,OCA 降低);OCA、INT-767、INT-777 均能降低 NTCP 表达,其中 OCA 的抑制作用强于 INT-767;三者均不影响 SREBP1c 和 TGR5 的表达,提示其通过调控 FXR 下游信号参与抗 HBV 过程。
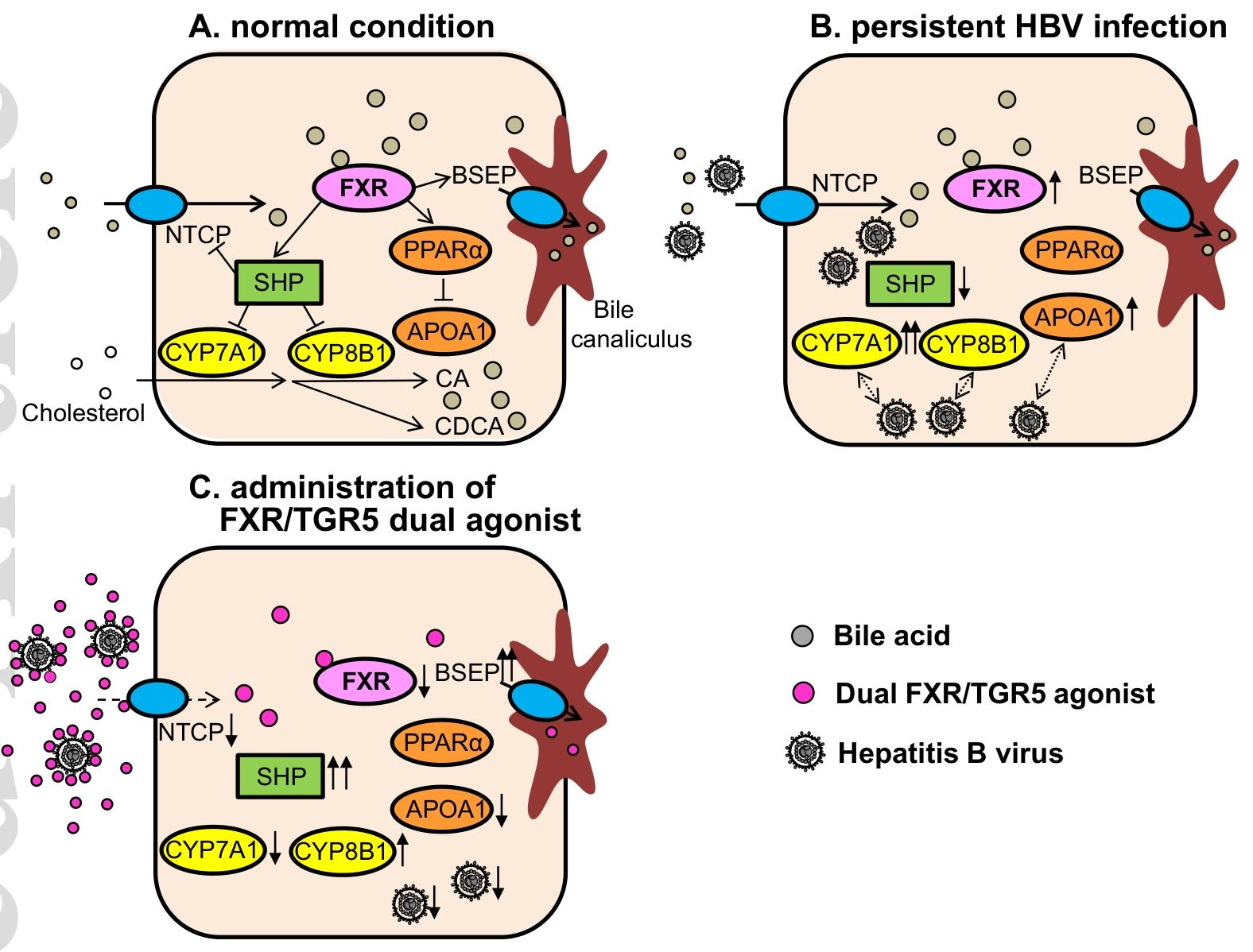
图 8:胆汁酸代谢与 FXR 下游信号通路示意图图示分别展示了正常状态(A)、持续 HBV 感染状态(B)及 FXR/TGR5 双激动剂(INT-767)给药后(C)的通路变化。正常状态下,FXR 激活通过 SHP 调控胆汁酸代谢相关基因;HBV 感染会改变胆汁酸代谢相关基因表达;INT-767 给药后,通过激活 FXR/TGR5 双受体,一方面阻断 HBV 与 NTCP 结合,另一方面调控下游信号影响 HBV 感染后步骤,发挥双重抗 HBV 作用。
本研究系统探讨了多种胆汁酸衍生物及 NTCP 抑制剂的抗 HBV 作用,发现 FXR/TGR5 双激动剂 INT-767 在体外(HepG2-hNTCP-C4 细胞、PXB 细胞)和体内(人源化肝脏嵌合小鼠)均表现出强效抗 HBV 活性,其机制包括作为进入抑制剂优先靶向 HBV 颗粒、阻断 preS1 与 NTCP 结合,以及刺激 FXR 下游信号通路影响 HBV 感染后步骤(如 cccDNA 形成、病毒转录),且具有高选择性和低细胞毒性。相比之下,OCA(FXR 激动剂)、INT-777(TGR5 激动剂)及天然胆汁酸的抗 HBV 效果较弱。研究证实 INT-767 是极具潜力的新型抗 HBV 候选药物,可为慢性乙肝的治疗提供新方向,未来需进一步明确其作用的精确分子机制,以推动相关药物的研发。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:miR-5787 靶向 TLR4/NF-κB 通路守护脑血管健康
下一篇:乳铁蛋白 - 骨桥蛋白复合物的肠道类器官生物利用度及肠道菌群调节研究