常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2026-01-07 09:00:28 细胞资源库平台 访问量:3
MeCP2(甲基化 CpG 结合蛋白 2)在神经系统正常发育中起关键作用,其突变与 Rett 综合征等神经发育障碍相关,可能与线粒体功能异常及线粒体自噬(mitophagy)受损有关,但具体机制尚未明确。传统研究模型难以模拟人类皮质发育的复杂过程,而皮质类器官(COs)能再现神经发生的时空特征,为探究 MeCP2 调控神经发育的机制提供理想平台。本研究通过 MeCP2 突变诱导多能干细胞(iPSCs)分化的 COs,揭示其通过调控线粒体自噬影响神经发育的分子机制。
来自西安交通大学的团队在《Journal of Advanced Research》期刊发表了题为“MeCP2 dysregulation inhibits mitophagy and impairs neural development in cortical organoids”的研究。
模型构建与表型分析:利用 CRISPR-Cas9 构建 MeCP2 c.269_275del(p.D90_R91del)突变 iPSCs,分化为皮质类器官(COs),发现突变型 COs 生长受抑(体积减小),神经干细胞增殖能力下降(Ki67+、BrdU + 细胞减少),分化异常(成熟神经元标志物 MAP2 + 细胞减少,未成熟神经元 imNeuron2 积累),模拟 Rett 综合征的微脑表型。
线粒体自噬与功能异常:单细胞 RNA 测序显示突变型 COs 中关键线粒体自噬受体 BNIP3L 显著下调;MeCP2 可结合 BNIP3L 的转录起始位点(TSS)促进其转录,突变后 BNIP3L 表达受抑,导致线粒体自噬障碍(LC3 与线粒体标记 TOM20 共定位减少,自噬底物 p62 积累);同时线粒体膜电位降低、ROS 积累、形态碎片化,氧化磷酸化功能受损(氧消耗率、ATP 生成下降)。
机制验证与功能恢复:MeCP2 敲除实验重现突变型表型,证实其对线粒体自噬的调控作用;过表达 BNIP3L 可部分恢复突变型 COs 的线粒体自噬功能,改善线粒体膜电位和 ROS 积累,缓解神经发育异常。
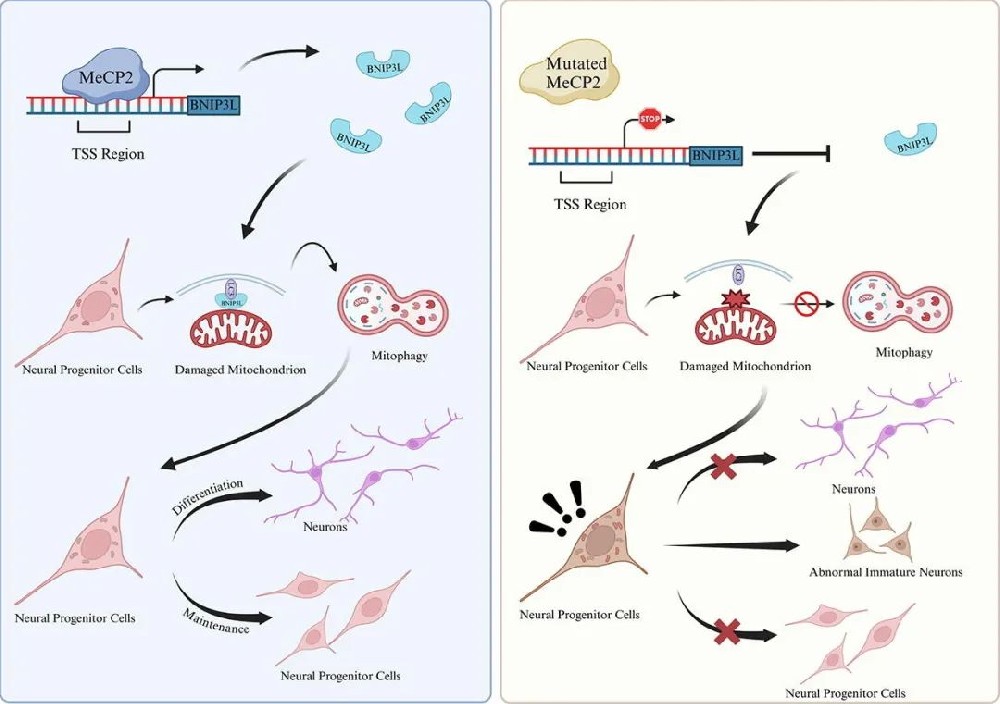
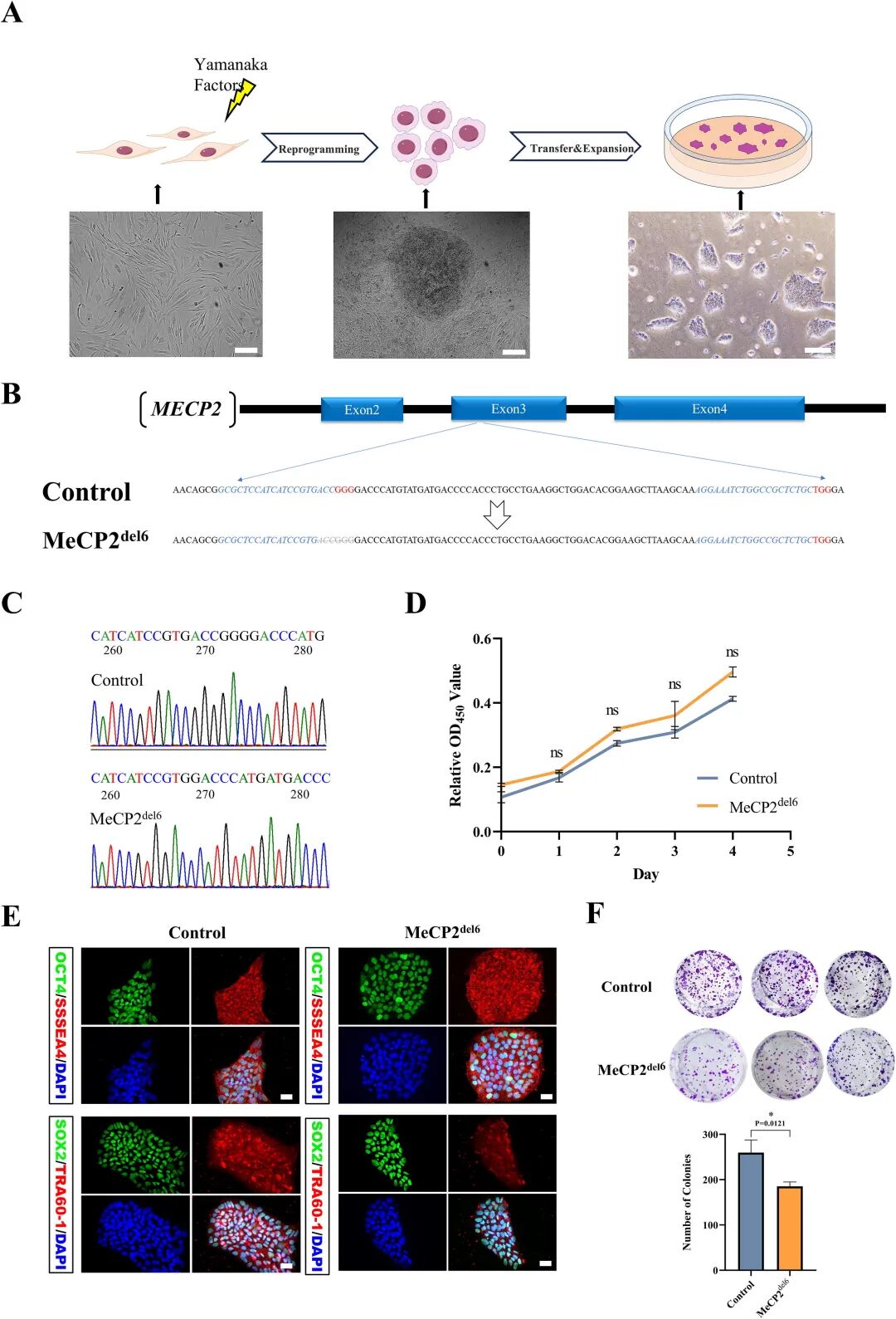
图 1:MeCP2 突变 iPSCs 的构建与表征
内容:展示从健康男性成纤维细胞重编程生成 iPSCs,通过 CRISPR-Cas9 引入 MeCP2 c.269_275del 突变( exon3 区域 6bp 缺失);验证突变 iPSCs 的多能性标志物(OCT4、SOX2 等)表达,克隆形成实验显示其单细胞存活率降低;核型分析证实染色体正常(46, XY)。
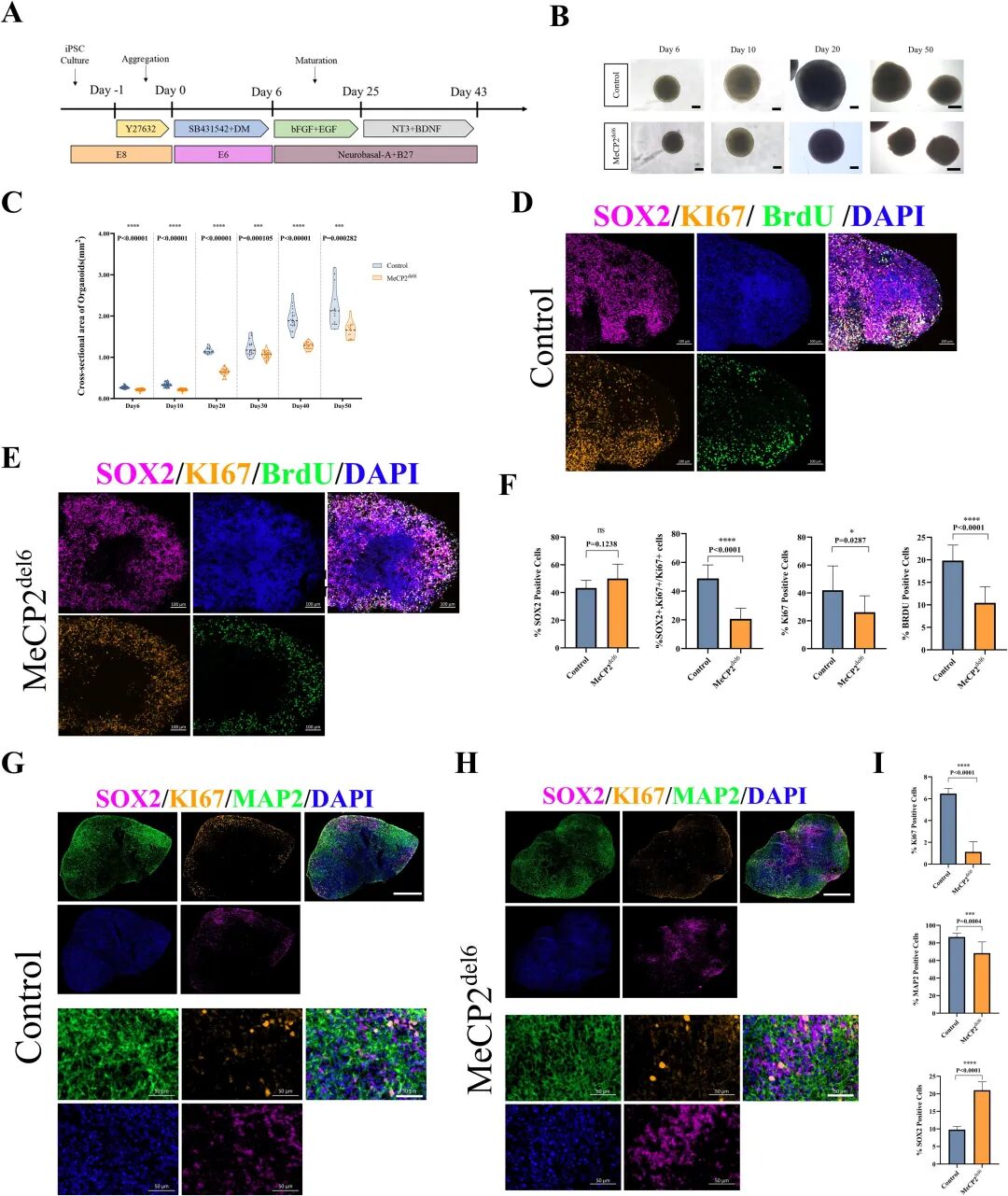
图 2:MeCP2 突变 COs 的生长与神经干细胞异常
内容:展示 COs 的诱导流程(双 SMAD 抑制剂诱导神经外胚层,bFGF/EGF 扩增神经干细胞,BDNF/NT3 促进分化);明场图像显示突变型 COs 在第 6-50 天体积显著小于对照组;免疫荧光显示突变型 COs 中 Ki67 + 增殖细胞、BrdU + 分裂细胞减少,SOX2 + 神经干细胞分化异常(成熟神经元 MAP2 + 细胞减少)。
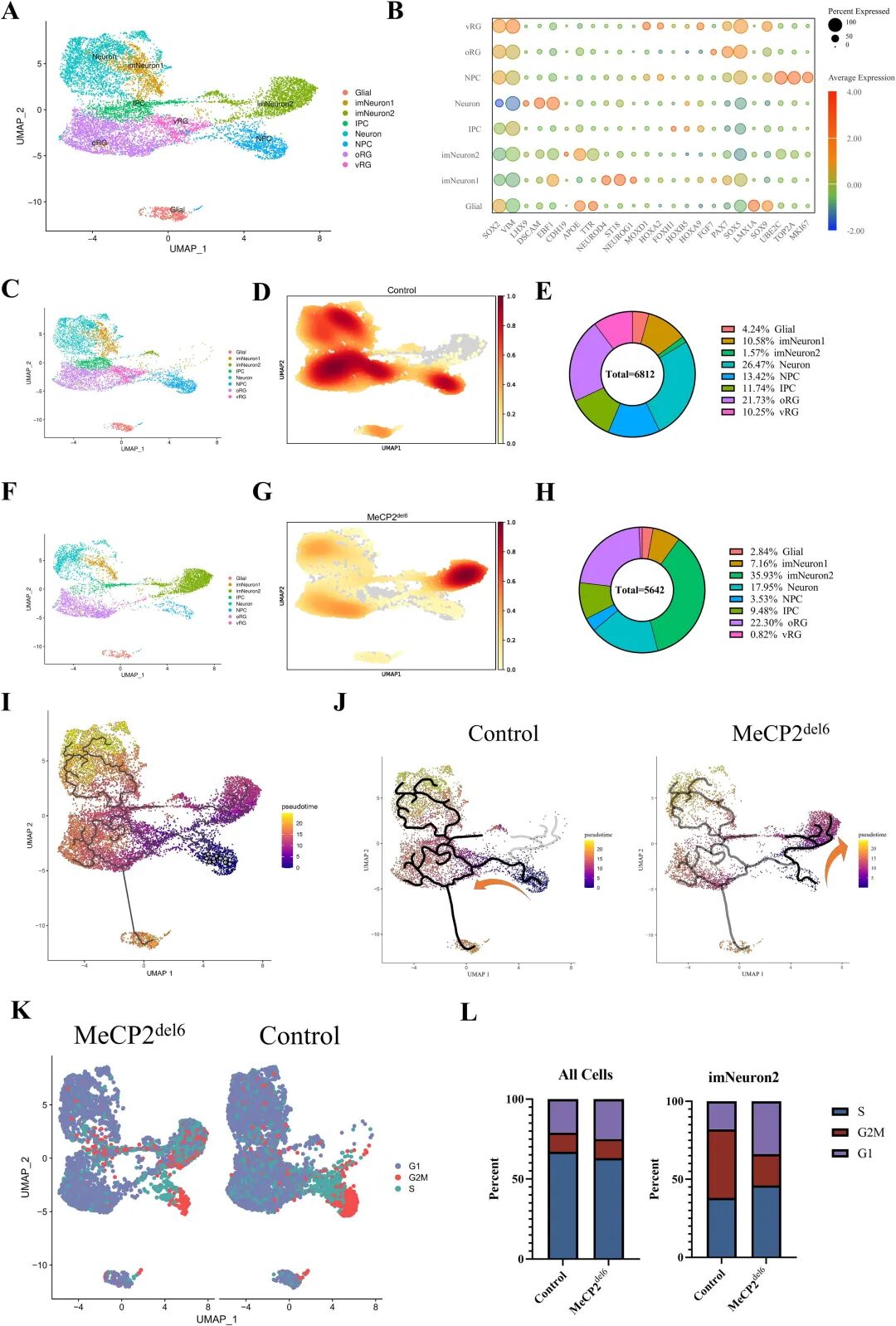
图 3:单细胞测序揭示突变型 COs 的细胞类型与分化轨迹异常
内容:UMAP 分析显示对照组与突变型 COs 的 13 个细胞集群(包括 NPC、vRG、成熟神经元等);突变型 COs 中 NPC 和 vRG 比例下降,未成熟神经元 imNeuron2 比例显著升高(35.93% vs 对照组 1.57%);伪时间分析显示突变型 COs 分化轨迹异常,imNeuron2 无法分化为成熟神经元;细胞周期分析显示 imNeuron2 的 G2/M 期比例降低,S 期阻滞。
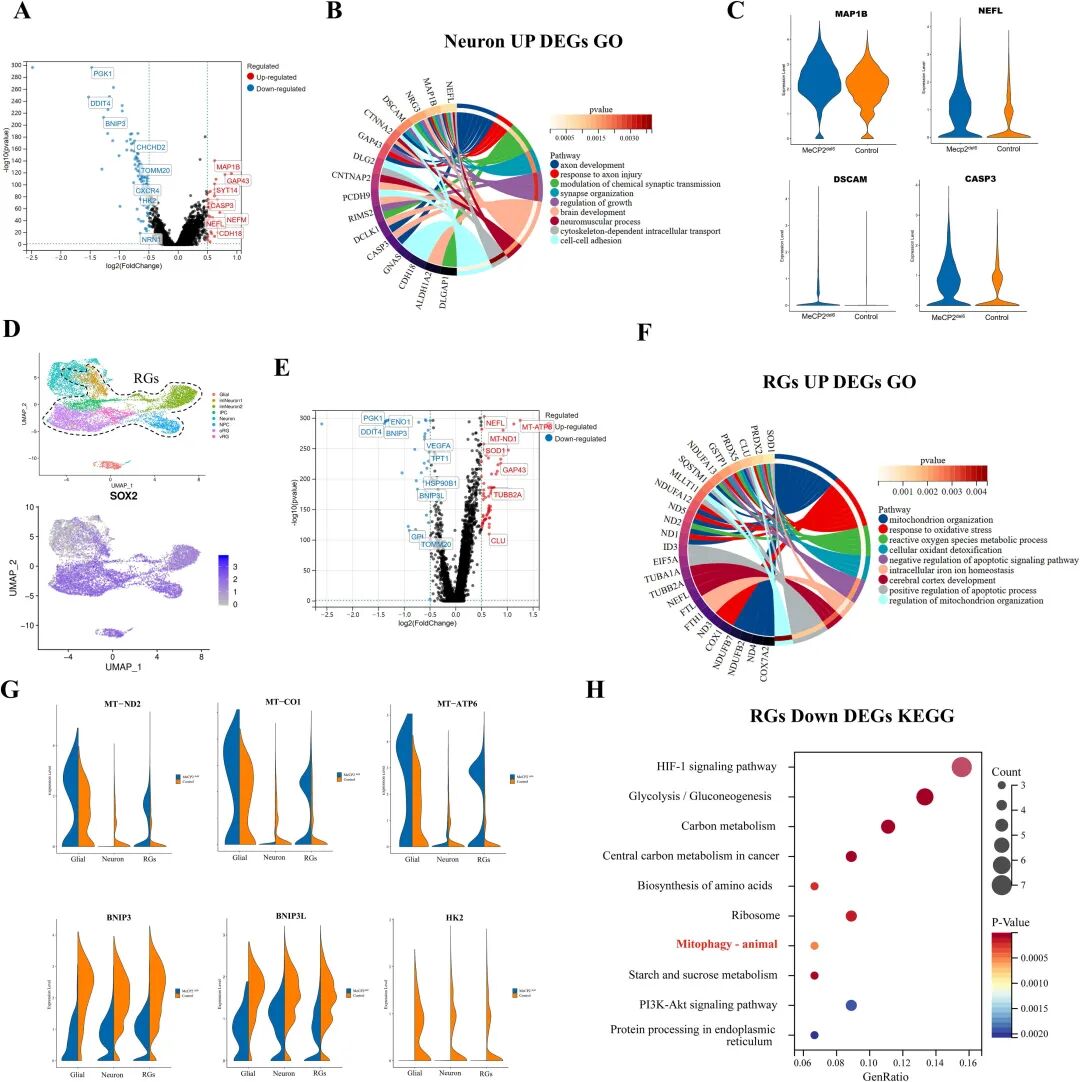
图 4:突变型 COs 的线粒体功能与自噬相关基因表达异常
内容:神经元集群中 DEGs 显示 MAP1B、DSCAM 等神经发育异常基因上调;径向胶质细胞(RGs)中 DEGs 富集线粒体组织、氧化磷酸化通路,mtDNA 基因(MT-CO1、MT-ATP6)表达异常;KEGG 分析显示 RGs 和神经元中自噬通路下调,BNIP3L 等线粒体自噬基因表达降低。
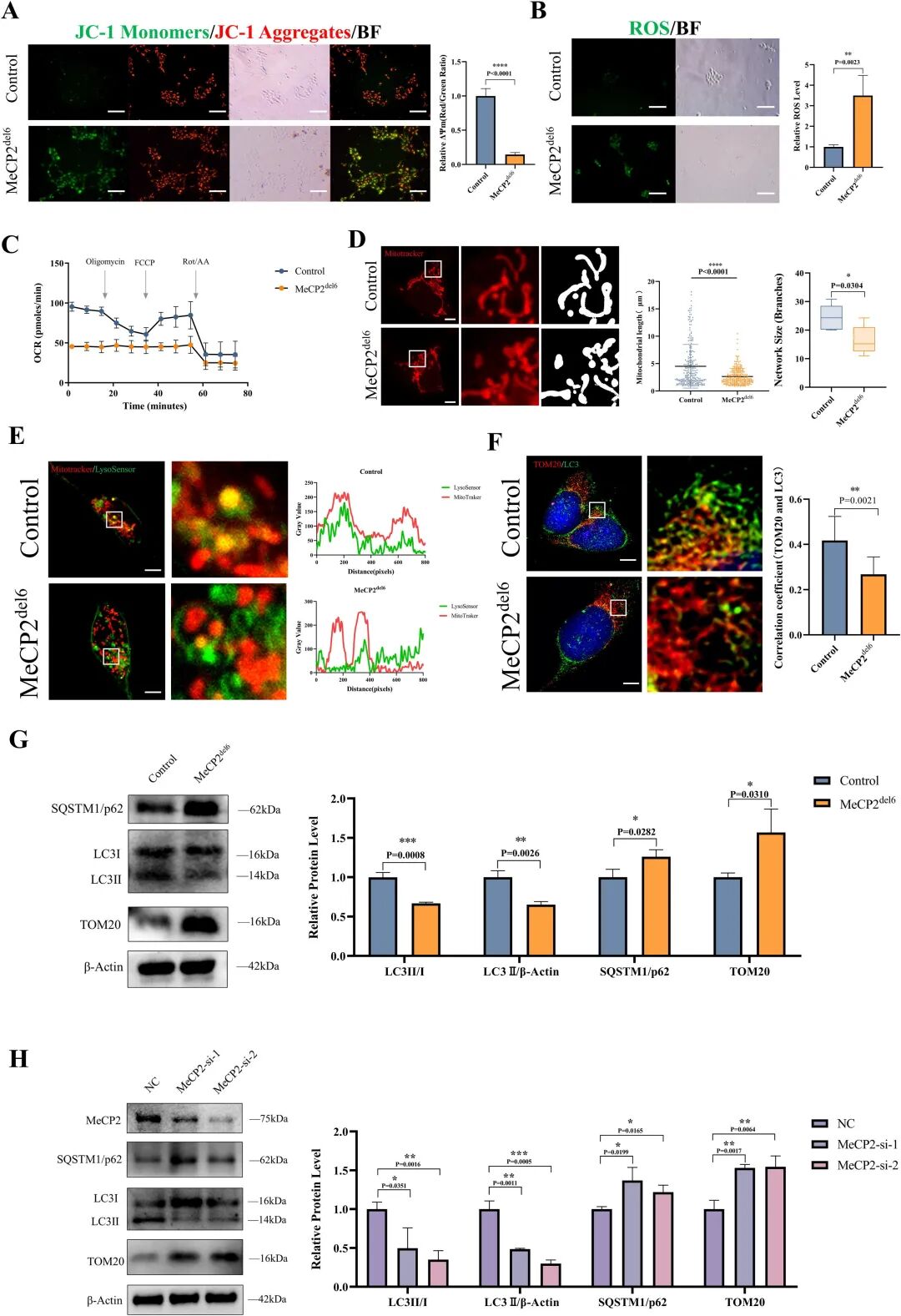
图 5:突变型 COs 的线粒体功能与自噬缺陷
内容:JC-1 染色显示突变型 COs 线粒体膜电位降低(绿色单体增多);ROS 检测显示荧光强度升高; Seahorse 实验显示氧消耗率、ATP 生成下降;线粒体形态分析显示突变型为短圆形碎片;免疫荧光显示 LC3 与 TOM20 共定位减少,Western blot 显示 LC3-II/I 比例下降、p62 和 TOM20 积累;MeCP2 敲除实验重现自噬缺陷。
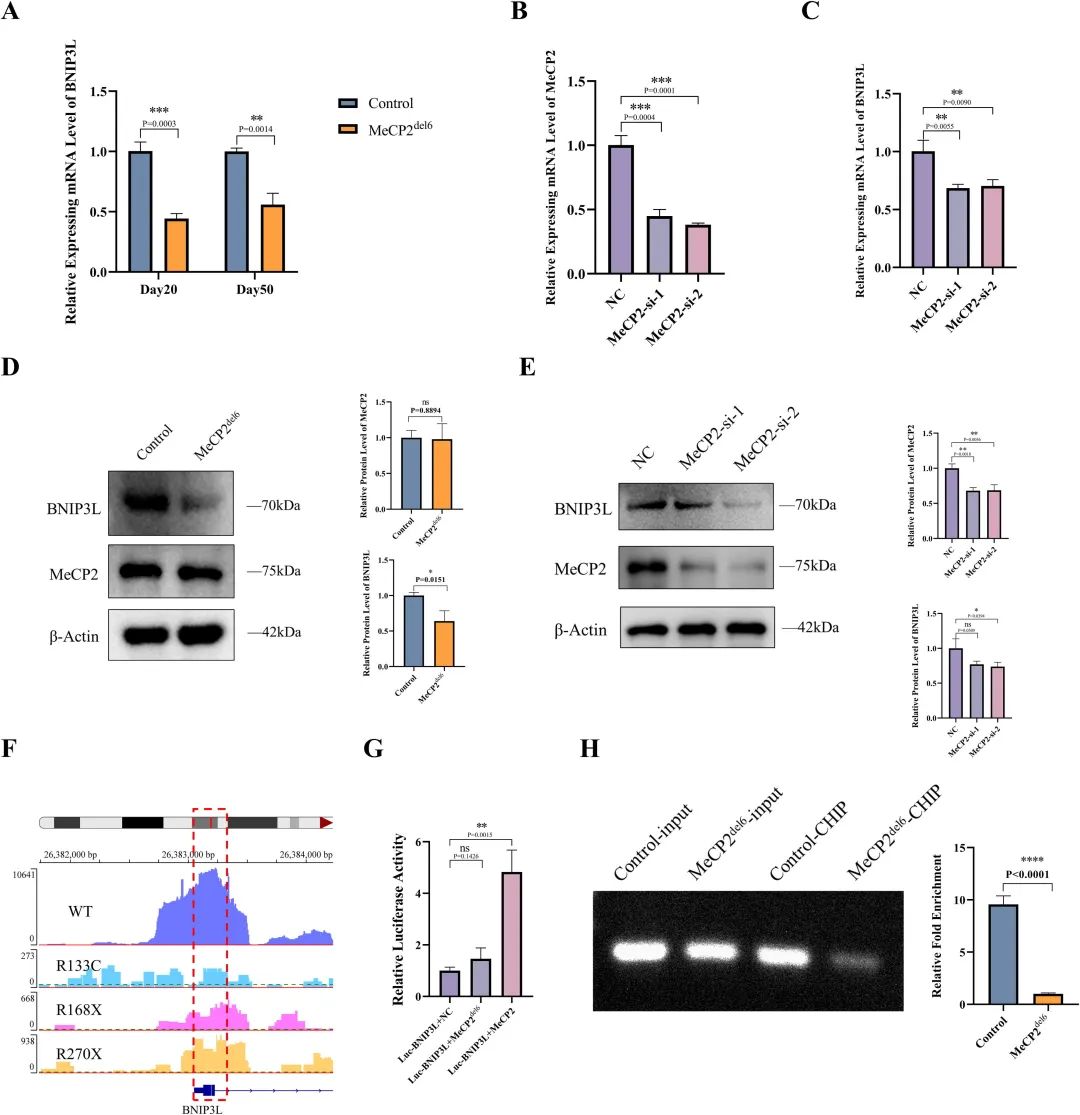
图 6:MeCP2 通过结合 BNIP3L 的 TSS 调控其转录
内容:qPCR 和 Western blot 显示突变型 COs 中 BNIP3L 在 mRNA 和蛋白水平均下调;CUT&Tag 数据显示 MeCP2 结合 BNIP3L 的 TSS,突变后结合信号减弱;双荧光素酶报告基因实验证实 MeCP2 促进 BNIP3L 转录,突变型无此作用;ChIP-qPCR 验证 MeCP2 在 BNIP3L TSS 的富集减少。
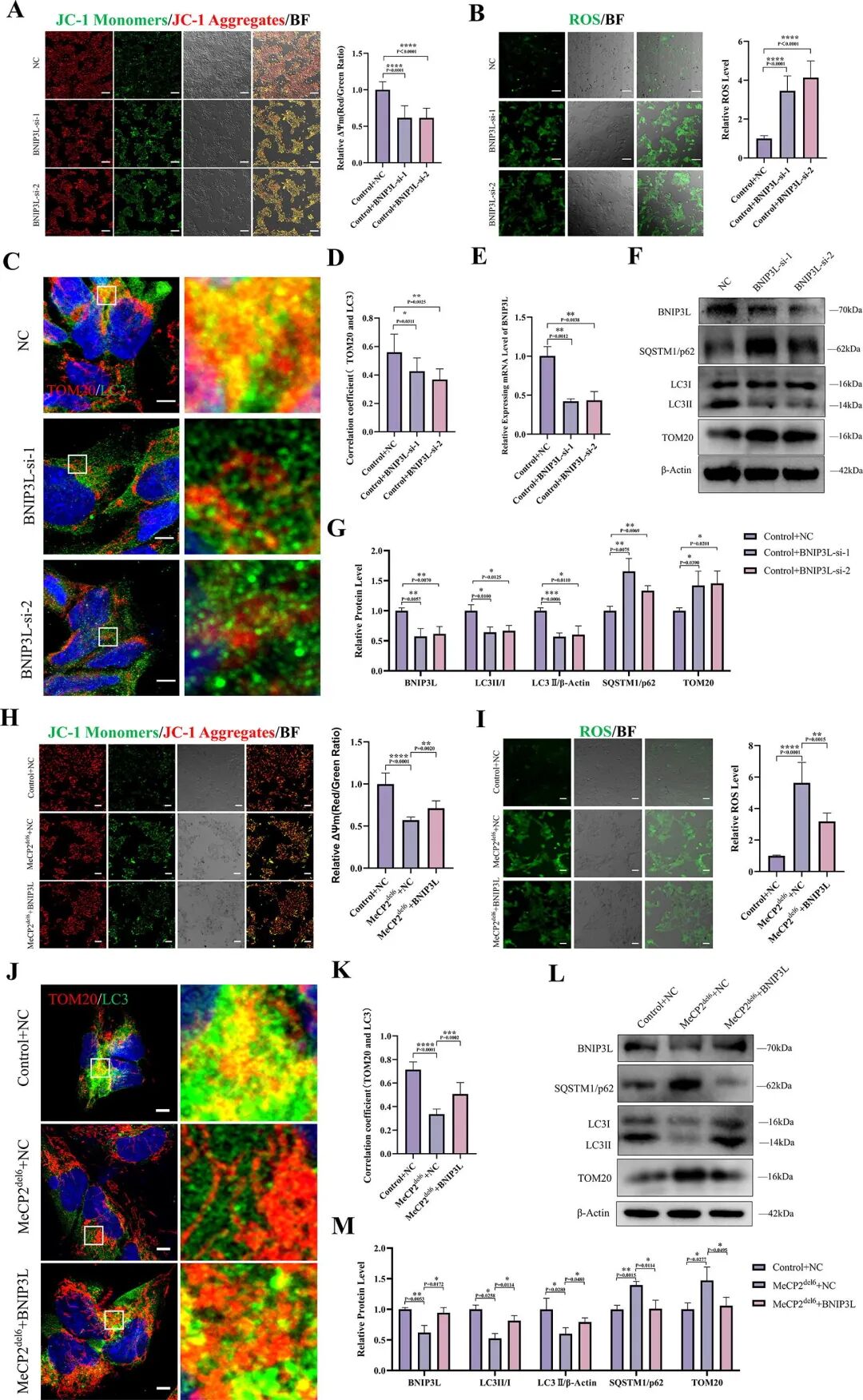
图 7:过表达 BNIP3L 恢复突变型 COs 的线粒体功能与自噬
内容:BNIP3L 敲除导致对照组 COs 出现线粒体膜电位降低、ROS 升高、LC3-TOM20 共定位减少;过表达 BNIP3L 使突变型 COs 的线粒体膜电位部分恢复、ROS 降低、LC3-TOM20 共定位增加;Western blot 显示 p62 和 TOM20 水平下降,证实自噬功能改善。
本研究通过 MeCP2 突变皮质类器官模型,证实 MeCP2 通过直接结合线粒体自噬受体 BNIP3L 的转录起始位点促进其表达,调控线粒体自噬;MeCP2 突变导致 BNIP3L 表达受抑,引发线粒体功能异常(膜电位降低、ROS 积累、形态碎片化)和自噬障碍,最终导致神经干细胞增殖分化异常及神经发育缺陷。过表达 BNIP3L 可部分逆转上述异常,为 Rett 综合征等 MeCP2 相关神经发育障碍提供了 “MeCP2-BNIP3L - 线粒体自噬” 的新发病机制和潜在治疗靶点。未来需结合体内模型验证,推动靶向线粒体自噬的临床转化。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:药物重定位发现蛋白酶体抑制剂可作为对抗三阴性乳腺癌类器官中炎症驱动化疗耐药的抗增殖剂研究