常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-12-15 17:30:40 细胞资源库平台 访问量:96
英文标题:An innovative and stable mRNA-LNP microneedle vaccine elicits humoral and multifunctional cellular immune responses
中文标题:一种创新且稳定的mRNA-LNP微针疫苗可引发体液和多功能细胞免疫反应
发表期刊:《Acta Pharmaceutica Sinica B》
影响因子:14.6
作者单位:
首都医科大学、北京药理与毒理学研究所等
作者信息:
Xiaoxuan Hong, Xianfu Li, Xiaolu Han, Jinghu Lou, Yue Li, Jintao Lin, Yi Cheng, Haonan Xing, Hui Zhang, Xiwei Wang, Shuang Zhang, Nan Liu, Zengming Wang, Chunying Cui, Aiping Zheng
1.mRNA疫苗的优势与挑战
mRNA疫苗具有快速开发、高效免疫诱导等优势,但其稳定性差,需超低温储存与运输,且依赖专业医护人员注射,限制了在资源匮乏地区的推广。
2.微针技术的潜力
微针可无痛穿透皮肤角质层,将疫苗递送至富含抗原呈递细胞的表皮/真皮层,诱导强效免疫反应,并可实现自我接种。
3.研究创新点
本研究开发了一种负载甘露糖修饰mRNA-LNP的可溶性微针疫苗,通过聚合物稳定技术,实现了在4°C和25°C下的长期稳定储存,并诱导了系统性体液免疫和肺部T细胞免疫。
1.mRNA-LNP的制备与表征
使用微流控技术制备LNP,优化DMG-PEG2000-甘露糖摩尔比(1.5%)。
通过DLS、TEM、RiboGreen试剂盒评估粒径、电位、包封率等。
2.微针制备与性能测试
采用3D打印PDMS模具与真空浇注法制备微针。
通过SEM、Micro-CT、OCT、荧光显微镜等评估形态、分布、穿透性与溶解性。
3.稳定性评估
在4°C和25°C下储存不同时间后,评估LNP的粒径、PDI、包封率、mRNA完整性及转染效率。
4.免疫学评价
使用BALB/c和H11-K18-hACE2小鼠模型。
通过流式细胞术、ELISA、ELISpot、ICS等方法评估体液免疫、T细胞活化、细胞因子分泌等。
5.假病毒攻击实验
使用SARS-CoV-2 D614G假病毒进行肺部攻击,评估疫苗保护效果。
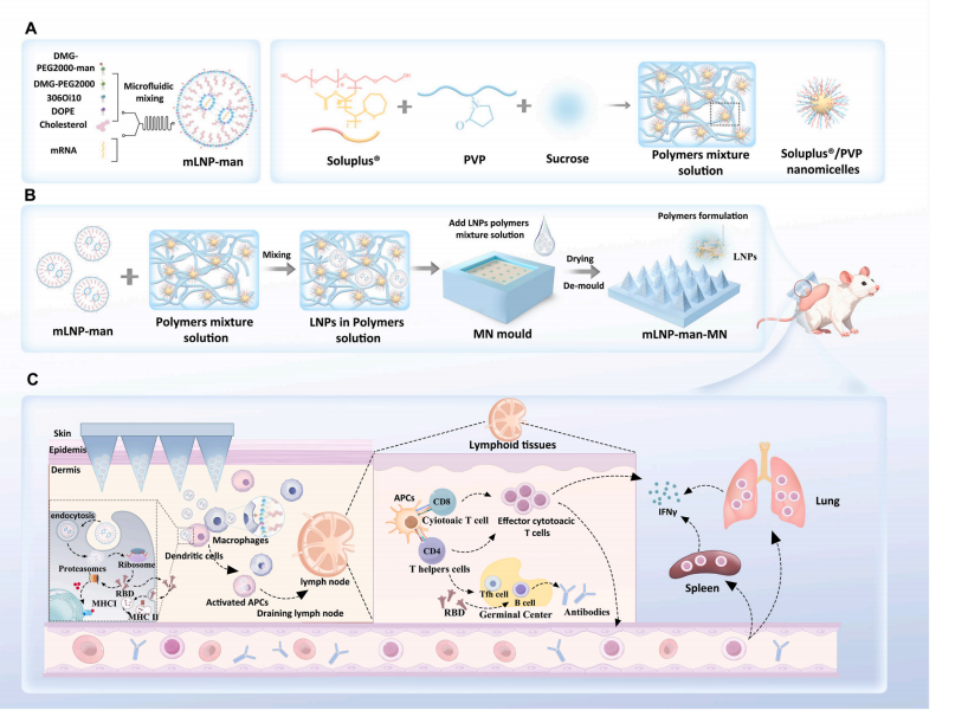
图1 创新性稳定化mRNALNP微针疫苗制备过程及体内免疫应答诱导示意图
(A)mLNP-man与聚合物混合溶液的组成示意图。
(B)mLNP-man疫苗负载微针(mLNP-man-MN)的制备示意图。
(C)mLNP-man-MN免疫诱导的体液免疫与多功能细胞免疫应答示意图。
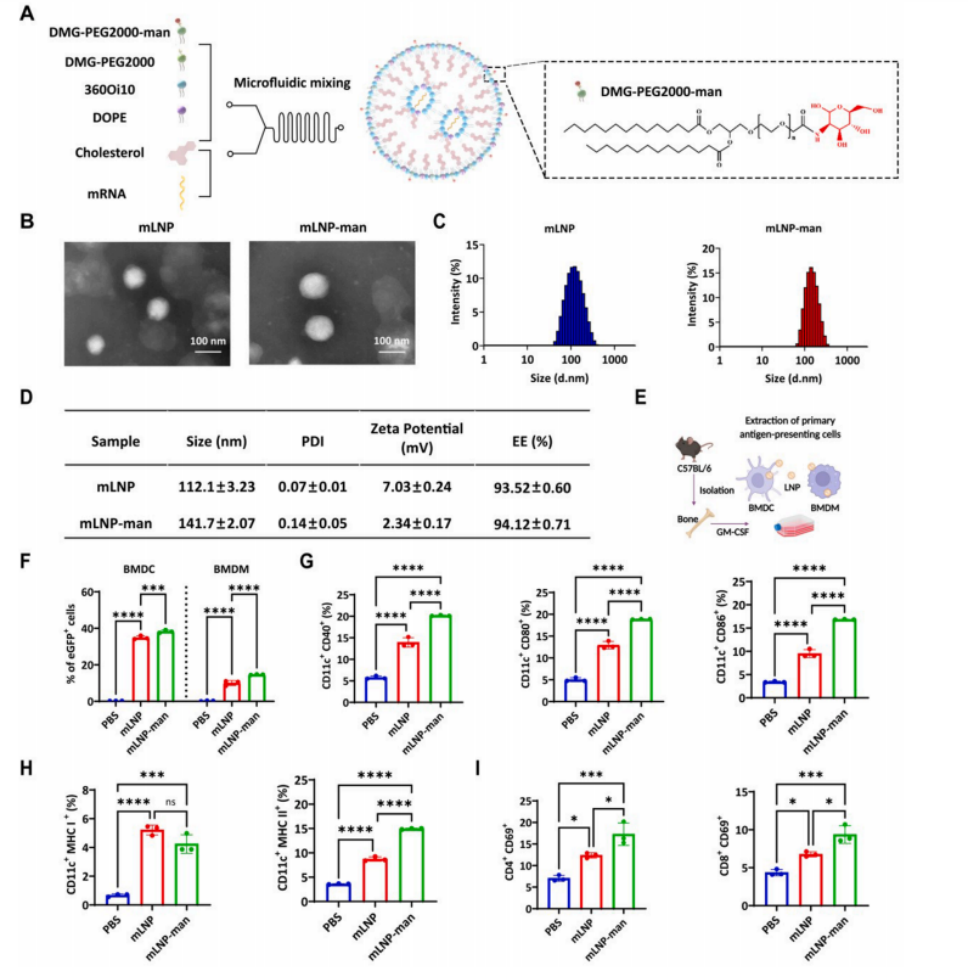
图2 mLNP-man的制备与表征
(A)mLNP-man的制备示意图及 DMG -PEG2000-man的结构。
(B)不同LNPs的代表性透射电镜图像。比例尺为100 nm。
(C)通过动态光散射法测定的不同LNPs的水动力学尺寸。展示了一个代表性结果。
(D)通过动态光散射法测定的不同LNPs的平均尺寸、多分散指数(PDI)和zeta电位。
(E)C57BL/6小鼠中BMDCs和BMDMs的诱导与提取示意图。
(F)流式细胞术分析转染LNPs后eGFP阳性细胞的百分比。
(G)流式细胞术分析LNPs疫苗在体外刺激BMDCs成熟的能力。
(H)柱状图显示BMDCs表面CD11c+ MHC I+ 和CD11c+ MHC II+ 表达的百分比。
(I)柱状图显示CD3+ T细胞中CD4+ CD69+ 和CD8+ CD69+ 细胞的百分比。数据以均值±标准差表示(n≥3)。显著性通过单因素方差分析和多重比较检验计算(ns,无显著性;*P<0.05,**P<0.01,***P<0.001,****P<0.0001)。
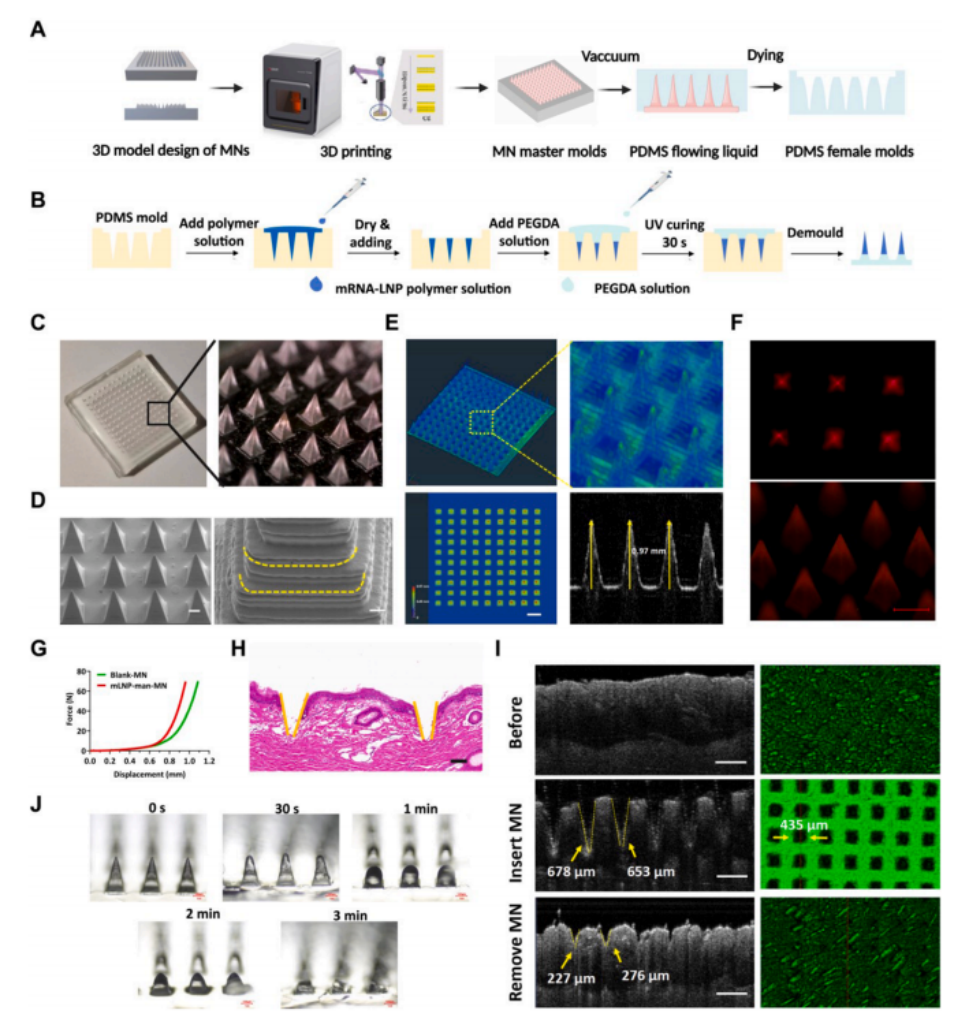
图3 mLNP-man-MN的制备与表征
(A)MN主模和 PDMS 女模的制备流程图。
(B)mLNP-man-MN制备过程的示意图。
(C)mLNP-man-MN的立体图像。
(D)mLNP-man-MN的SEM图像。左图比例尺为200 μm 。右图比例尺为10 μm 。
(E)mLNP-man-MN的微CT三维伪彩色图像。
(F)装载DiD标记mLNP-man的mLNP-man-MN的荧光显微镜图像。比例尺为200 μm 。
(G)空白MN和mLNP-man-MN的机械强度。
(H)mLNP-man-MN穿透猪皮的H&E图像。比例尺为100 μm 。
(I) mLNP-man-MN植入猪皮前后的OCT图像。上:MN植入猪皮前的OCT图像;中:MN植入猪皮后的OCT图像;下:MN移除后猪皮的OCT图像。比例尺为500 μm 。(J) mLNP-man-MN的溶解过程。比例尺为100 μm 。
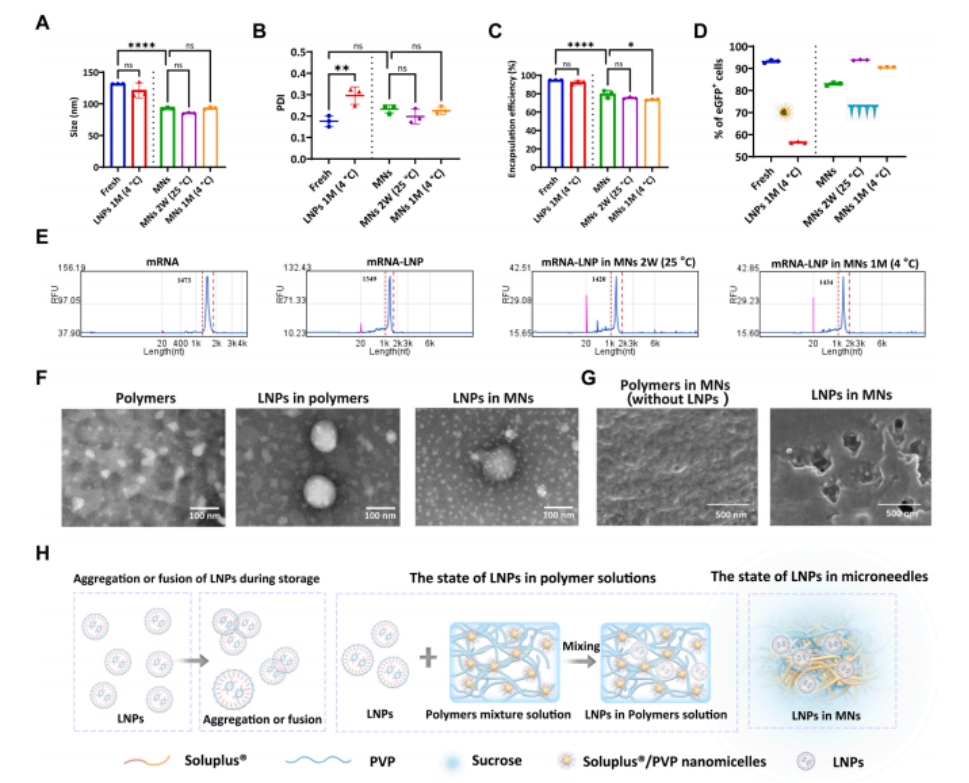
图4 mRNA-LNPs在微囊中的稳定性表征
(A)新鲜LNPs、储存1个月(4°C)的LNPs、储存2周(25°C)的微囊中LNPs以及储存1个月(4°C)的微囊中LNPs的粒径、(B) PDI和(C) 包封率。
(D)新鲜LNPs、储存1个月(4°C)的LNPs、储存2周(25°C)的微囊中LNPs以及储存1个月(4°C)的微囊中LNPs在 HEK -293T细胞中的转染效率。
(E)使用毛细管电泳分析新鲜LNPs、储存2周(25°C)的微囊中LNPs和储存1个月(4°C)的微囊中LNPs的mRNA片段。
(F)聚合物、液态LNPs在聚合物中、LNPs在微囊中的TEM图像。比例尺为100 nm。
(G)聚合物微囊(不含LNPs)和LNPs微囊横截面的SEM图像。比例尺为500 nm。
(H) 储存期间LNPs聚集和融合的示意图,以及LNPs在聚合物中的稳定性。数据以均值±标准差表示(n=3)。显著性通过单因素方差分析和多重比较检验计算(ns,无显著性;*P<0.05,**P<0.01,***P<0.001,****P<0.0001)。M,月;W,周。
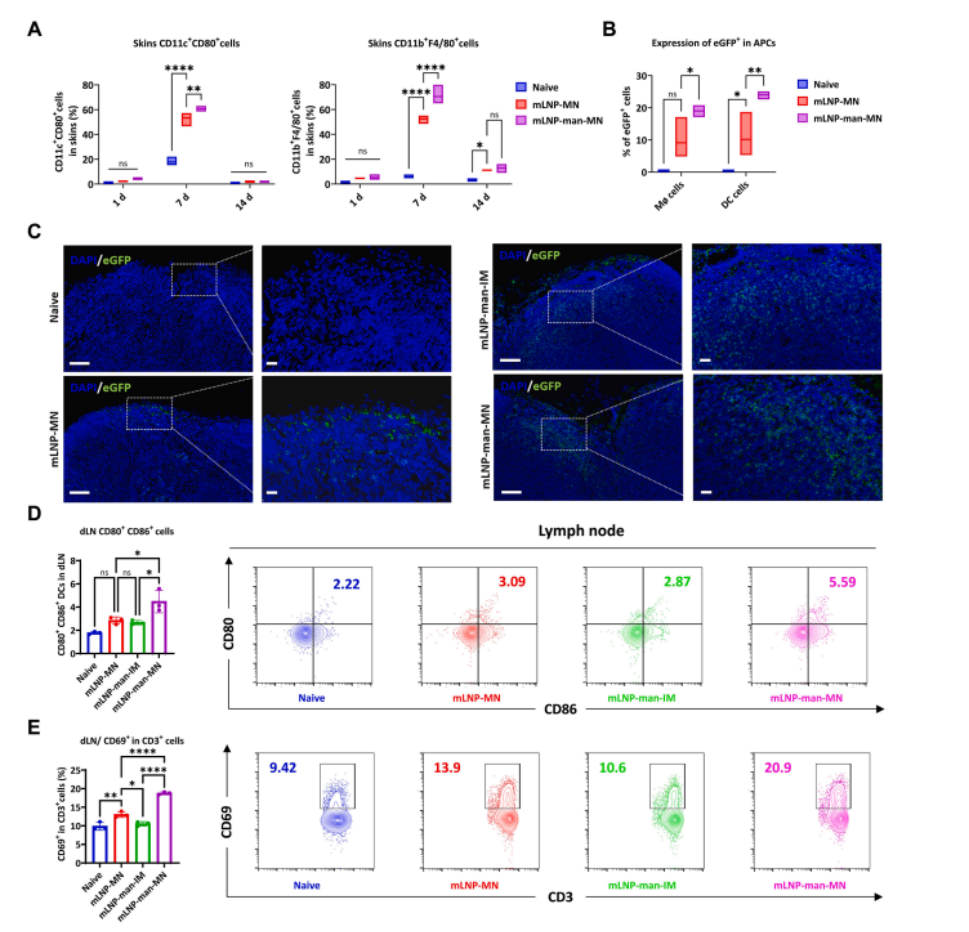
图5 mLNP-man招募的APC和MN免疫后激活的dLNs
(A)箱线图显示MN免疫后1-14天小鼠给药部位的CD11c+ CD80+(左)和F4/80+ CD11b+(右)细胞数量。
(B)给药部位APC中eGFP+的表达。
(C)IM或MN免疫后24小时引流至淋巴结并表达eGFP+的LNPs的免疫荧光。左图比例尺为100 μm 。右图比例尺为20 μm 。
(D)左图,柱状图显示CD11c+淋巴结细胞中CD80+ CD86+细胞的比例。右图, BALB /c小鼠免疫7天后淋巴结中DC成熟(CD80+ CD86+)的代表性流式细胞术轮廓图。
(E) 左图,柱状图显示淋巴结细胞中CD3+ CD69+细胞的频率。右图, BALB /c小鼠免疫7天后淋巴结中T细胞活化(CD3+ CD69+)的代表性流式细胞术轮廓图。数据以均值±标准差表示(n=3)。显著性通过单因素方差分析和多重比较检验计算(ns,无显著性;*P<0.05,**P<0.01,***P<0.001,****P<0.0001)。
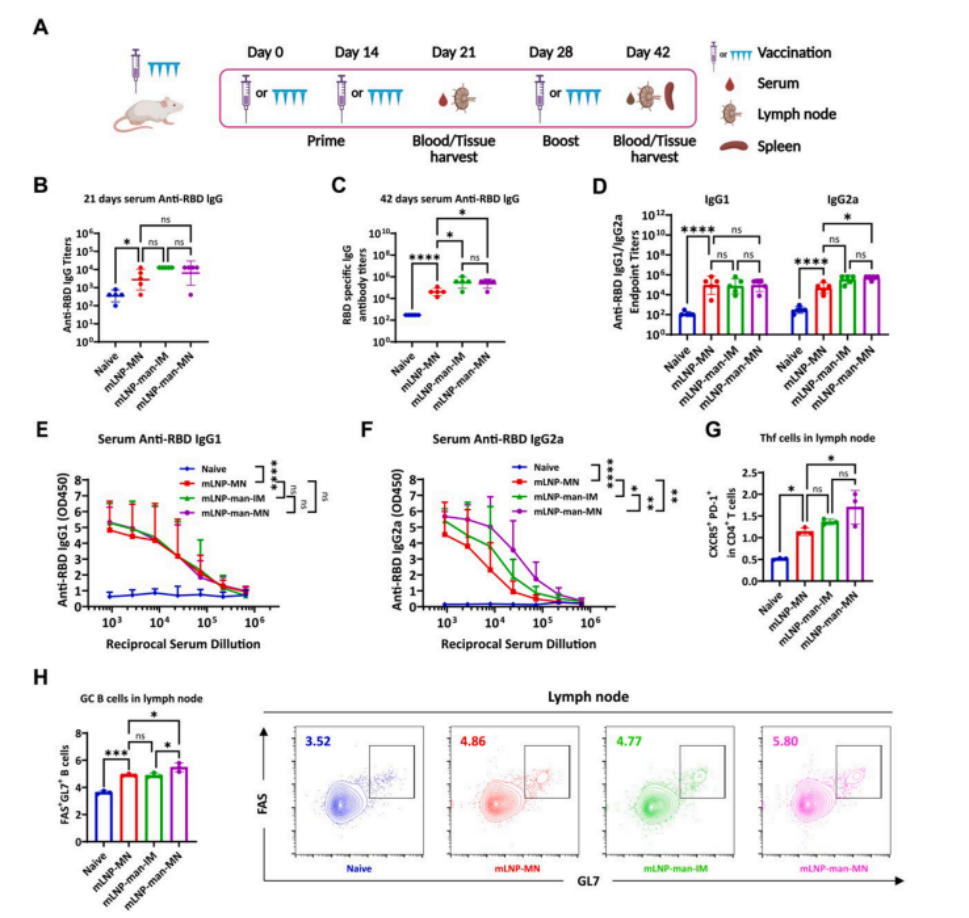
图6 mLNP-man-MN疫苗在小鼠中诱导了强烈的 RBD 特异性抗体反应
(A)动物免疫的示意图。
(B,C)在第21天和第42天,通过 ELISA 测定小鼠血清中的IgG滴度。
(D) 在第42天测量了 RBD 特异性IgG2a与IgG1终点血清滴度。
(E) 免疫42天后小鼠血清中的 RBD 蛋白特异性IgG1滴度和(F) IgG2a滴度。数据以均值±标准差表示(n ≥ 5)。
(G) 柱状图显示MN或IM免疫21天后淋巴结Thf细胞的频率。数据以均值±标准差表示(n ≥ 3)。
(H) 左图柱状图显示MN或IM免疫21天后淋巴结FAS+ GL7+细胞的频率。右图是淋巴结FAS+ GL7+细胞的代表性流式细胞术轮廓图。数据以均值±标准差表示(n ≥ 3)。(E) 和(F) 使用双向混合方差分析后Holm-Sidak检验处理效应。其他图片使用单因素方差分析和Tukey检验(ns,无显著性;*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001)。
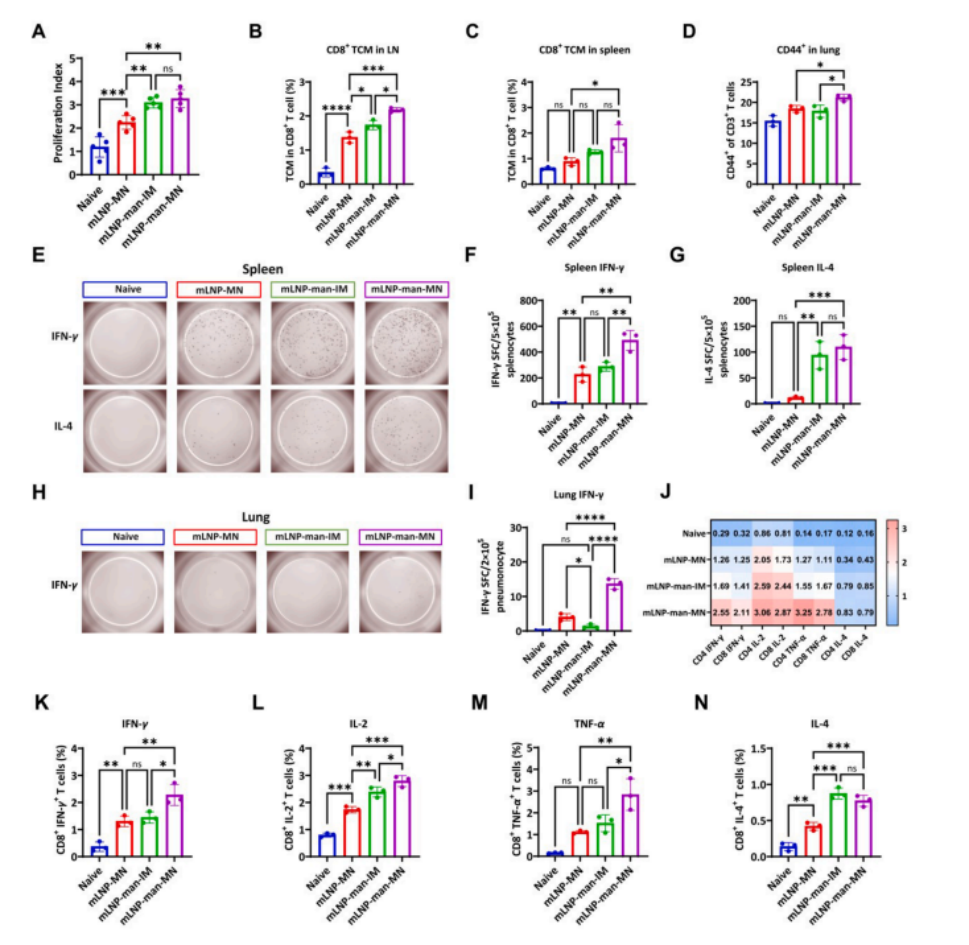
图7 mLNP-man-MN疫苗诱导更强的多功能T细胞反应
(A)使用 CCK -8试剂盒体外抗原刺激后脾细胞的增殖情况。数据以均值±标准差表示(n ≥ 5)。
(B)柱状图显示淋巴结中CD8+ TCM细胞的频率,(C) 脾脏中CD8+ TCM细胞的频率。
(D) 柱状图显示肺部CD3+ CD44+细胞的频率。
(E) 使用第42天分离的脾淋巴细胞进行抗原特异性 IFN - γ(上)和IL-4(下)ELISpot检测,每孔5×10^5脾细胞。
(F) 肺细胞产生 IFN - γ 和(G) IL-4的SFCs定量柱状图。(H) 肺细胞产生 IFN - γ 的SFCs定量柱状图。
(I) 免疫后第42天小鼠肺淋巴细胞的 IFN - γ ELISpot检测结果,每孔2×10^5肺细胞。
(J) 在 RBD 肽池刺激后,免疫后第42天通过热图显示脾脏中多功能T细胞反应。(K-N)免疫后第42天脾脏中 RBD 特异性 IFN - γ +、 TNF - α +、IL-2+或IL-4+ CD8+ T细胞的比例柱状图。数据以均值±标准差表示(n ≥ 3)。组间比较采用单因素方差分析和Tukey检验(ns,无显著性;*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001)。
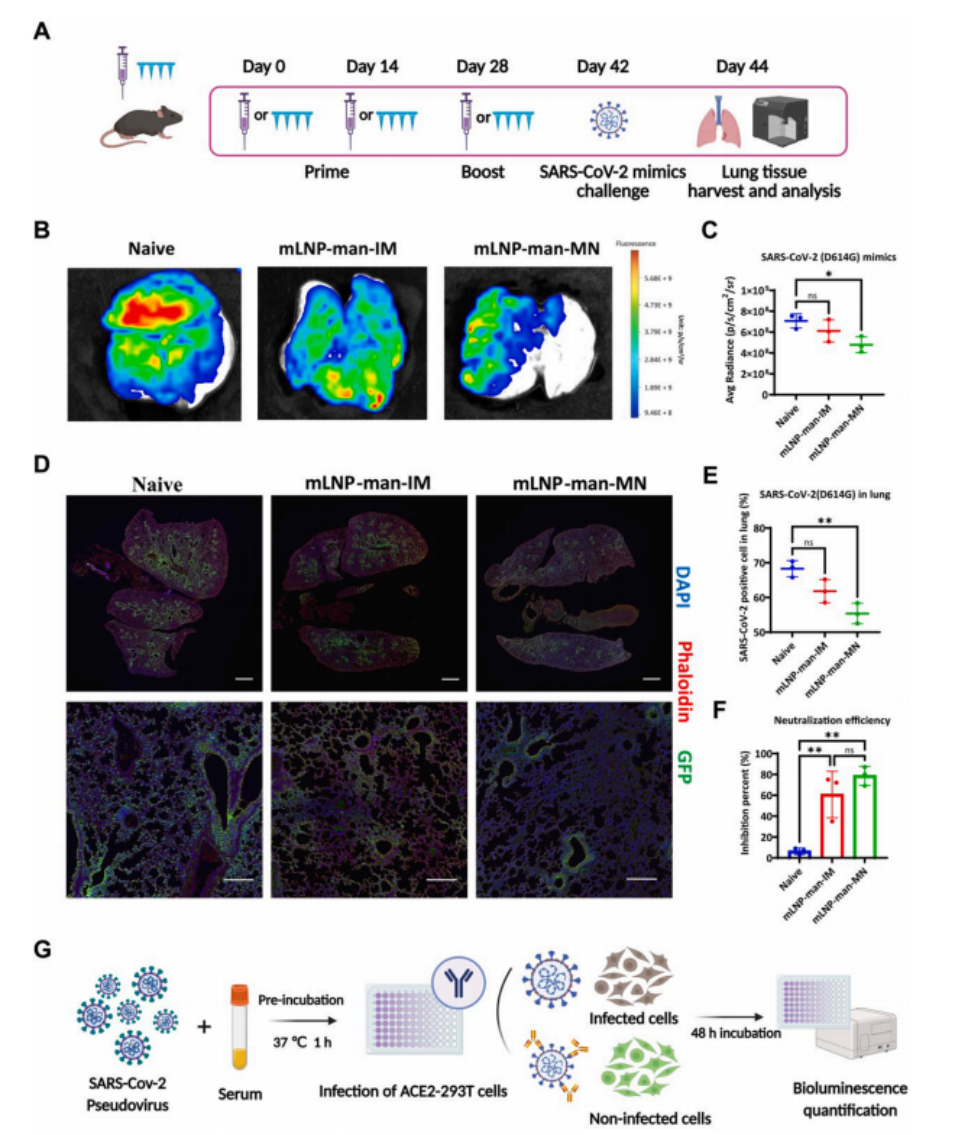
图8 H11-K18-hACE2小鼠假病毒攻击挑战
(A)H11-K18-hACE2小鼠免疫和假病毒攻击实验的示意图。
(B)假病毒攻击肺组织后第2天肺组织的离体成像,以检测 GFP 的平均荧光强度(×103 p/s/cm2 /sr)。
(C)小鼠肺组织中 GFP 荧光强度的定量分析。
(D)肺组织的免疫染色成像。顶部图像的比例尺为2 mm。底部图像的比例尺为200 μm 。(E) 通过流式细胞术验证各组小鼠肺细胞中 GFP 阳性表达率。
(F) 免疫第42天时,1:100稀释的小鼠血清对SARS-CoV-2 D614G假病毒的中和效率。数据以均值±标准差表示(n ≥ 3)。
(G) SARSCoV-2 D614G假病毒中和检测原理示意图。组间比较采用单因素方差分析和Tukey检验(ns,无显著性;*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001)。
1.稳定性显著提升:mRNA-LNP在微针中可在25°C稳定2周,4°C稳定1个月,保持理化性质与生物活性。
2.强效免疫诱导:微针递送mLNP-man可诱导高水平的体液免疫(IgG、IgG2a)与细胞免疫(记忆T细胞、多功能T细胞)。
3.肺部免疫优势:相较于肌肉注射,微针免疫可诱导肺部CD44⁺记忆T细胞与IFN-γ分泌,提供更好的呼吸道病毒防御。
4.保护效果明确:在假病毒攻击实验中,微针免疫组肺部感染率显著降低,血清中和抗体效价高。
本研究提出了一种可自接种、无需冷链、兼具稳定性与强免疫原性的mRNA-LNP微针疫苗平台,为全球疫苗普及、尤其是资源匮乏地区提供了可行的技术路径,也为未来应对新发呼吸道传染病疫苗设计提供了新思路。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:中国 ICC 研究新工具!全新肝内胆管癌细胞系 ICC-X2 建立,特性稳定且成瘤率 100%
下一篇:肺动脉高压新靶点!Cavin-1通过竞争性结合 CAV1 抑制 BMP/Smad 信号