常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-10-14 09:00:00 细胞资源库平台 访问量:130
检测细胞株广泛应用于药物发现、抗体开发、基因研究和毒性评估等领域。基于D-Luciferase的报告基因细胞株及其荧光素酶检测方法在药物初筛/复筛、表位竞争、药物生物活性检测等多方面展现了广泛的应用潜力。报告基因法已被药典收录,为国家认可的检测方法。报告基因细胞株多用于监测特定的生物过程或信号通路。
HEK293细胞因子报告基因细胞株是以HEK293为工具细胞,采用慢病毒感染的方式构建,不仅能够稳定表达细胞因子受体蛋白,并且能够表达荧光素酶报告基因,是基于转录因子信号通路构建的荧光素酶报告基因细胞系。当细胞因子结合受体蛋白后,细胞因子与受体蛋白相互作用,激活转录因子信号通路,从而激活荧光素酶的表达。荧光信号的强弱即代表信号通路的激活效果,因此可用于相关药物的体外效果评价,筛选抗体以及筛选信号通路的激活剂或抑制剂。
英文标题:TGF-β–SMAD–miR-520e axis regulates NSCLC metastasis through a TGFBR2-mediated negative-feedback loop
中文标题:TGF-β-SMAD-miR-520e 轴通过 TGFBR2 介导的负反馈环调控非小细胞肺癌(NSCLC)转移
发表期刊:
Carcinogenesis
影响因子:2.9
作者单位:
1.Medical Biology Department, School of Medicine, Pamukkale University, Kinikli, Denizli, Turkey
2.ALTAY Biopharma, San Bruno, CA, USA
3.Pathology Department, Antalya Training and Research Hospital, Antalya, Turkey
作者信息:
Hakan Kucuksayan, Sakir Akgun, Osman Nidai Ozes
非小细胞肺癌(NSCLC)是肺癌主要亚型(占比 84%),转移是导致患者 5 年生存率 <15% 的核心原因。转化生长因子 -β(TGF-β)通路在癌症中具有 “双重角色”:既能通过诱导上皮 - 间质转化(EMT)促进转移,也能通过上调 p21 诱导 G1 期阻滞抑制增殖。TGF-β 受体 2(TGFBR2)是该通路的关键分子,在 40%-80% 的 NSCLC 中下调,但机制未明 —— 此前研究显示小细胞肺癌(SCLC)中 TGFBR2 下调源于 DNA 甲基化,而 NSCLC 中甲基化水平低,推测存在 miRNA 介导的调控缺口。本研究旨在明确 NSCLC 中 TGFBR2 下调的 miRNA 机制,发现 TGF-β-SMAD-miR-520e 轴通过负反馈环调控 TGFBR2,进而影响 NSCLC 转移。
细胞培养与转染:培养 A549、293T、H1703 等细胞,用 Dharmafect-2 转染 miR-520e 模拟物(50nM)、抑制剂(100nM)及对照,用 SB431542(TGF-β 受体激酶抑制剂)阻断 TGF-β 通路。
靶标验证:构建野生型 / 突变型 TGFBR2 3′-UTR 双荧光素酶报告载体,共转染 293T 细胞,检测 luciferase 活性验证 miR-520e 与 TGFBR2 的直接结合。
基因 / 蛋白检测:用 miRNeasy 试剂盒提取 RNA,qPCR 检测 miR-520e 及 TGFBR2 mRNA 水平(内参分别为 Snord、β-actin);免疫印迹(RIPA 裂解液)检测 TGFBR2、SMAD2/3、EMT 标志物(E - 钙粘蛋白、N - 钙粘蛋白等),Image Studio 定量条带。
功能实验:MTT 法检测细胞增殖;Transwell 实验(8μm 孔)检测迁移,Matrigel 包被 Transwell 检测侵袭;免疫荧光(Alexa Fluor 标记二抗)观察 SMAD2/3 核定位及 EMT 标志物分布。
ChIP-PCR:用 ChIP-IT® Express 试剂盒,抗 SMAD2/3 抗体富集染色质,qPCR 验证 miR-520e 启动子区的 SMAD 结合位点(-822、-3500、-4164kb)。
临床样本分析:收集 21 例 NSCLC 石蜡包埋组织(13 例非转移、8 例转移),qPCR 检测 miR-520e 与 TGFBR2 表达,Kaplan-Meier 分析生存相关性(kmplot 数据库)。
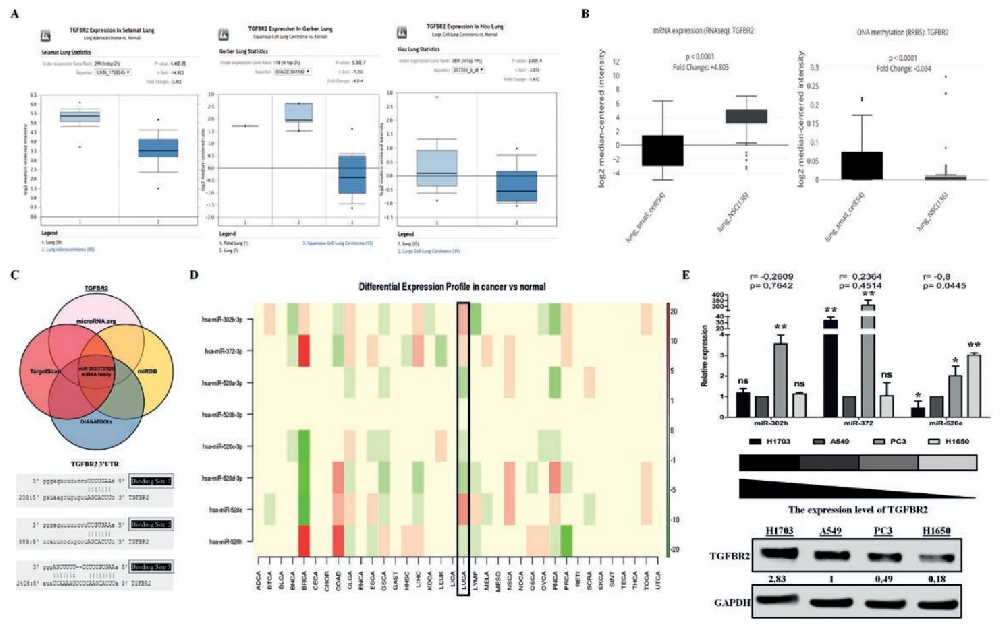
图1:miR-520e 与 TGFBR2 在 NSCLC 中呈负相关
Oncomine 数据库显示,所有 NSCLC 亚型(腺癌、鳞癌、大细胞癌)的 TGFBR2 表达均低于正常肺组织;CCLE 数据库显示,NSCLC 中 TGFBR2 甲基化水平显著低于 SCLC,排除甲基化介导的下调;TargetScan 等数据库预测 TGFBR2 3′-UTR 存在 miR-302/520 家族结合位点;dbDEMC.v2 数据库及 qPCR 验证,仅 miR-520e 在 NSCLC 细胞(A549、H1703 等)中高表达,且与 TGFBR2 蛋白水平呈负相关;CCLE 数据库 30 株 NSCLC 细胞进一步证实二者负相关。
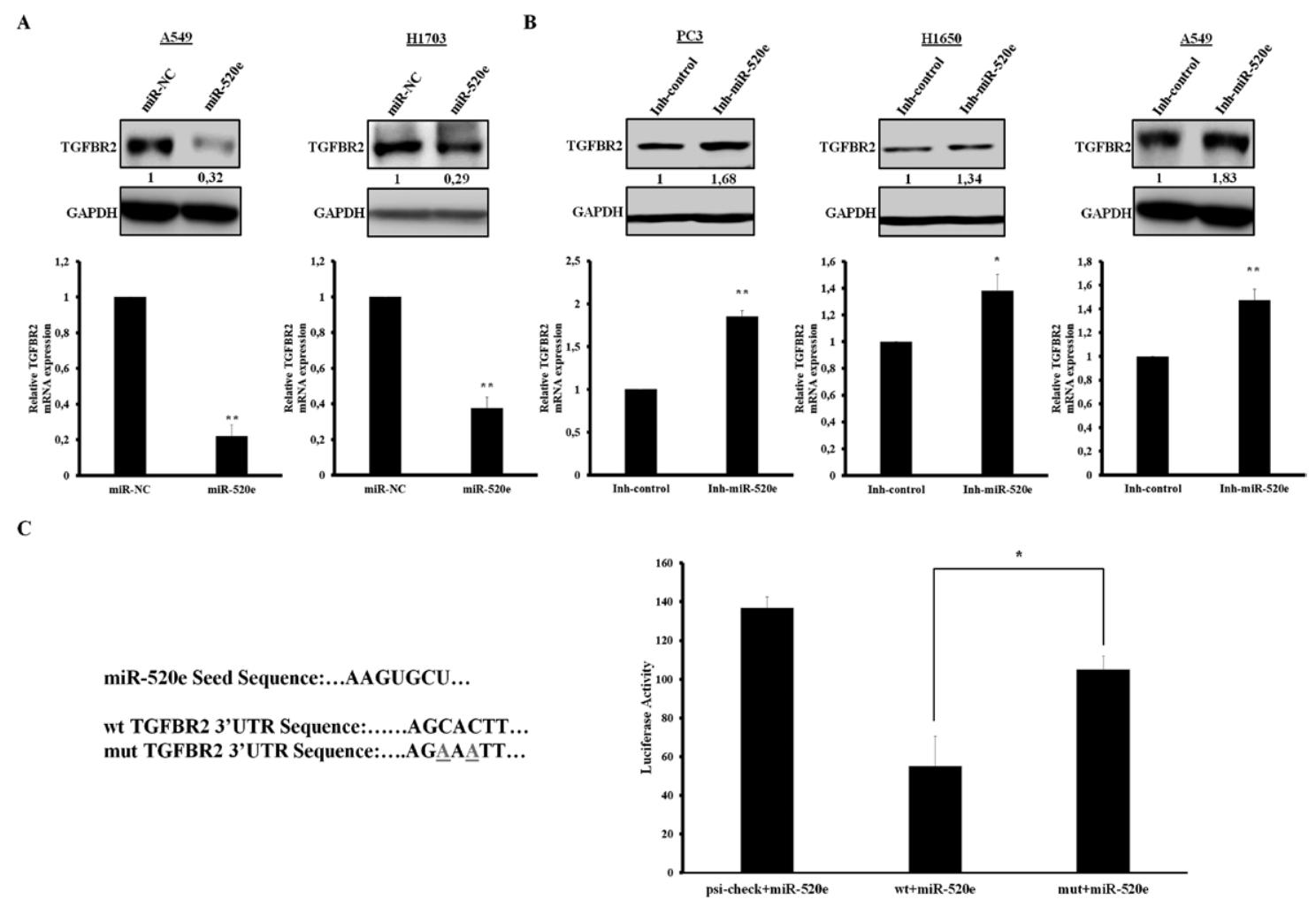
图2:TGFBR2 是 miR-520e 的直接靶标
转染 miR-520e 模拟物可显著降低 A549、H1703 细胞中 TGFBR2 的 mRNA 和蛋白水平,转染抑制剂则显著升高 A549、H1650 细胞中 TGFBR2 表达;双荧光素酶实验显示,miR-520e 可使野生型 TGFBR2 3′-UTR 的 luciferase 活性降低 50%,突变型无显著变化,证实二者直接结合。
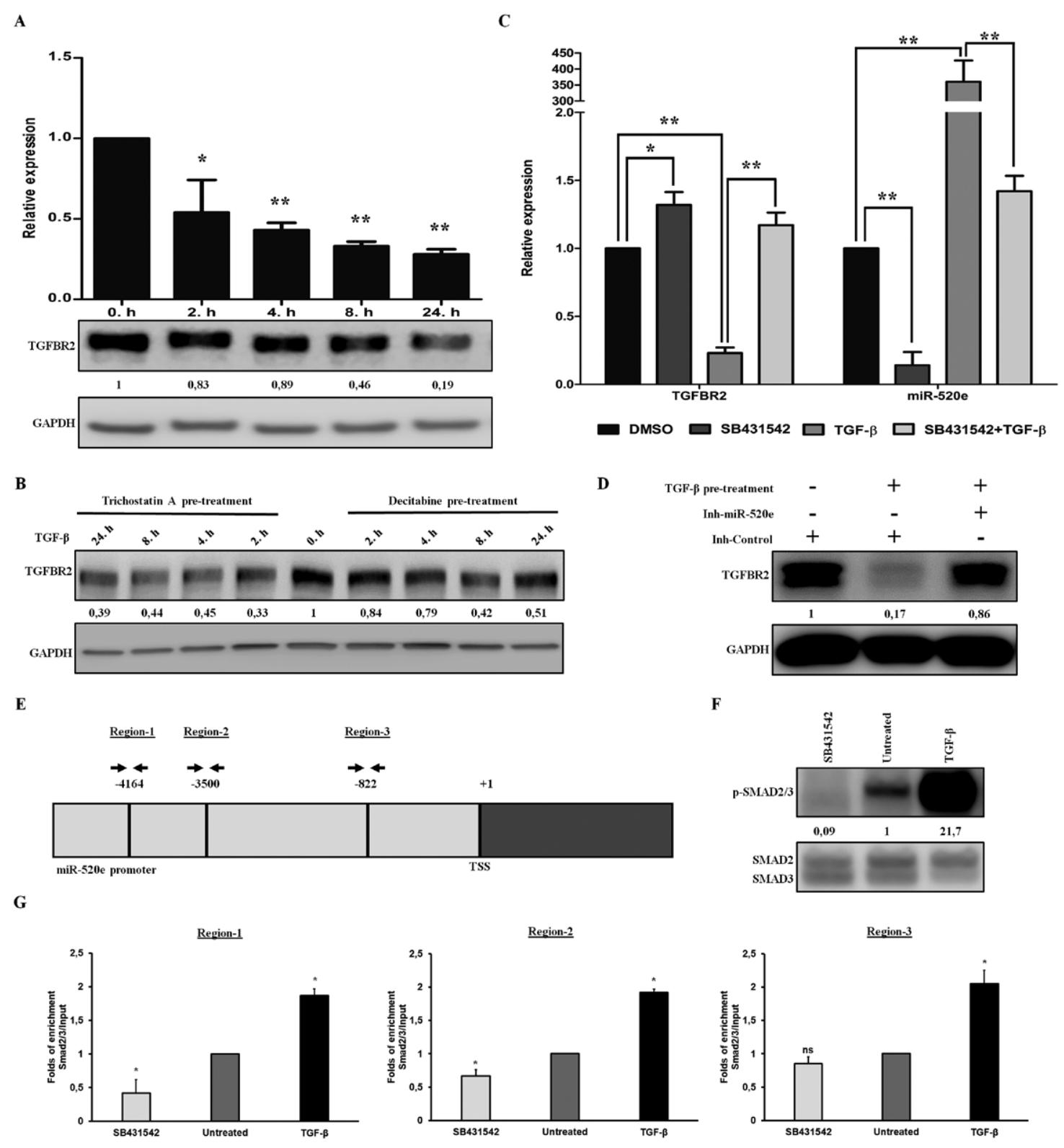
图3:TGF-β 通过 SMAD2/3 激活 miR-520e,下调 TGFBR2
TGF-β 刺激 A549 细胞后,TGFBR2 mRNA / 蛋白水平呈时间依赖性下降,miR-520e 水平显著升高,且 SB431542 可逆转该效应;组蛋白去乙酰化酶抑制剂 TSA 不影响 TGF-β 介导的 TGFBR2 下调,DNA 甲基转移酶抑制剂 Decitabine 仅轻微缓解,排除表观遗传调控;ChIP-PCR 显示,TGF-β 可诱导 SMAD2/3 结合 miR-520e 启动子的 3 个 SBE 位点,SB431542 可阻断该结合;沉默 SMAD2/3 或 SMAD4 可抑制 TGF-β 诱导的 miR-520e 上调,证实 SMAD2/3 介导 TGF-β 对 miR-520e 的转录激活。
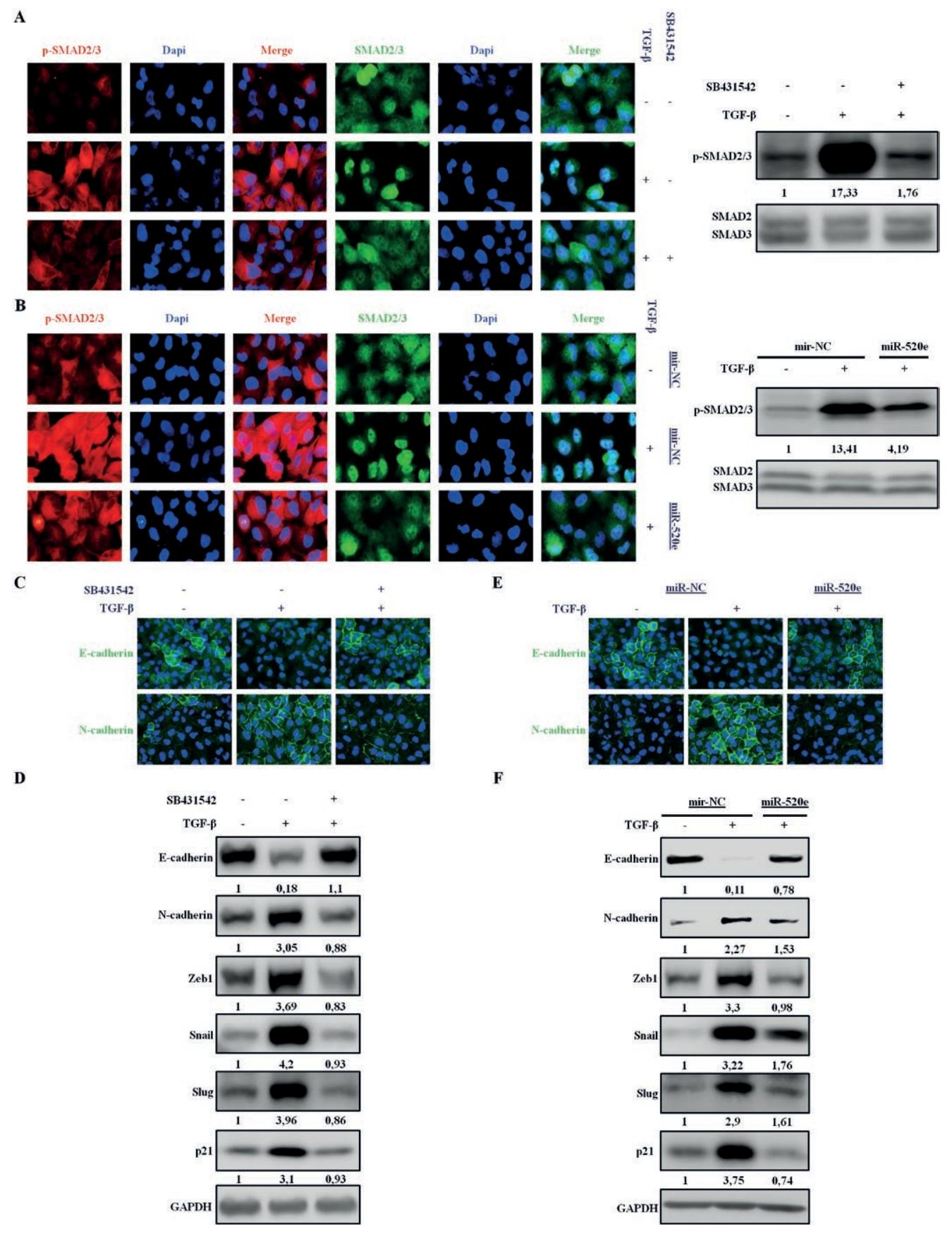
图4:miR-520e 抑制 SMAD 通路及 TGF-β 调控的基因表达
免疫荧光和免疫印迹显示,miR-520e 与 SB431542 类似,可抑制 TGF-β 诱导的 SMAD2/3 磷酸化及核定位(SB431542 抑制作用更强);miR-520e 可降低 TGF-β 介导的 Akt、Erk1/2、p38 激活;qPCR 和免疫印迹证实,miR-520e 可逆转 TGF-β 诱导的 EMT 标志物变化(E - 钙粘蛋白下调、N - 钙粘蛋白 / Zeb1/Snail/Slug 上调),且抑制 TGF-β 诱导的 p21 上调;沉默 miR-520e 可增强 TGF-β 诱导的 EMT。
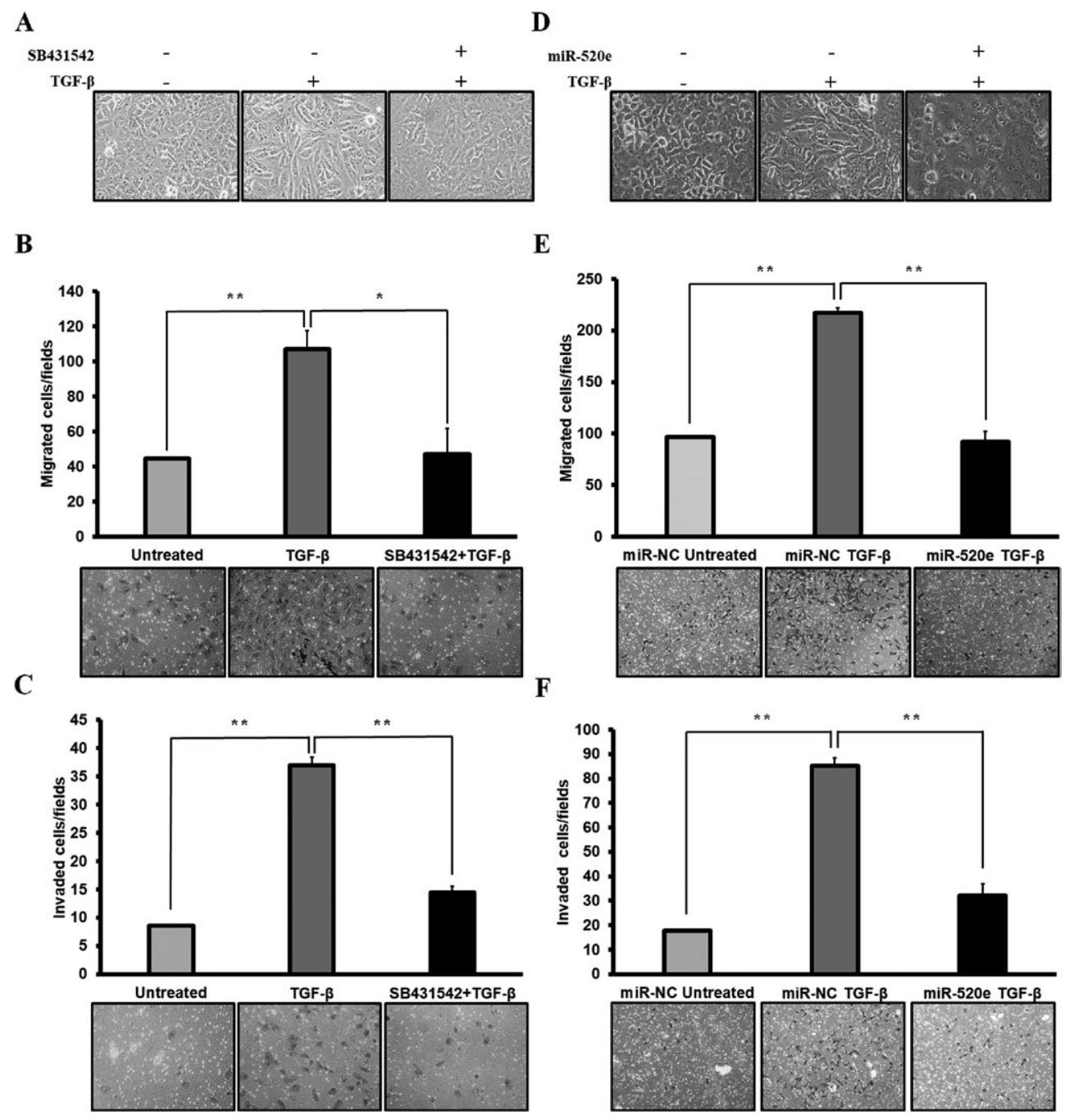
图5:miR-520e 抑制 TGF-β 诱导的 EMT、迁移侵袭及生长抑制
相差显微镜显示,miR-520e 可逆转 TGF-β 诱导的 NSCLC 细胞间质样形态;Transwell 实验显示,miR-520e 显著降低 TGF-β 诱导的 A549 细胞迁移(抑制率约 40%)和侵袭(抑制率约 50%);MTT 实验显示,miR-520e 可消除 TGF-β 对 A549 细胞的增殖抑制,甚至促进增殖;沉默 miR-520e 可加速 TGF-β 诱导的 EMT。
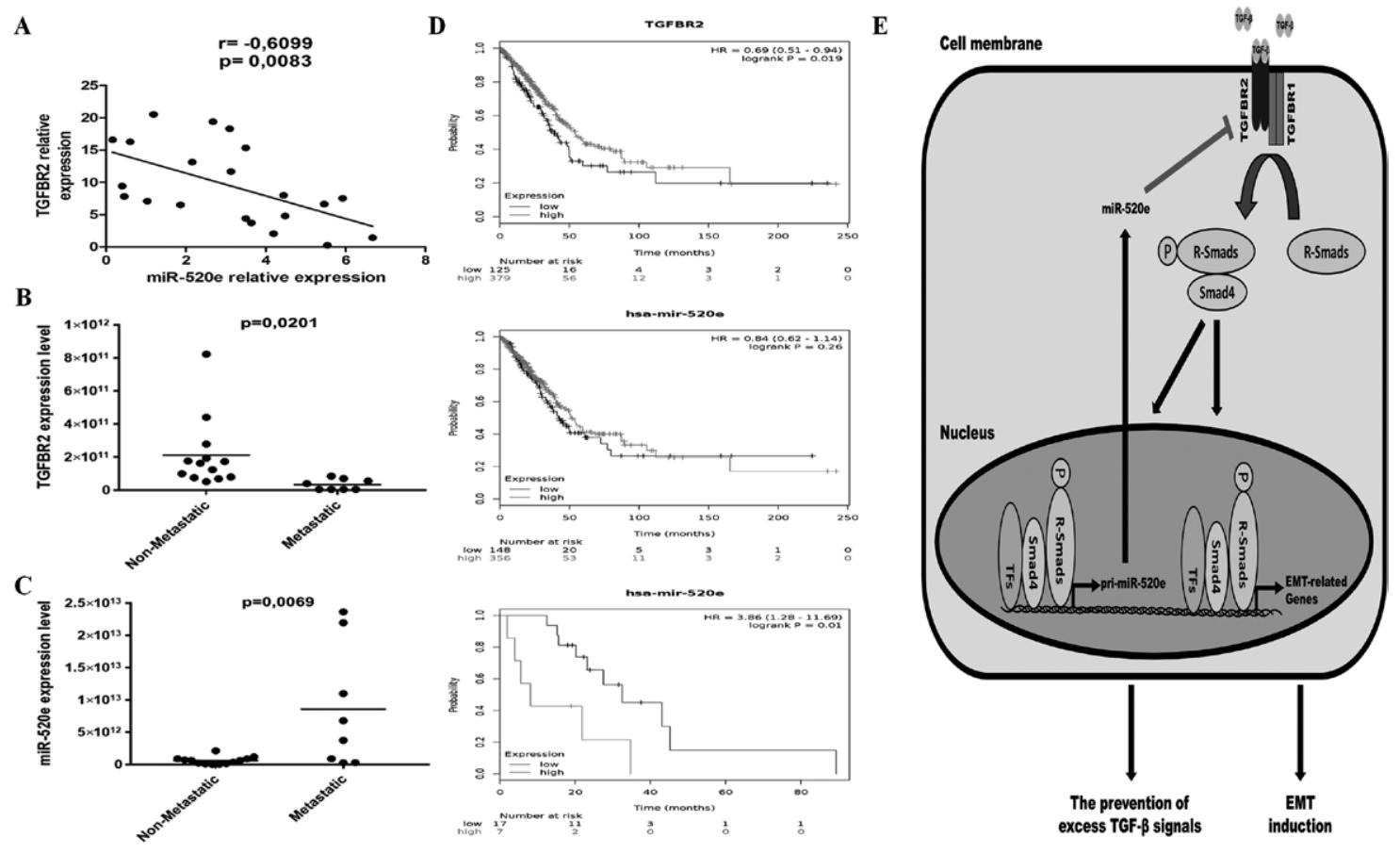
图6:临床样本中 miR-520e 与 TGFBR2 负相关,且与 NSCLC 转移及生存相关
21 例 NSCLC 样本 qPCR 显示,miR-520e 与 TGFBR2 表达呈负相关(r=-0.69);转移灶中 miR-520e 表达显著高于非转移灶,TGFBR2 则显著低于非转移灶;Kaplan-Meier 分析显示,TGFBR2 低表达与 NSCLC 整体生存率降低相关,而 miR-520e 高表达仅与 IV 期(远处转移)NSCLC 患者生存率降低相关;机制模型显示:TGF-β 激活 SMAD2/3→诱导 miR-520e→下调 TGFBR2→形成负反馈环,避免 TGF-β 过度激活导致的细胞阻滞,同时调控 EMT 和转移。
本研究首次揭示 TGF-β-SMAD-miR-520e-TGFBR2 负反馈轴在 NSCLC 中的作用:TGF-β 通过 SMAD2/3 转录激活 miR-520e,miR-520e 直接靶向并下调 TGFBR2,既避免 TGF-β 过度激活导致的细胞增殖抑制,又调控 EMT 和转移;临床样本证实 miR-520e 高表达与 NSCLC 转移及 IV 期患者不良预后相关,可作为 NSCLC 转移的潜在预测标志物。该机制为 NSCLC 转移的靶向治疗提供了新靶点(如 miR-520e 或 TGFBR2)。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:机器学习引导的中国大蝾螈皮肤抗光老化肽:高效制备和机制研究