常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-10-13 09:06:41 细胞资源库平台 访问量:199
乙肝病毒(HBV)感染是全球主要公共卫生问题之一,有超过2.5亿人慢性感染HBV。而其中有超三分之一的人口集中在我国,人数接近1亿人。NTCP工具细胞,特别是外源表达NTCP的肝癌细胞系如HepG2-NTCP和Huh7-NTCP,因其易操作、短周期、重现性佳的特点,在乙肝病毒(HBV)研究中扮演着至关重要的角色。这些细胞模型能够有效模拟HBV的感染过程,为研究HBV的生命周期、宿主限制因子、病毒复制以及药物筛选提供了一个强大而便捷的体外平台。它们不仅有助于揭示HBV感染的分子机制,如DDX3作为宿主限制因子阻碍cccDNA转录,GPC5作为附着因子在感染入胞过程中的作用,还能通过直接与NTCP相互作用或下调NTCP表达来筛选和验证抗病毒药物的活性,例如环孢菌素A及其衍生物、雷帕霉素及其衍生物等。此外,这些工具细胞还促进了对HBV宿主特异性分子的发现,为发展支持HBV感染的小动物模型提供了可能,这对于乙肝相关研究和药物开发具有重大意义。
英文标题:VVX001 Induces preS-Specific Antibodies Reacting to Common HBV Genotypes in Hepatitis B Virus (HBV) Carrier Mice
中文标题:VVX001 在乙型肝炎病毒(HBV)携带小鼠中诱导 preS 特异性抗体,且该抗体对常见 HBV 基因型具有交叉反应性
发表期刊:《Vaccines》
影响因子:3.4
作者单位:
1. Institute of Pathophysiology and Allergy Research, Center for Pathophysiology, Infectiology and Immunology, Medical University of Vienna, 1090 Vienna, Austria
2. Laboratory of Immunopathology, Department of Clinical Immunology and Allergology, I. M. Sechenov First Moscow State Medical University, 119991 Moscow, Russia
3. Life Improvement by Future Technologies (LIFT) Center, 115478 Moscow, Russia4 Virology Department, Institut Pasteur, Université Paris Cité, 75015 Paris, France
作者信息:
Inna Tulaeva, Maryline Bourgine, Carolin Cornelius-Nikl
慢性乙型肝炎(CHB)是全球重大公共卫生问题,全球超 2.5 亿人慢性感染,每年因 HBV 相关肝衰竭或肝癌死亡超 80 万人。现有治疗(直接抗病毒药物、聚乙二醇干扰素)难以实现 “功能性治愈”(HBsAg 清除 + 抗 - HBs 血清转换),且存在耐药、毒性等问题。HBV 大表面蛋白(LHBs)的 preS 结构域(preS1+preS2)是关键靶点:preS1 通过结合肝细胞表面 NTCP 受体介导 HBV 入侵,且 preS 主要存在于成熟感染性病毒颗粒中,抗原量远低于 HBsAg,不易引发免疫耐受。
VVX001 是基于 preS 的重组融合疫苗,由 HBV 基因型 A2 的 preS 结构域与草花粉变应原 Phl p 5 的肽段在 N/C 端融合而成(草花粉过敏疫苗 BM32 的组件之一),此前研究显示其可在草花粉过敏患者及 HBsAg 疫苗低应答者中诱导 preS 特异性中和抗体,体外可抑制 HBV 感染。本研究采用 AAV-HBV 小鼠模型(AAV2/8 载体携带复制型 HBV 基因组,模拟 CHB 持续感染),验证 VVX001 能否在 HBV 携带小鼠中突破免疫耐受,诱导 preS 特异性抗体及交叉反应。
动物实验设计:6-8 周龄雌性 C57BL/6 小鼠(每组 6 只,共 6 组),尾静脉注射 5×10¹⁰病毒基因组当量(vg)的 AAV-HBV(3 组)或 AAV-Empty(空载对照,3 组);6 周后,皮下注射 20μg 氢氧化铝吸附的 VVX001、preS(对照免疫原)或仅氢氧化铝(载体对照),共 5 次,间隔 3 周;实验期间定期采血,末次免疫后 2 周收集脾、肝单个核细胞,检测抗体、B 细胞反应及肝内淋巴细胞(IHL)。
载体与免疫原:AAV2/8-HBV 含复制型 HBV 基因组,AAV-Empty 为空载;VVX001 含 HBV 基因型 A2 preS(preS1+preS2)及 Phl p 5 肽段,preS 对照为含 C 端组氨酸标签的基因型 A2 preS(E. coli 表达纯化)。
细胞制备:肝单个核细胞经门静脉灌注 PBS 后,通过 100μm 滤网过滤、Percoll 密度梯度离心分离;脾细胞用溶血缓冲液去除红细胞,均重悬于含 10% FCS 的 α-MEM 完全培养基。
B 细胞 ELISPOT 实验:96 孔板包被 MHBs(preS2+S)、HBcAg 或 preS,加入 5×10⁵脾细胞, overnight 孵育后,用生物素化抗小鼠 IgG 及碱性磷酸酶标记二抗检测抗体分泌细胞(ASC),以 KLH 为阴性对照、抗 IgG 为阳性对照。
流式细胞术与胞内细胞因子染色(ICS):肝单个核细胞用抗 CD3、CD4、CD8 等抗体表面染色,检测 IHL 数量;脾 / 肝单个核细胞用 HBc、MHBs、preS 肽池刺激,加入布雷菲德菌素 A,抗 IFNγ、IL-2、TNF-α 抗体胞内染色,检测细胞因子分泌 T 细胞。
ELISA 检测:包被 preS 或 HBV 基因型 A-H 的 preS 肽段(含 NTCP 结合位点),检测血清 preS 特异性 IgG₁/IgG₂ₐ;商用 ELISA 试剂盒检测血清 HBsAg、HBeAg 及肝酶(ALAT/ASAT);QIAamp 试剂盒纯化血清 HBV DNA,qPCR 定量(检测限 10² IU/mL)。
统计分析:数据以均值 ± 标准误(SEM)表示,非正态分布数据用 Kruskal-Wallis 检验 + Dunn 事后检验,两组比较用 Mann-Whitney U 检验,GraphPad Prism 8 分析(p<0.05 为显著)。
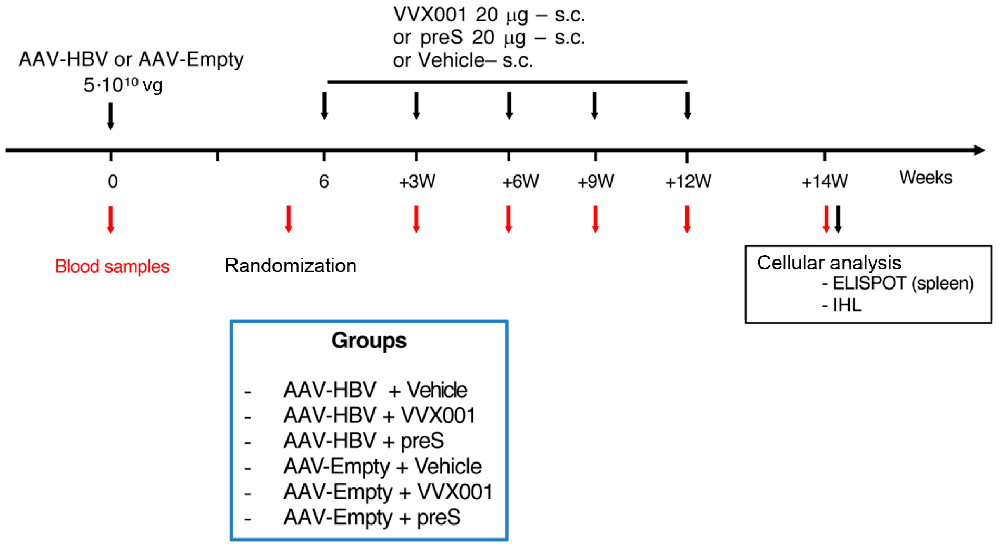
图1:小鼠实验设计及流程节点示意图
实验设计示意图展示小鼠分组(AAV-HBV/Empty+VVX001/preS/ 载体)、AAV 注射时间(0 周)、免疫时间(6、9、12、15、18 周,共 5 次)、采血时间点及末次免疫后 2 周的细胞分析(脾 ELISPOT、肝 IHL 检测),明确实验流程与检测节点。
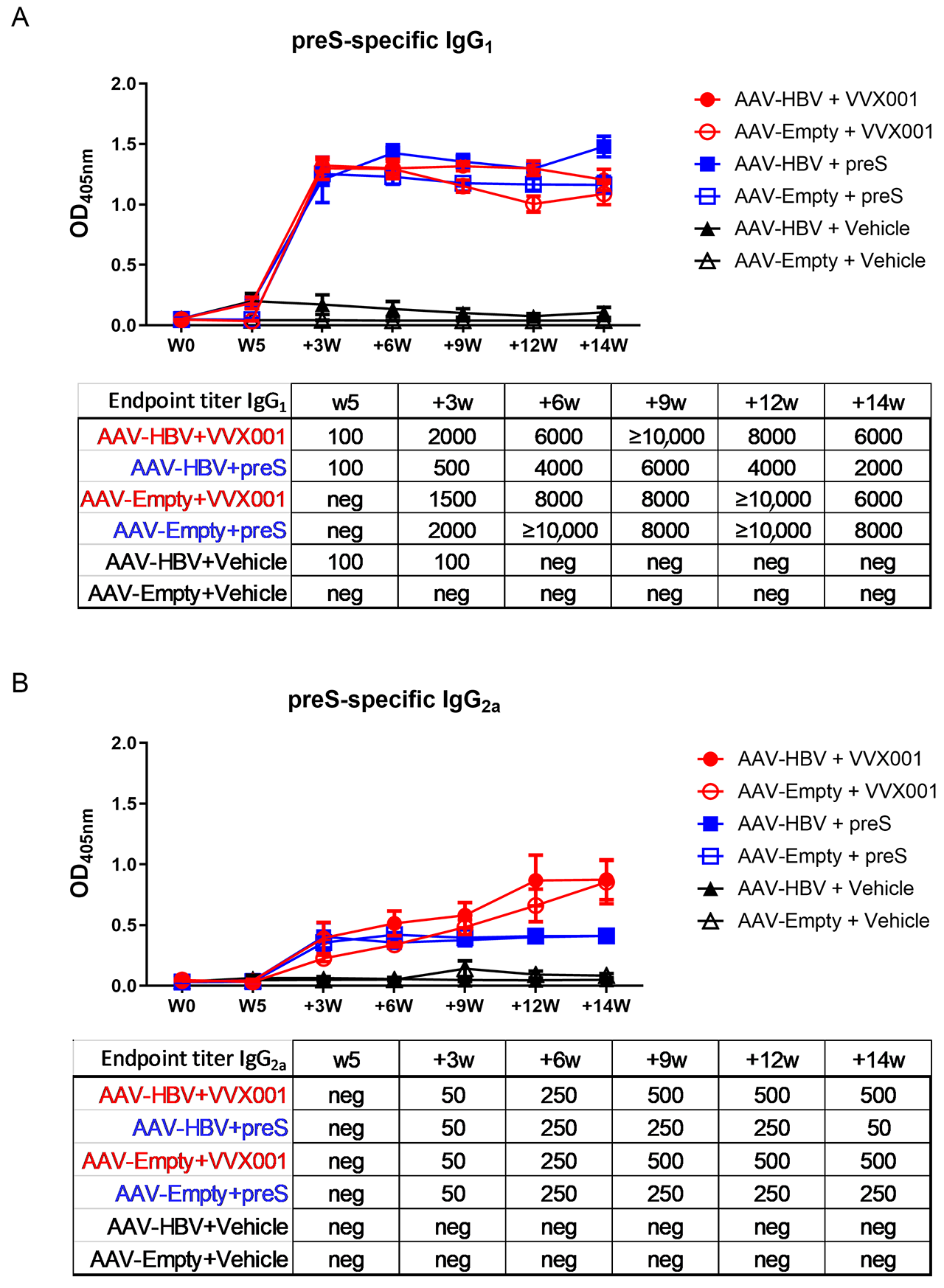
图2:VVX001诱导preS抗体效果显著
VVX001 诱导 preS 特异性 IgG₁和 IgG₂ₐ抗体载体对照组(AAV-HBV/Empty+Vehicle)全程无显著 preS 特异性抗体;VVX001 或 preS 免疫组在首次免疫后 3 周即出现 IgG₁/IgG₂ₐ显著升高,且持续维持高滴度;其中 VVX001 组的 IgG₂ₐ滴度显著高于 preS 组(AAV-HBV 组:末次免疫时 IgG₂ₐ终点滴度 500 vs 50),且 AAV-HBV+VVX001 组的抗体水平略高于 AAV-Empty+VVX001 组,提示 HBV 感染未阻碍抗体诱导,反而可能增强应答。
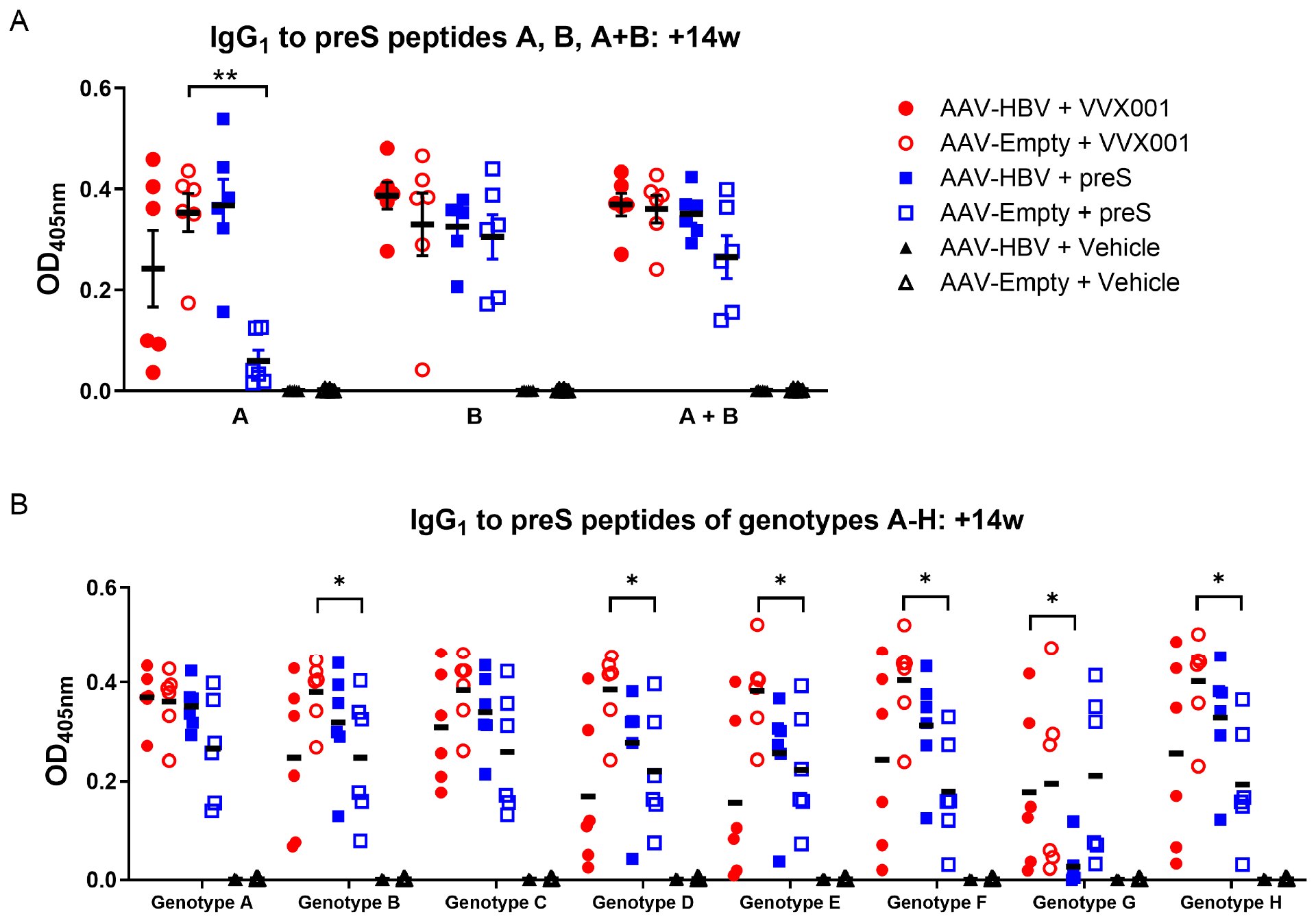
图3:preS抗体靶向位点及多基因型交叉反应
preS 特异性抗体靶向 NTCP 结合位点且对多基因型交叉反应ELISA 显示,VVX001/preS 免疫组的 IgG₁可识别 preS 的 NTCP 结合位点肽(肽 A:1-29aa)、辅助感染抑制域肽(肽 B:30-61aa)及融合肽 A+B;AAV-HBV+VVX001 组对肽 B 反应更强,AAV-HBV+preS 组对肽 A 反应更强;两组抗体可交叉识别 HBV 基因型 A-H 的 preS 肽段(仅 AAV-HBV+preS 组对基因型 G 肽反应较弱),证实 VVX001 诱导的抗体具有广谱基因型交叉反应性。
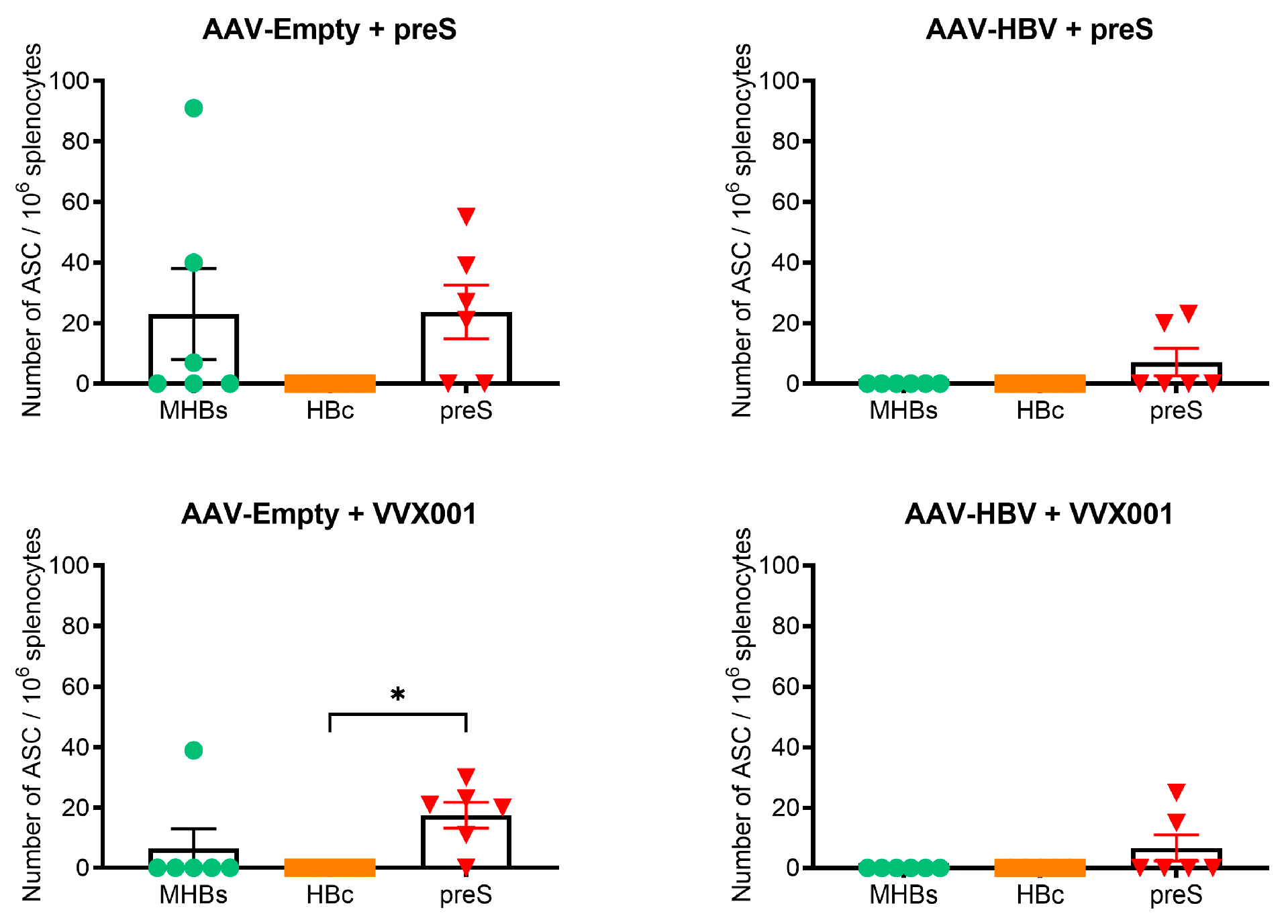
图4:VVX001对包膜抗体分泌B细胞的影响
VVX001 增强包膜特异性抗体分泌 B 细胞ELISPOT 显示,AAV-Empty+VVX001/preS 组可检测到 preS 及 MHBs(preS2+S)特异性 ASC;AAV-HBV+VVX001/preS 组仅检测到 preS 特异性 ASC(无 MHBs 特异性),且应答小鼠数量少于 AAV-Empty 组(VVX001 组:2/6 vs 5/6),但 ASC 数量无统计学差异,提示 HBV 感染可能轻微影响 B 细胞应答范围,但不阻断 preS 特异性 B 细胞激活。
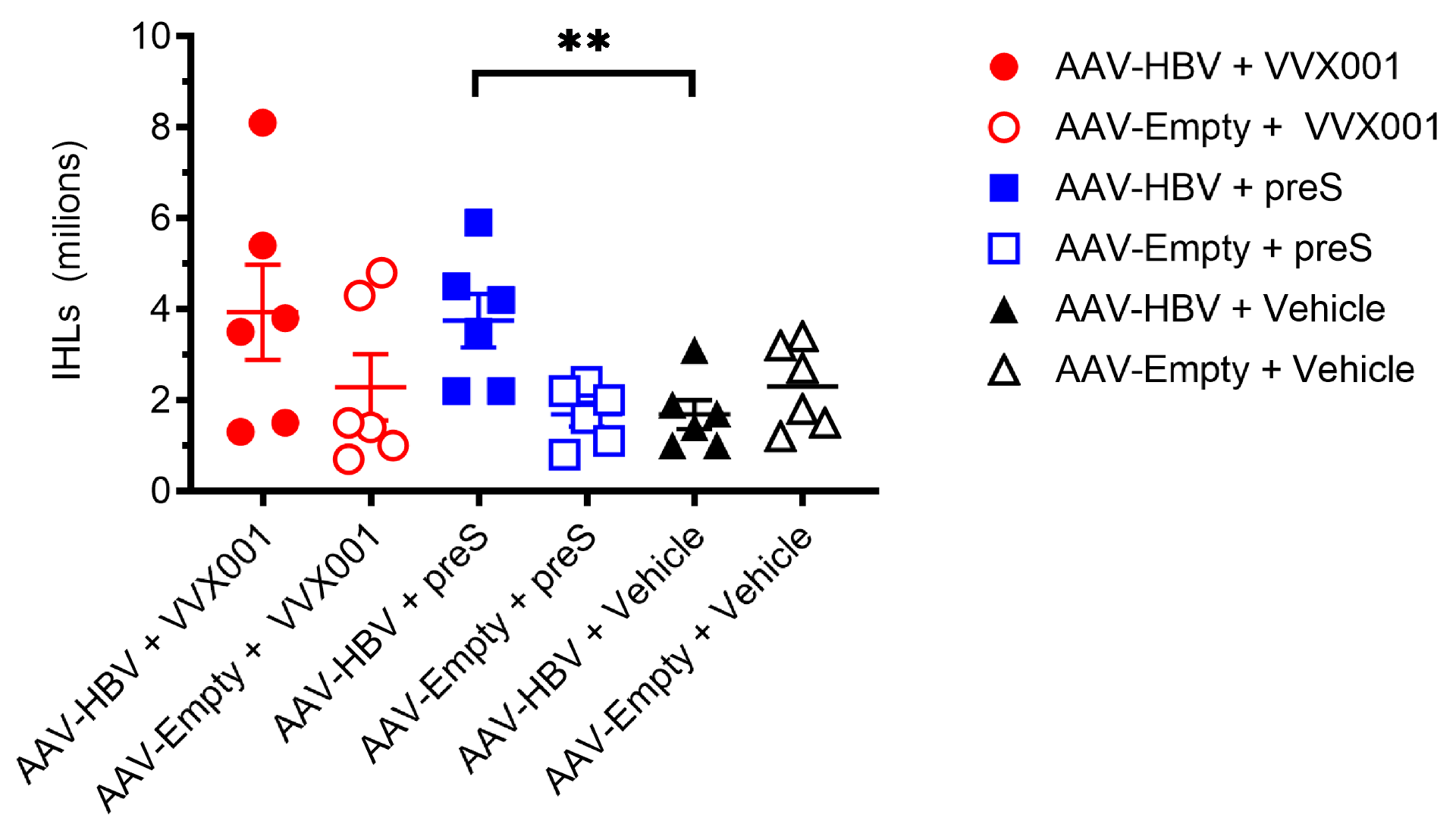
图5:VVX001/preS增加HBV小鼠肝内淋巴细胞数
VVX001/preS 增加 HBV 携带小鼠的肝内淋巴细胞数量AAV-HBV+Vehicle 组的 IHL 数量低于 AAV-Empty+Vehicle 组;AAV-HBV+preS 组的 IHL 数量显著高于载体组(p=0.009),VVX001 组也呈升高趋势,提示疫苗诱导的免疫细胞可被招募至肝脏,可能参与抗病毒反应。
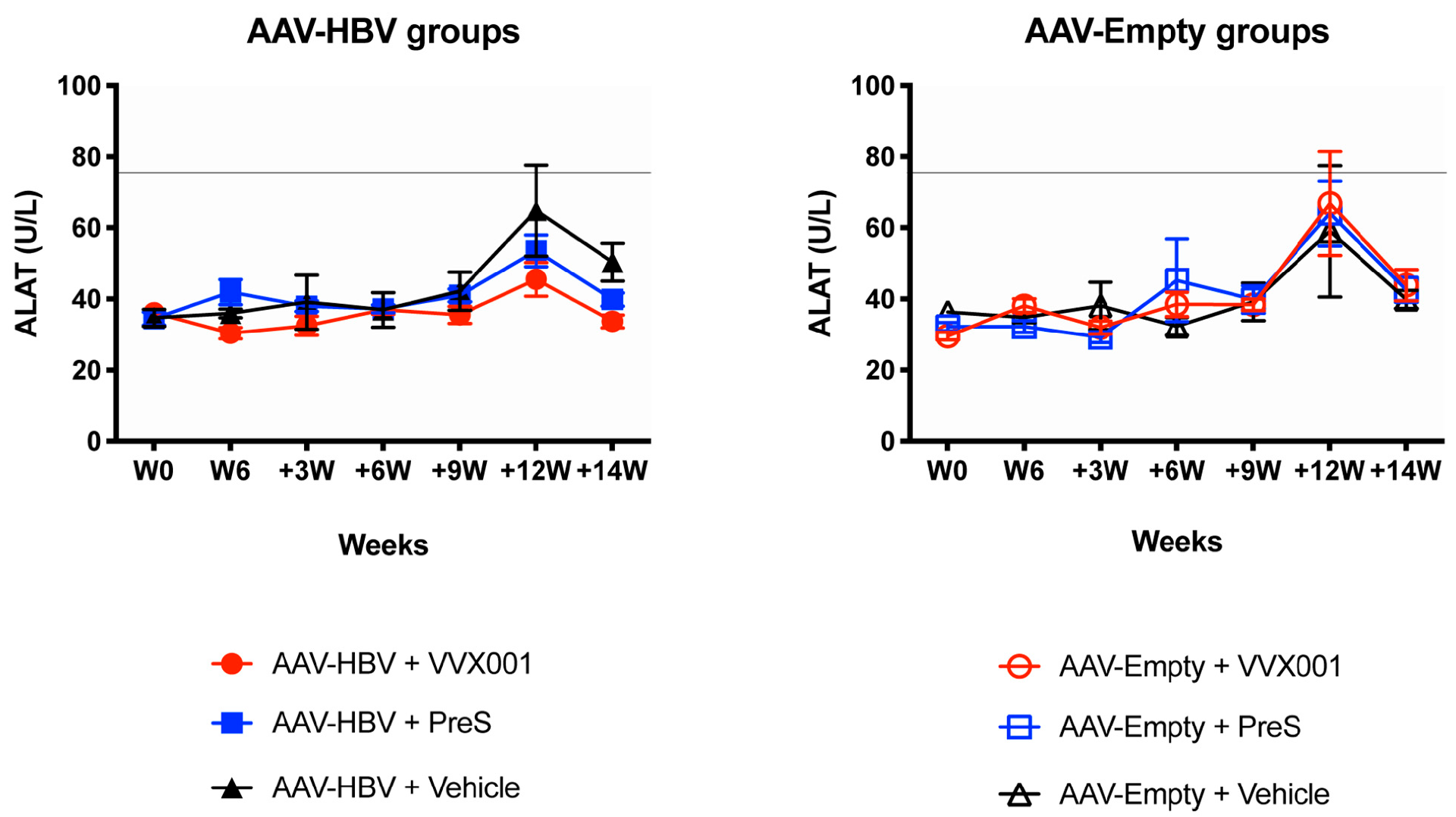
图6:VVX001/preS疫苗免疫无肝损伤
疫苗不引发肝损伤(肝酶正常)所有组的 ALAT/ASAT 水平全程维持在正常范围(ALAT 均值 35-40 IU/L),无显著组间差异,且无 > 4 倍正常上限的肝酶升高,证实 VVX001/preS 免疫安全性良好,不引发肝损伤。
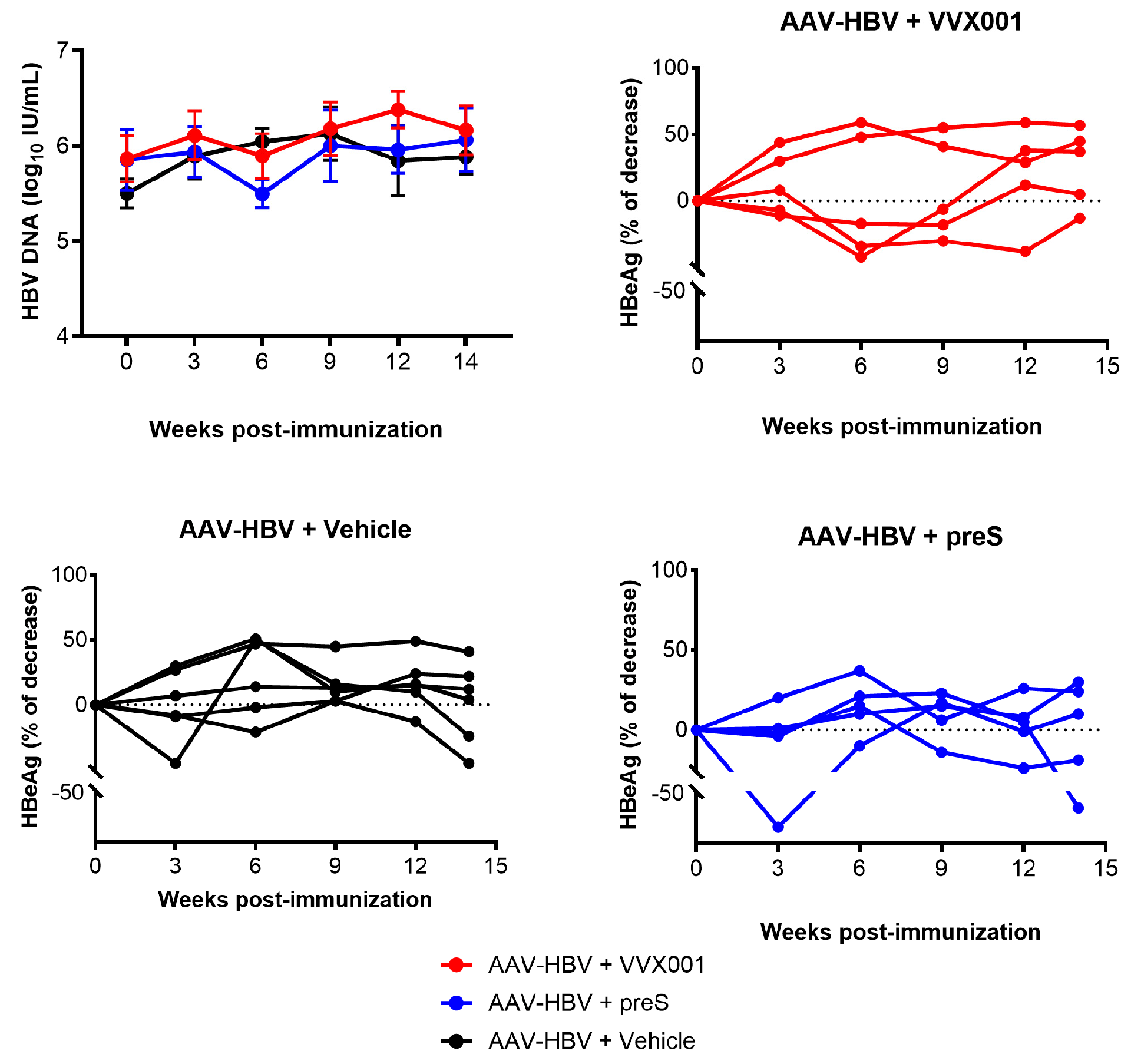
图7:VVX001/preS 对 HBV DNA 和 HBeAg 的影响
该图呈现 AAV-HBV 转导小鼠免疫期间 HBV DNA 和 HBeAg 的动态变化:免疫前(AAV 注射后 6 周),VVX001、preS 及载体组的 HBV DNA 均值分别为 5.87±0.24、5.86±0.31、5.5±0.16 log₁₀ IU/mL,组间无显著差异;首次免疫后 6 周,preS 组和 VVX001 组的 HBV DNA 水平均显著下降,载体组则无明显变化,提示疫苗对病毒复制有轻微抑制作用。HBeAg 方面,免疫前浓度范围为 18-156 PEI U/mL,整个随访期间(免疫后 0-14 周),无论是 VVX001 组、preS 组还是载体组,HBeAg 水平与免疫前相比均无显著变化,表明疫苗对 HBeAg 表达无明显影响。
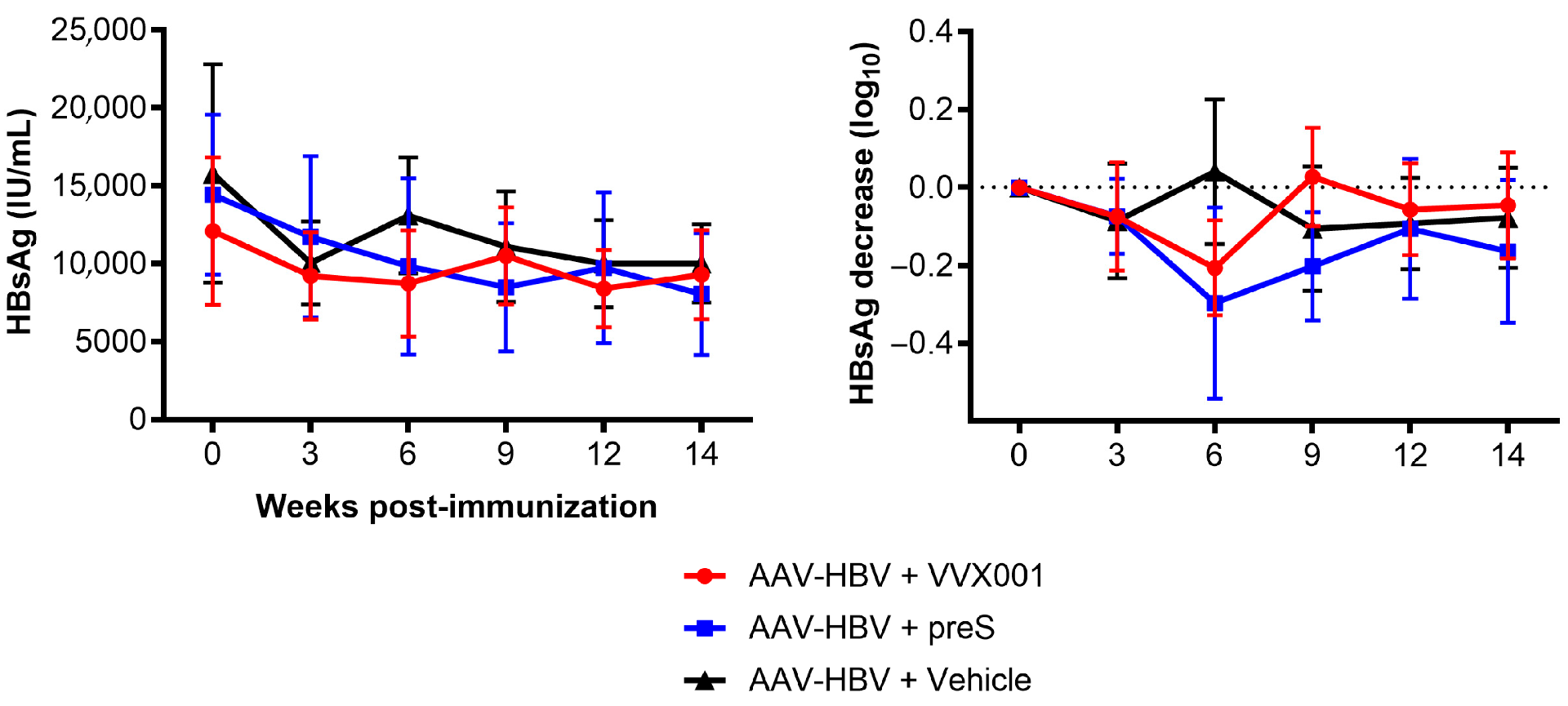
图8:VVX001/preS 对 HBsAg 的影响
该图追踪 AAV-HBV 转导小鼠免疫后 HBsAg 的变化趋势:免疫前,VVX001、preS 及载体组的 HBsAg 均值分别为 12103±4730、14419±5127、15788±7009 IU/mL,各组基线一致;首次免疫后 3 周,三组 HBsAg 均开始下降,6 周时载体组恢复至免疫前基线水平,而 VVX001 组和 preS 组仍维持下降趋势。以免疫前水平为基准计算 HBsAg 下降百分比(右侧图)显示,preS 组在第三次免疫(+9 周)后仍能维持 HBsAg 低水平,VVX001 组也持续低于载体组,进一步证实两种疫苗均能轻微降低 HBsAg,且 preS 组效果更持久。
在 AAV-HBV 小鼠(AAV2/8 载体携带复制型 HBV 基因组,模拟慢性乙型肝炎(CHB)感染)模型中,VVX001 可突破 HBV 介导的免疫耐受,有效诱导 preS 特异性 IgG₁和 IgG₂ₐ抗体(其中 IgG₂ₐ水平显著高于单独 preS 免疫组),且诱导的抗体能靶向 preS 的 NTCP 受体结合位点、对 HBV 基因型 A-H 的 preS 肽段具有交叉反应性;同时,VVX001 免疫安全性良好,小鼠肝酶(ALAT/ASAT)维持正常无肝损伤,还可增加肝内淋巴细胞数量,虽因模型局限(无人类 NTCP、HBV DNA / 抗原由 AAV 整合驱动)未验证抗体阻断再感染功能且仅轻微抑制 HBV DNA 和 HBsAg,但仍为 VVX001 作为 CHB 治疗性疫苗的后续临床研究提供了关键依据。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
下一篇:机器学习引导的中国大蝾螈皮肤抗光老化肽:高效制备和机制研究