常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-09-28 09:53:08 细胞资源库平台 访问量:166
产品名称:人外周血CD8+ T细胞分离试剂盒(阳选)
产品货号:IMP-HK002
背景介绍:磁珠分选技术源于20世纪70年代免疫学与材料科学结合,其借助磁性微珠特异性结合靶细胞,实现快速、高纯度分选,推动细胞生物学等领域研究。目前主流的细胞分选方法包括密度梯度离心分选、流式细胞术分选与磁珠分选。其中,密度梯度离心分选虽成本最低,但无法区分大小相近却功能不同的细胞亚群(如难以从淋巴细胞中精准分离CD4⁺T细胞);流式细胞术分选虽纯度最高,却因成本高昂、分选加压易损伤细胞活性,应用场景受限;磁珠分选则兼具显著优势,不仅成本适中、分选速度快、操作简便,能保证较高的纯度与得率,加之耗材为一次性使用可有效避免交叉污染,能够高效实现CD8⁺T细胞的快速分选。
本产品借助磁珠分选技术,可快速获取高纯度 CD8⁺T 细胞;其核心优势在于,试剂盒配套的流式抗体可直接用于后续流式检测,且不会对细胞下游实验分析造成干扰,为研究流程提供便利。
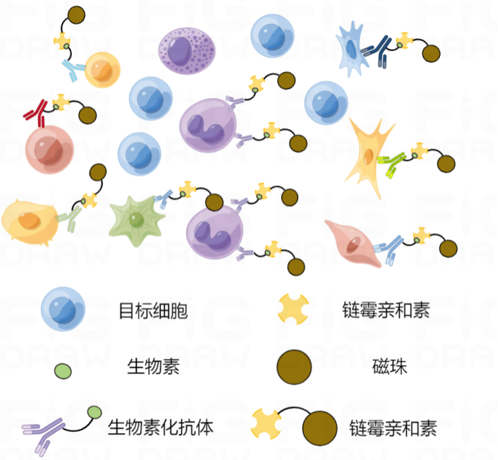
免疫磁珠法分离细胞的主要原理是利用生物素化的抗体与链霉亲和素磁珠相结合,由于抗体的特异性以及链霉亲和素和生物素形成的紧密结合,从而在磁场的作用下分离出特定的细胞。
免疫磁珠细胞分选根据所标记细胞的不同可分为阳性分选(正选)和阴性分选(负选),两种方式均可分离出高纯度的目的细胞。
| 分选方法 | 原理 | 优点 | 缺点 | 产品优化 |
| 阳选 | 直接标记目标细胞(用磁珠偶联抗体结合目的细胞) | 1、纯度和回收率高 2、兼容多参数分选 3、比例少的细胞高度富集 | 1、抗体结合影响细胞功能 2、分选后无法直接流式检测(克隆表位被占据) | 本产品克服表位问题,分选后可直接用于流式检测 |
| 阴选 | 通过去除非目标细胞,保留未被标记的目标细胞 | 1、目的细胞未被标记 2、避免磁珠残留 3、适用于后续功能实验 | 1、纯度回收率低 2、需要多种抗体 | 优化抗体配比提高纯度 |
用亲和链霉素偶联抗体直接标记目的细胞,使亲和链霉素与磁珠表面的活性基团形成稳定的化学键,磁吸后收集目的细胞以及流出液(非目的细胞)。
免疫磁珠细胞分离法(阳选)操作简单,分选磁珠颗粒小为纳米磁珠,对细胞影响小,分离的组织可不限于在脾脏和外周血,也可以尝试从其他组织中获得目的细胞。
本产品最大的优势在于克服了磁珠占据细胞表位而无法流式检测的问题,可利用阳选得到的目的细胞直接进行流式细胞术。
人的样品一般只能来自外周血,外周血是比较容易获取的组织。
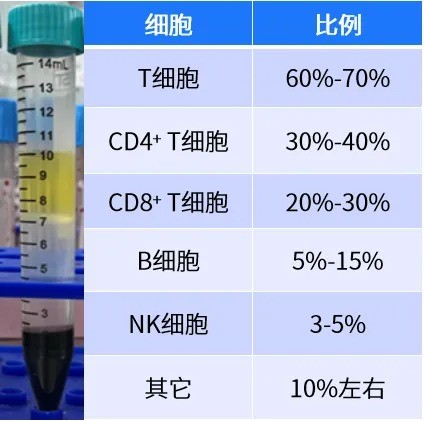
健康人10 mL外周血可提取1-2x107个细胞,人外周血PBMC也是一款产品可以出售,新鲜血液效果最佳。其中T细胞,B细胞,NK 细胞是研究较多的细胞,比例也各不相同。
其中以T细胞最多,将近70%,B细胞也占10%左右,T细胞里面又分为CD4+ T细胞,CD8+ T细胞,也在30%-40%左右,NK细胞只占5%左右。
单细胞悬液制备
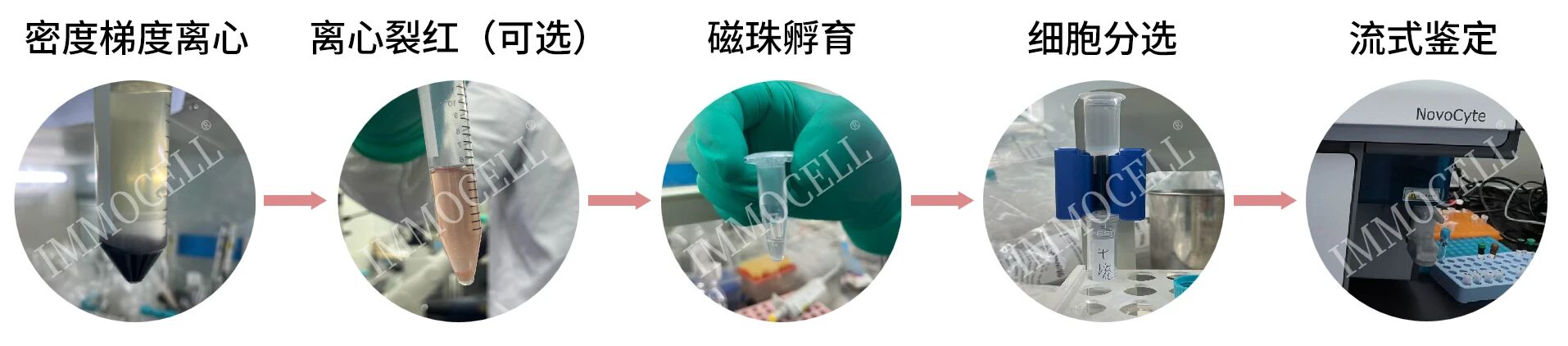
1、肝素钠采血管采集新鲜人外周血10 mL,加入至等体积的分离液中(如血液比较粘稠,可先PBS稀释后再加入至分离液中);
2、采用差速离心,升1降0,500g离心30min;
3、离心完成后,取中间白膜层细胞于新的15 mL离心管中,分选Buffer稀释,500g离心5min;
4、离心后将细胞重悬于分选Buffer中,调整细胞密度为1×108 cells/mL(分选Buffer为含有2 mM EDTA和1% BSA 的PBS,使用前需预先通过0.22 μm滤膜过滤除菌);
CD8+T细胞分选抗体孵育
1、取100 μL细胞悬液加入2 μL CD8+ T细胞分选抗体混合均匀,4°C 孵育15 min,期间每隔5 min轻弹管壁使细胞与抗体混合均匀;
2、孵育完成后加入1 mL分选Buffer重悬,500 g,离心5 min,弃去上清,加入100 μL的分选Buffer重悬。
CD8+T细胞分选磁珠孵育
1、吸取10 μL 链霉素亲和磁珠,与细胞混匀后4°C孵育10 min,期间每隔5 min轻弹管壁使细胞和磁珠混合均匀(此试剂盒说明书为分选1×107个脾脏细胞中的CD8+ T细胞的使用说明,如果分选更多的细胞,则可按比例增加抗体、链霉亲和素磁珠的用量,少于1×107个细胞则将细胞悬液体积补至100 μL,加入2 μL分选抗体和10 μl 磁珠);
2、孵育完成后,加入1 mL的分选Buffer重悬,500 g,离心5 min,去除上清,加入500 μL分选Buffer重悬,准备磁性分选。
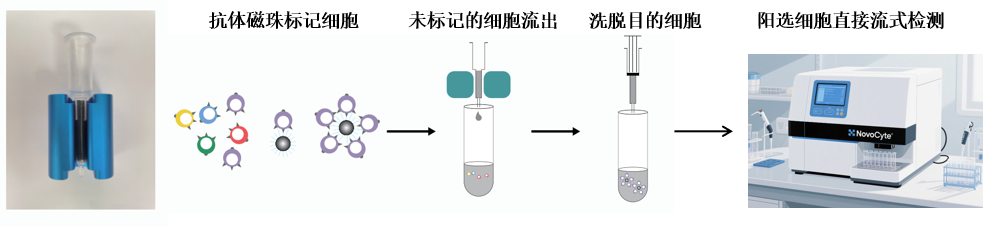
CD8+T细胞磁珠过柱分选
1、将分选柱放入磁场中,加入500 μL分选Buffer润洗柱子;
2、将重悬好的细胞悬液缓慢加入分选柱中,注意不要产生气泡,待分选柱中的液体流尽时再次加入500 μL分选Buffer清洗两次,流出的液体即为未结合磁珠的细胞(可用于流式间接检测);
3、将分选柱从磁场中移出,置于合适的离心管中,吸取1 mL分选Buffer加入分选柱,使用配套的活塞将结合在分选柱上的细胞推出,收集推出的细胞即为目的细胞;
4、目的细胞可根据实验需求,将细胞洗涤重悬后可直接流式检测、后续分子生物学或细胞生物学实验。
CD8+T目的细胞流式检测
1、将收集的目的细胞500g 5min离心,1 mL分选Buffer重悬计数;
2、取20-50w目的细胞溶于100 μL分选Buffer,加入2 μL CD8流式抗体;
3、孵育15min后,1 mL分选Buffer清洗,300g 3min离心;
4、100 μL分选Buffer重悬,即可流式上机检测。
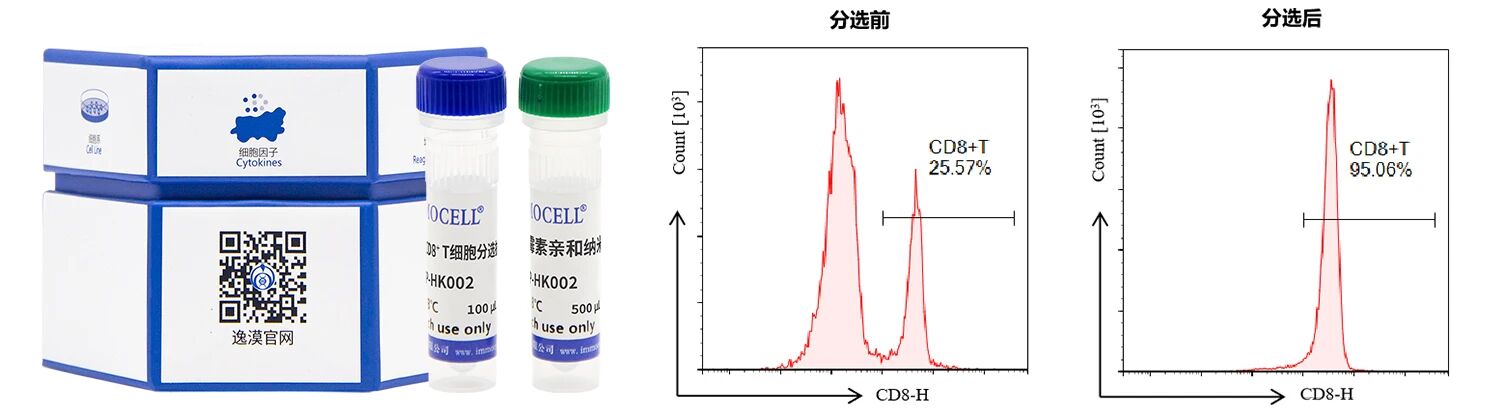
产品:人外周血CD8+ T细胞分离试剂盒(阳选)
包含试剂:人外周血CD8+T细胞阳性分选抗体、人外周血CD8+T细胞阳性分选磁珠、CD8+T细胞流式抗体。
分选前CD8+T细胞比例25.57%,使用分离试剂盒分选后,细胞纯度达95.06%。
本产品包含CD8+T细胞分选抗体、CD8+T细胞分选磁珠且配套了专门用于流式检测的荧光抗体,经过筛选的CD8流式抗体与分选抗体有着不一样的克隆位点,因此不需考虑表位被磁珠占据的问题,可直接用于目的细胞检测。
1、疾病诊断与病情评估:
在感染性疾病(如 HIV、新冠)和肿瘤中,可通过检测外周血 CD8⁺T 细胞的数量、活化状态(如 CD38⁺HLA-DR⁺)及功能,判断病情进展。例如 HIV 感染时,CD8⁺T 细胞耗竭或功能下降提示免疫损伤加重,为临床诊断和预后判断提供关键依据。
2、过继性细胞免疫治疗:
将患者外周血中具有肿瘤杀伤活性的 CD8⁺T 细胞分离、体外扩增并激活后回输体内,可精准攻击肿瘤细胞。在黑色素瘤、白血病等治疗中,该疗法能增强患者自身抗肿瘤免疫,提升治疗效果,是目前临床研究的热点方向之一。
3、疫苗研发与效果评价:
疫苗接种后,外周血 CD8⁺T 细胞的应答水平是评估疫苗有效性的重要指标。如新冠疫苗研发中,检测接种者体内特异性 CD8⁺T 细胞的产生及增殖能力,可判断疫苗能否诱导持久的细胞免疫保护,为疫苗优化提供数据支持。
4、免疫机制研究与药物筛选:
在基础研究中,通过分选纯化外周血 CD8⁺T 细胞,可深入探究其在免疫耐受、自身免疫病中的作用机制。同时,在药物研发中,可利用该细胞建立体外模型,筛选能调节 CD8⁺T 细胞功能的药物,为自身免疫病、肿瘤等疾病的治疗药物研发奠定基础。
1、采血环节注意事项
因为EDTA会影响免疫细胞的激活与扩增,采集血样时避免使用 EDTA 抗凝的真空采样管。
采血管选择:肝素钠采血管>枸橼酸钠采血管
暂存:4度
2、血小板、红细胞混入问题
部分外周血在提取PBMC的过程中,白膜层可能会存在一些红细胞,吸取时应尽可能避开有红细胞部分。
不建议加入红细胞裂解液等,对免疫细胞的活性、增殖能力存在较大影响。
1、上分离柱前,充分振荡,重悬细胞,打散细胞团块
2、细胞悬液加入分离柱中时,应将滴管伸至底壁后加入,避免将细悬液沿管壁流入,使管壁残流未分选细胞,以致后继洗柱过程中,因疏忽未被洗下,最后导致纯度不高
3、洗柱时,应在前次液体充分流尽后,再加洗液
4、分选细胞量应根据说明书控制,不超量
5、孵育时间和温度应按说明书进行,延长孵育时间、提高温度会增加非特异结合
6、磁珠和抗体使用和保存过程中均应避免冷冻、高速离心等操作
7、建议选用低吸附移液器吸头和离心管,避免因吸附造成磁珠和抗体的损耗
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
下一篇:延长 I 型干扰素信号!THP-1 报告细胞系助力疫苗辅佐剂筛选