常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-09-12 09:01:38 细胞资源库平台 访问量:247
乙肝病毒(HBV)感染是全球主要公共卫生问题之一,有超过2.5亿人慢性感染HBV。而其中有超三分之一的人口集中在我国,人数接近1亿人。NTCP工具细胞,特别是外源表达NTCP的肝癌细胞系如HepG2-NTCP和Huh7-NTCP,因其易操作、短周期、重现性佳的特点,在乙肝病毒(HBV)研究中扮演着至关重要的角色。这些细胞模型能够有效模拟HBV的感染过程,为研究HBV的生命周期、宿主限制因子、病毒复制以及药物筛选提供了一个强大而便捷的体外平台。它们不仅有助于揭示HBV感染的分子机制,如DDX3作为宿主限制因子阻碍cccDNA转录,GPC5作为附着因子在感染入胞过程中的作用,还能通过直接与NTCP相互作用或下调NTCP表达来筛选和验证抗病毒药物的活性,例如环孢菌素A及其衍生物、雷帕霉素及其衍生物等。此外,这些工具细胞还促进了对HBV宿主特异性分子的发现,为发展支持HBV感染的小动物模型提供了可能,这对于乙肝相关研究和药物开发具有重大意义。
英文标题:AUF1 Is a Novel Negative Regulator for Hepatitis B Virus Replication Acting Through a Posttranscriptional Manner
中文标题:AUF1 通过转录后机制成为乙型肝炎病毒复制的新型负调控因子
发表期刊:《Journal of Medical Virology》
影响因子:4.6
作者单位:
1. Department of Microbiology & Infectious Disease Center, School of Basic Medical Sciences, Peking University Health Science Center, Beijing, China
2. Department of Laboratory Medicine, Beijing Tongren Hospital, Capital Medical University, Beijing, China
3. Fujian Provincial Key Laboratory of Hepatic Drug Research, Ningde, Fujian, China
作者信息:
Jing Zhang, Chenxiao Qu, Yanhua Zhang
慢性乙型肝炎病毒(HBV)感染是全球重大公共卫生问题,现有干扰素和核苷(酸)类似物治疗难以实现彻底治愈,核心瓶颈在于 HBV 共价闭合环状 DNA(cccDNA)持续存在及病毒与宿主的复杂相互作用。RNA 结合蛋白(RBPs)是 HBV 转录后调控的关键宿主因子,如 HuR、RBM24 等通过结合 HBV RNA 影响其稳定性或包装,但 AU-rich 元件 RNA 结合蛋白 1(AUF1,又称 hnRNP D)在 HBV 调控中的作用尚未报道。AUF1 作为广泛表达的 RBP,可通过结合 mRNA 的 AU-rich 元件(AREs)调控 RNA 稳定性,在柯萨奇病毒、丙肝病毒等复制中发挥调控作用,但与 HBV 的相互作用及机制未知。本研究通过筛选 pgRNA 结合蛋白,首次发现 AUF1 可通过转录后机制抑制 HBV 复制,并揭示 HBV 通过促进 AUF1 蛋白降解实现逃逸,为 HBV 治疗提供新靶点。
细胞系与病毒模型
采用三种 HBV 相关细胞模型:①HepAD38 细胞(Tet-off 系统调控 HBV 表达,稳定产毒);②HepG2-NTCP 细胞(Tet-on 系统调控 NTCP 表达,用于 HBV 感染);③HepG2 细胞(共转染 prcccDNA 与 pCMV-Cre 质粒,模拟 cccDNA 介导的 HBV 复制)。细胞培养于含 10% FBS 的 DMEM 培养基,HepAD38 添加 G418,HepG2-NTCP 添加嘌呤霉素,分别用 Tet 或 Dox 调控 HBV 或 NTCP 表达。HBV 病毒颗粒从 HepAD38 上清经 PEG 8000 沉淀浓缩,以 50 Geq/cell 感染 HepG2-NTCP 细胞。
质粒与干扰试剂
构建 AUF1 四种亚型(p45、p42、p40、p37)的过表达质粒(pCDH-AUF1),设计靶向 AUF1 的 siRNA(siAUF1)及阴性对照(siCtrl);使用含 HBV 增强子 / 启动子(Enh I、Enh II+BCP、BCP 等)的荧光素酶报告质粒,以及野生型(WT)和 ARE 突变型(Mut)HBV pgRNA 质粒。转染采用 Lipofectamine 2000 或 RNAiMAX,按说明书操作。
分子生物学检测
采用 TRIZOL 提取总 RNA,RT-qPCR 检测 HBV RNA 及 AUF1 mRNA 水平(以 CTBP1 为内参);Western blot 检测 AUF1、HBV 核心蛋白等(以 GAPDH 或 Tubulin 为内参);Southern blot 检测核心相关 HBV DNA 复制中间体;Northern blot 检测 HBV RNA;RNA 免疫沉淀(RIP)验证 AUF1 与 HBV RNA 的结合;RNA pulldown 实验(生物素化 HBV RNA 探针)确认结合特异性;双荧光素酶报告实验检测 HBV 启动子 / 增强子活性。
翻译效率与蛋白稳定性分析
核糖体图谱测序(Ribo-seq)分析 AUF1 敲低后 HBV RNA 的翻译效率(计算核糖体足迹 RF 与 mRNA 水平的比值);Cycloheximide(CHX)阻断蛋白合成,Western blot 检测不同时间点 AUF1 蛋白水平,评估其降解速率。
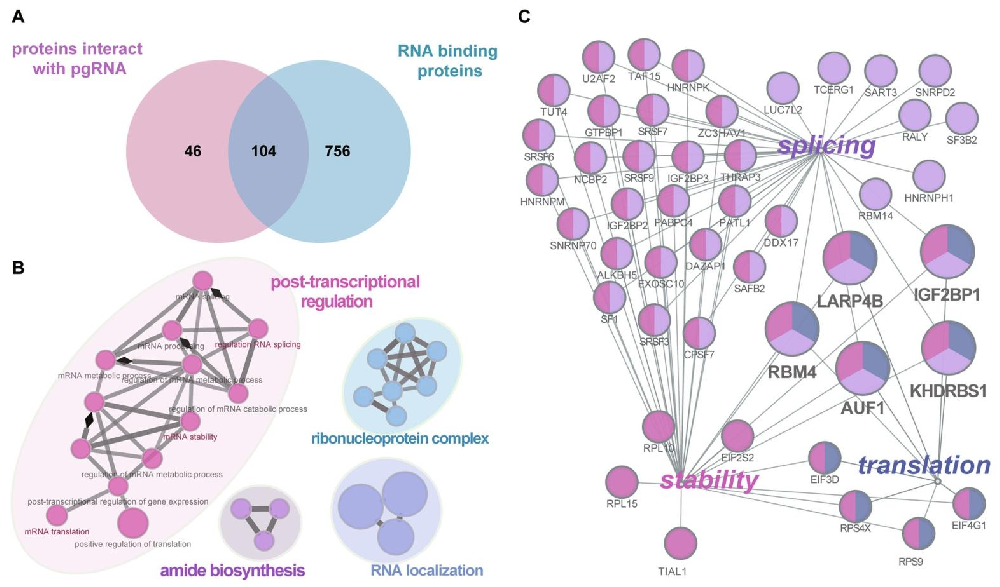
图1:pgRNA 结合的 RBP 筛选
① 通过质谱筛选 HepG2 细胞中与 pgRNA 结合的蛋白,结合已知 RBP 数据库,获得 104 个重叠蛋白(图 1A);
② GO 生物学过程分析显示,这些 RBP 主要富集于转录后调控、RNA 定位等通路,其中 50 个参与转录后调控(图 1B);
③ 在转录后调控通路中,AUF1 与 IGF2BP1 等 5 个 RBP 同时参与 RNA 剪接、翻译及稳定性调控,提示其可能在 HBV RNA 调控中起关键作用(图 1C)。
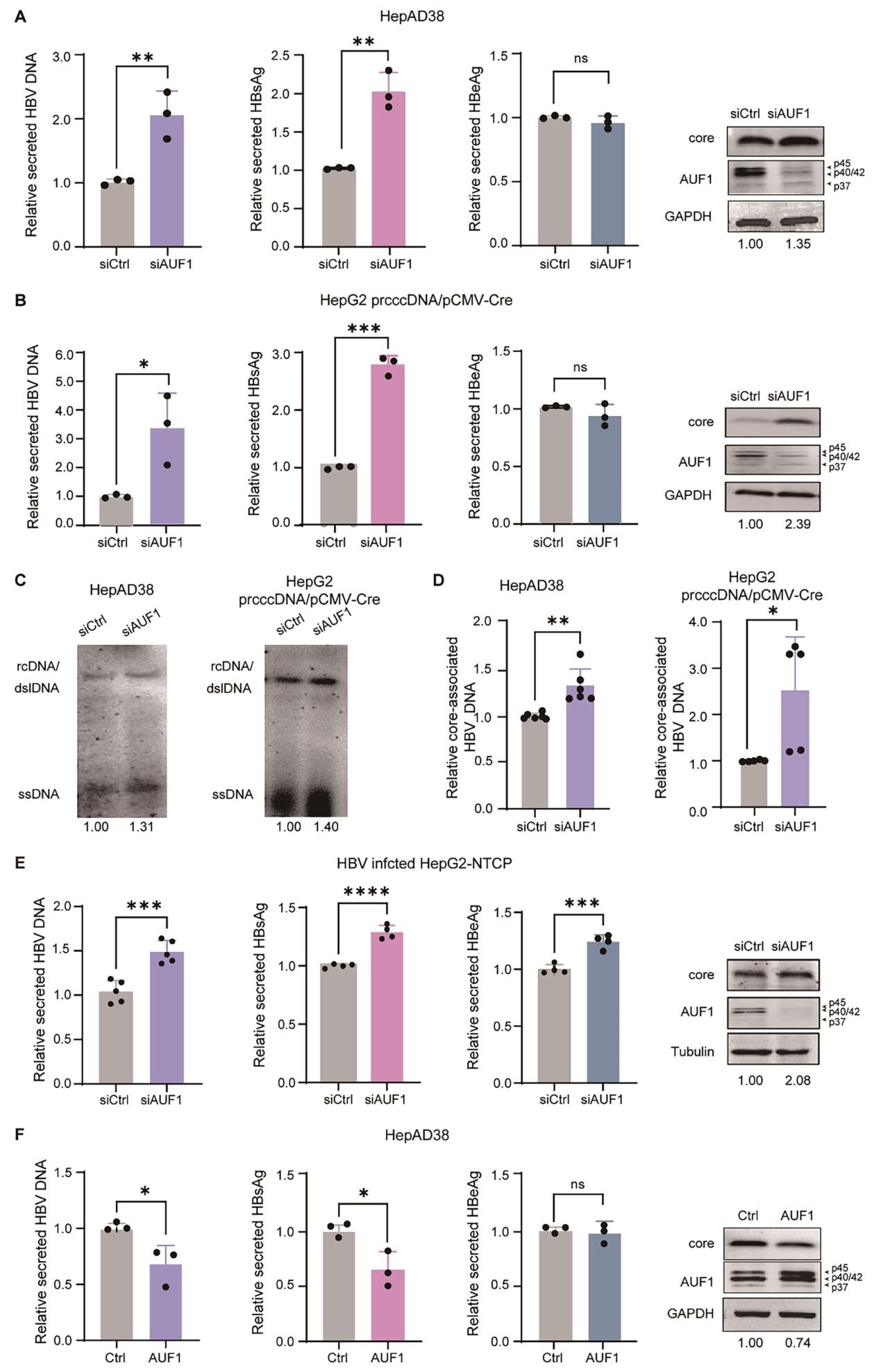
图2:AUF1 抑制 HBV 复制与基因表达
① HepAD38 细胞中敲低 AUF1(siAUF1),上清 HBV DNA、HBsAg 水平显著升高, intracellular 核心蛋白增加(图 2A);② HepG2 细胞共转染 prcccDNA/pCMV-Cre 后敲低 AUF1,上清 HBV DNA、HBsAg 及 intracellular 核心蛋白同样升高(图 2B);③ Southern blot 和 qPCR 显示,AUF1 敲低显著增加 HBV 复制中间体及核心相关 DNA(图 2C、D);④ HBV 感染的 HepG2-NTCP 细胞中,AUF1 敲低促进上清 HBV DNA、HBsAg 及 intracellular 核心蛋白表达(图 2E);⑤ HepAD38 细胞过表达 AUF1 四种亚型,上清 HBV DNA、HBsAg 降低,intracellular 核心蛋白减少(图 2F)。

图3:AUF1 通过促进 HBV RNA 降解降低其水平
① Northern blot 显示,AUF1 敲低显著升高 HepAD38 细胞(3.5 kb pgRNA)及 prcccDNA 转染 HepG2 细胞(3.5 kb、2.4/2.1 kb RNA)的 HBV RNA 水平(图 3A);
② RT-qPCR 进一步确认 AUF1 敲低后 HBV RNA 升高(图 3B);
③ 双荧光素酶报告实验显示,AUF1 敲低对 HBV Enh I、BCP、Enh II+BCP 等启动子 / 增强子活性无显著影响,排除转录调控(图 3C、D);
④ Actinomycin D 阻断转录后,AUF1 敲低减缓 HBV RNA 降解(图 3E),过表达 AUF1 加速 HBV RNA 降解(图 3F)。
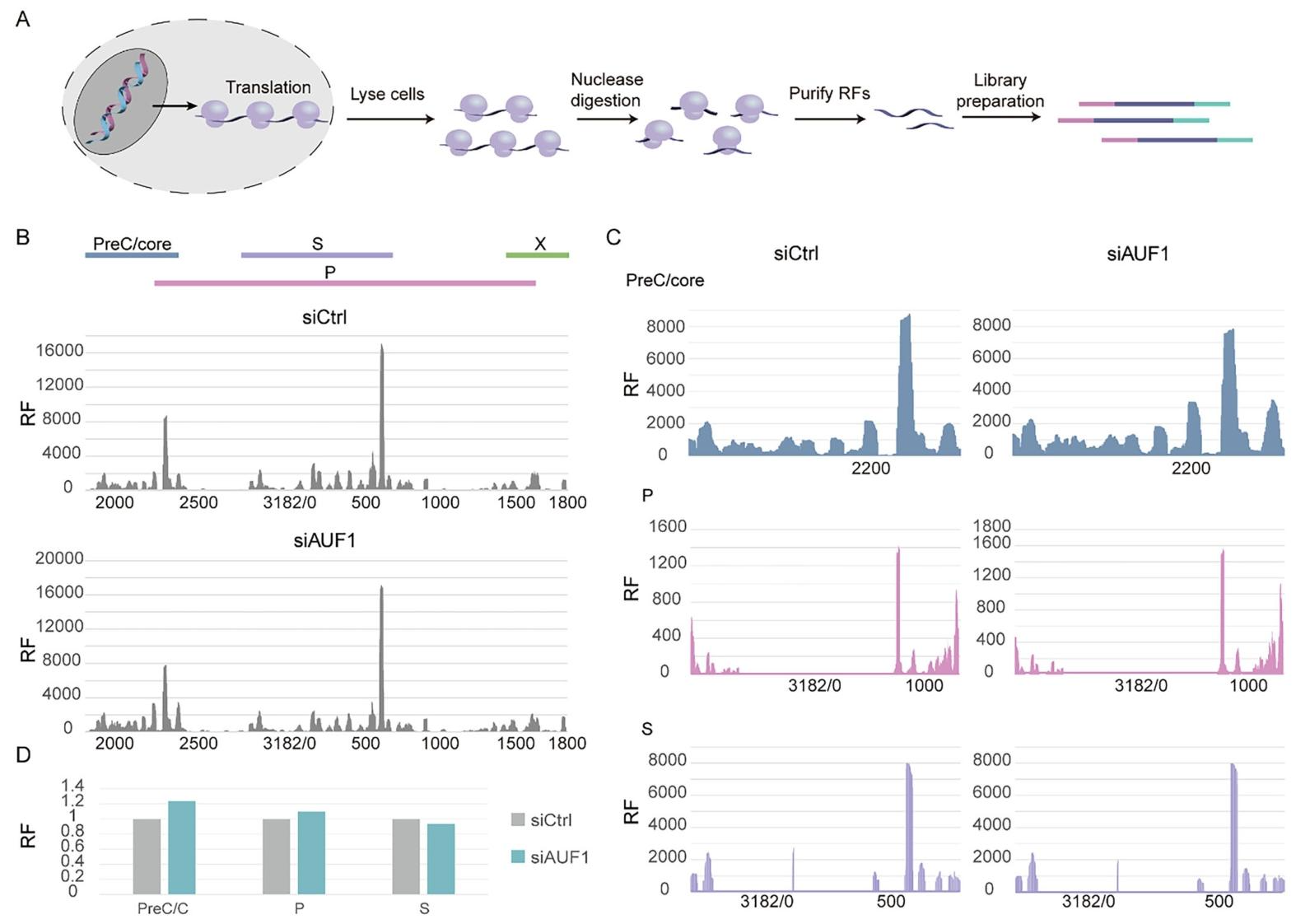
图4:AUF1 不影响 HBV RNA 翻译效率
① Ribo-seq 流程:细胞经 CHX 预处理后裂解,RNase I 消化,纯化核糖体足迹(RF)并构建测序文库(图 4A);
② 两组细胞的 RF 均呈 3 核苷酸周期性,符合翻译特征(图 4B);
③ HBV 各开放阅读框(PreC/core、S、P、X)的 RF 计数显示,AUF1 敲低与对照相比,core、P、S 的 RF 计数无显著差异,提示翻译效率未受影响(图 4C、D)。
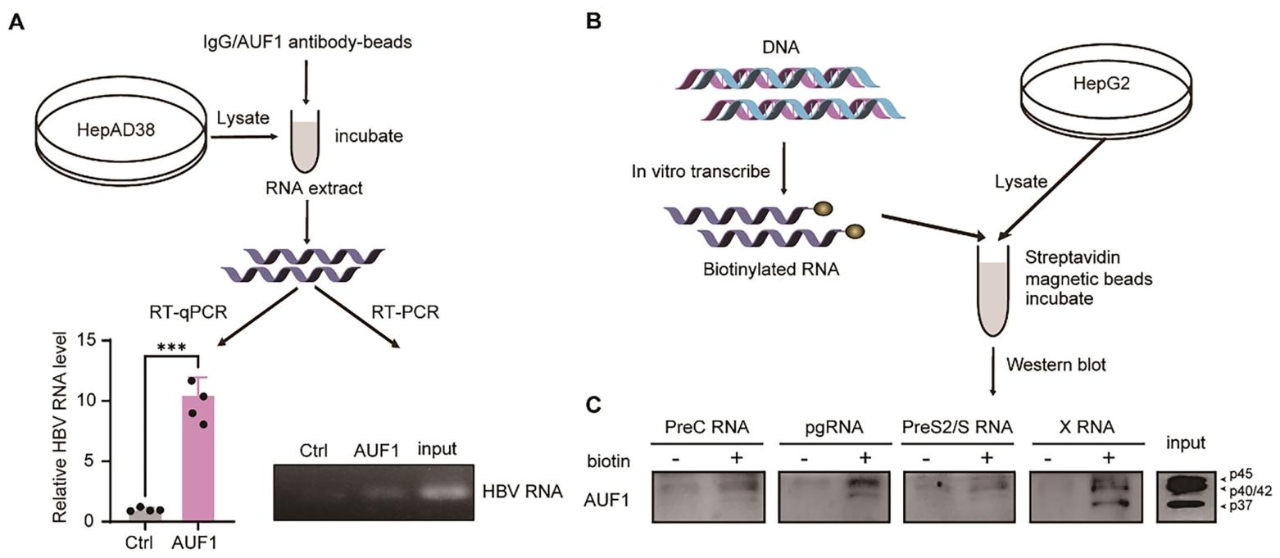
图5:AUF1 直接结合 HBV RNA
① RIP 实验显示,AUF1 抗体富集的 HBV RNA 显著多于 IgG 对照(图 5A);
② RNA pulldown 实验 schematic:体外转录生物素化 HBV RNA 探针,与 HepG2 细胞裂解液孵育后, streptavidin 磁珠富集结合蛋白(图 5B);
③ Western blot 显示,AUF1 可结合 3.5 kb PreC RNA、pgRNA、2.1 kb PreS2/S RNA 及 0.7 kb X RNA,不结合对照 RNA(图 5C)。
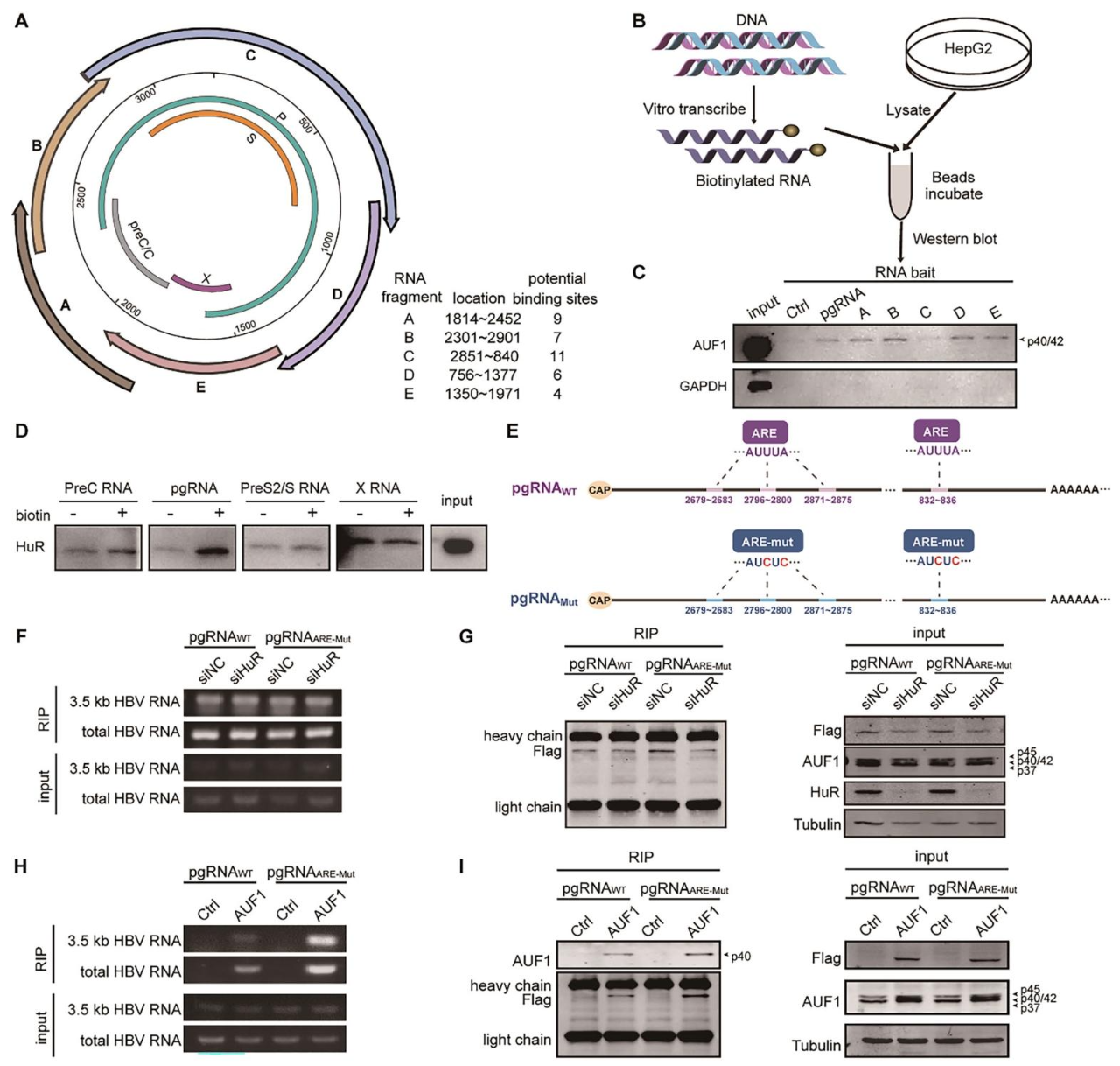
图6:AUF1 结合 HBV RNA 多个位点且不与 HuR 竞争
① 设计覆盖 HBV 全基因组的 5 个重叠生物素化 RNA 片段(A-E,600-1200 nt),预测各片段含多个 AUF1 潜在结合位点(图 6A);
② RNA pulldown 显示,AUF1 可结合所有 5 个片段(图 6B、C);
③ RNA pulldown 确认 HuR 可结合 HBV pgRNA(图 6D);
④ HBV pgRNA 的 ARE motif(AUUUA)突变为 AUCUC 后(图 6E),RIP 实验显示 AUF1 与 WT、Mut pgRNA 的结合无差异,且 HuR 敲低不影响 AUF1 与 HBV RNA 的结合,证明二者无竞争关系(图 6F-I)。
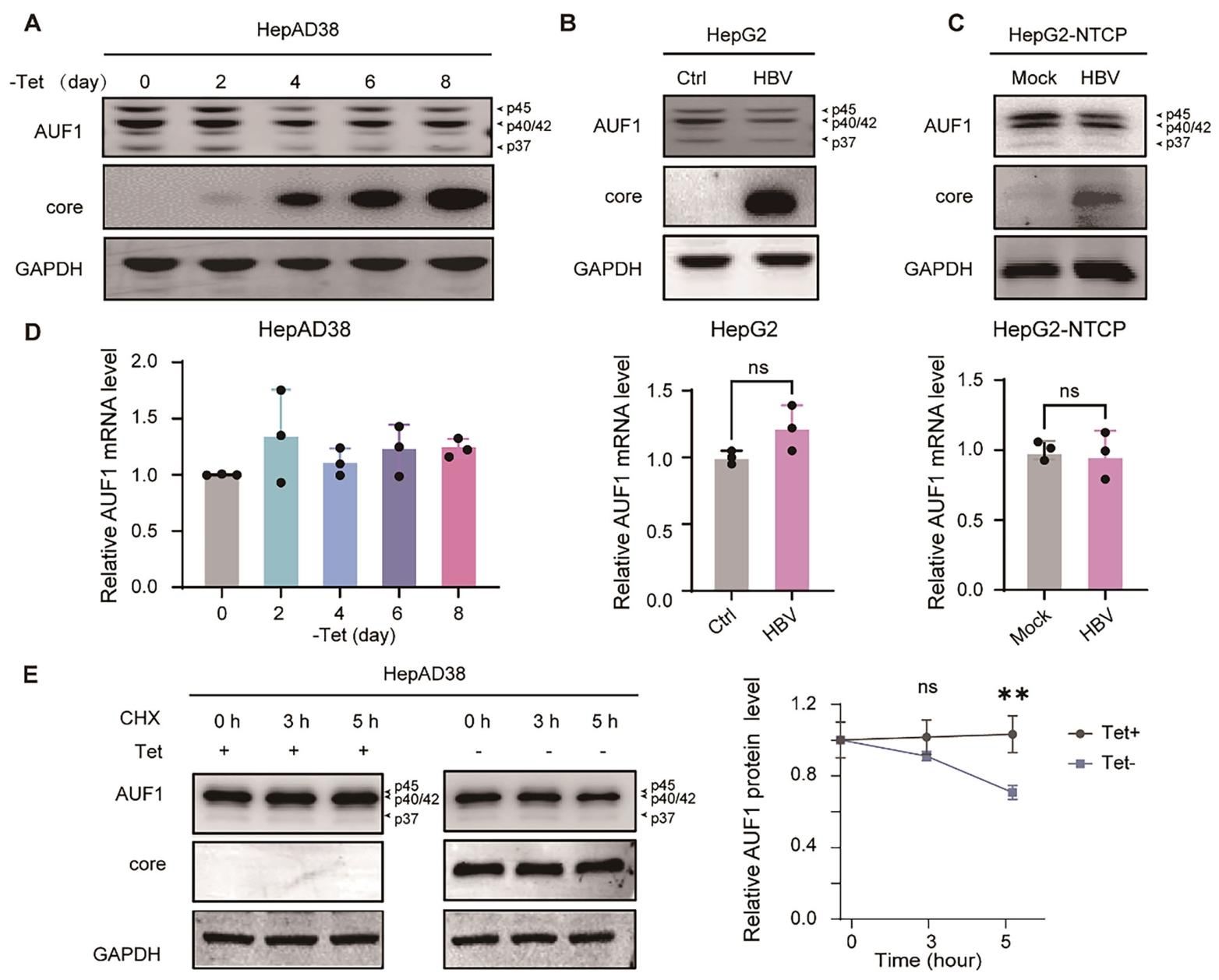
图7:HBV 通过促进 AUF1 蛋白降解下调其水平
① HepAD38 细胞撤去 Tet 诱导 HBV 复制后,AUF1 蛋白水平随时间逐渐降低,8 天时最显著,核心蛋白同步升高(图 7A);
② prcccDNA 转染的 HepG2 细胞中,AUF1 蛋白水平显著低于对照(图 7B);
③ HBV 感染的 HepG2-NTCP 细胞中,AUF1 蛋白表达降低(图 7C);
④ RT-qPCR 显示,上述模型中 AUF1 mRNA 水平无显著变化(图 7D);
⑤ CHX 阻断蛋白合成后,HBV 诱导组(-Tet)的 AUF1 蛋白降解速率显著快于对照(+Tet)(图 7E)。
AUF1 的抗病毒作用:
AUF1 是 HBV 复制的新型负调控因子,在 HBV 感染 / 复制模型中,敲低 AUF1 促进 HBV DNA、抗原及 RNA 表达,过表达则抑制,且该作用不依赖细胞模型类型。
作用机制:
AUF1 通过转录后机制发挥作用,不影响 HBV 启动子 / 增强子活性(排除转录调控),不改变 HBV RNA 翻译效率(Ribo-seq 证实),而是直接结合 HBV RNA 的多个位点(非经典 ARE motif),加速其降解。
HBV 的逃逸机制:HBV 可通过促进 AUF1 蛋白降解(不影响 mRNA)下调其水平,抵消 AUF1 的抗病毒作用,形成 “宿主抑制 - 病毒逃逸” 的动态调控循环。
研究意义:
首次揭示 AUF1 与 HBV 的相互作用及机制,为 HBV 转录后调控提供新视角,靶向 AUF1-HBV RNA 轴或增强 AUF1 稳定性可能成为 HBV 治疗的新策略。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:乳腺癌细胞 ICAM-1:不影响肿瘤生长与 CTL 杀伤,却靠中性粒细胞抑制肺转移
下一篇:吉瑞替尼作为AXL抑制剂在人类实体肿瘤中的抗肿瘤活性