常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-08-23 09:13:04 细胞资源库平台 访问量:87
英文标题:Harnessing Surface Hydrophilicity of Inhalable Nanoparticles for Precision Delivery of Glucagon-like Peptide 1 Receptor Agonists or Anti-Asthmatic Therapeutics
中文标题:利用可吸入纳米粒子的表面亲水性,精确递送胰高血糖素样肽-1受体激动剂或抗哮喘治疗药物
发表期刊:《ACS Nano》
影响因子:16
作者单位:四川大学华西药学院药物靶向与递送系统教育部重点实验室等
作者信息:
Xi Liu, Lie Zhang, Sa Li, Liyun Xing, Mingjie Ni, Minyi Huang, Yuan Huang
1. 肺部药物递送的挑战
肺部药物递送因其高渗透性和丰富血流成为治疗呼吸系统疾病和全身性疾病的理想途径,但面临黏液清除、肺泡巨噬细胞吞噬等生理屏障的阻碍。
2. 创新点
通过调控脂质体表面亲水性(低亲水性LH Lip vs. 高亲水性HH Lip),实现差异化递送:
LH Lip增强跨肺泡上皮转运,促进全身吸收(如GLP-1受体激动剂)。
HH Lip延长肺部滞留时间,提升局部疗效(如布地奈德治疗哮喘)。
1. 脂质体制备与表征
采用薄膜水化-挤出法制备不同DSPE-PEG2000比例的脂质体(LH Lip:MH Lip:HH Lip = 10:2:10:4:10:8)。
通过动态光散射(DLS)、冷冻电镜(Cryo-TEM)和接触角测定验证粒径(~200 nm)、形貌及亲水性梯度。
2. 药效学实验
全身递送模型: T2DM小鼠(KKAγ)吸入GLP-1 RAs(利拉鲁肽/司美格鲁肽)@LH Lip,评估降血糖效果(口服葡萄糖耐量试验)。
局部递送模型: OVA诱导的哮喘小鼠吸入布地奈德@HH Lip,检测炎症因子(IL-4/5/13)和肺组织病理改善。
3. 机制研究
跨细胞转运: LH Lip通过网格蛋白/小窝蛋白多途径内吞,避免溶酶体降解,促进ER-高尔基体分泌。
肺部滞留: HH Lip减少肺泡上皮转运并逃逸巨噬细胞清除。
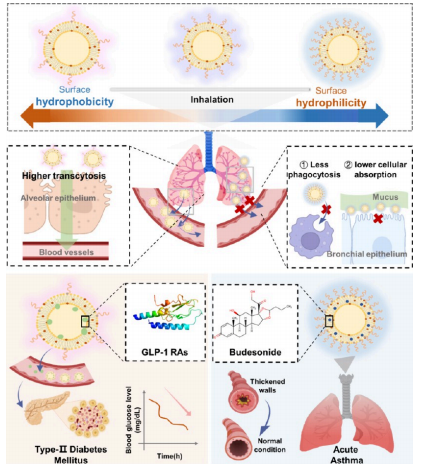
方案1. 不同表面亲水性的可吸入脂质体系统递送GLP-1受体激动剂(GLP-1 RA)及局部递送抗哮喘药物的示意图
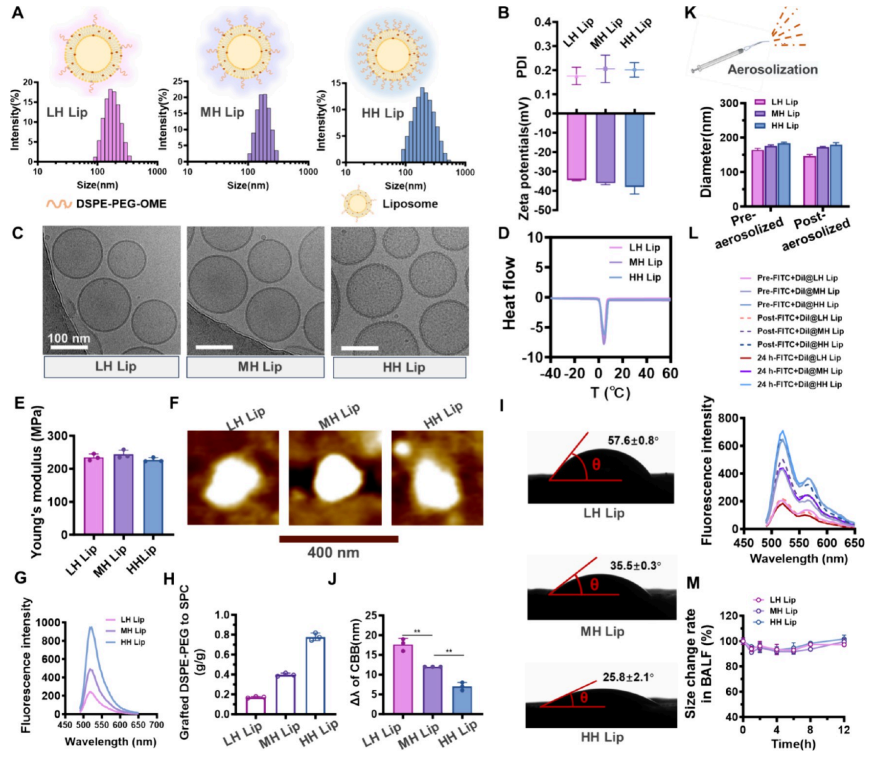
图1:不同亲水性脂质体的制备与表征
(A) 不同表面亲水性脂质体(LH Lip、MH Lip和HH Lip)的示意图及粒径分布。
(B) 不同表面亲水性脂质体的多分散指数(PDI)和zeta电位。
(C) LH Lip、MH Lip和HH Lip的冷冻透射电镜图像,比例尺= 100 nm。
(D) 不同亲水性脂质体在−40至60°C加热温度下的差示扫描量热(DSC)曲线。
(E) 不同亲水性脂质体的杨氏模量(AFM表征,n=3)。
(F) AFM显示不同亲水性脂质体在不同作用力下的形变图像,比例尺= 400 nm。
(G) FITC标记的DSPE-PEG2000在460 nm激发波长和490−620 nm发射波长下制备的不同表面亲水性脂质体荧光光谱。
(H) 不同亲水性脂质体表面DSPE-PEG2000与脂质的接枝比例(n=3)
(I) 不同亲水性脂质体的接触角测试结果(n=3)。
(J) LH Lip、MH Lip和HH Lip在脂质浓度为1.25 mg·mL−1时孵育后考马斯亮蓝的红移值(Δλ)。
(K) 不同亲水性脂质体经微喷雾气溶胶化处理前后的直径变化(均值±标准差,n=3)。
(L) FITC+DiI双标记脂质体(Pre-FITC+DiI@LH Lip、Pre-FITC+DiI@MH Lip和Pre-FITC+DiI@HH Lip)经微喷雾气溶胶化处理(命名为Post-FITC+DiI@ Lips)及与小鼠支气管肺泡灌洗液(BALF)孵育24小时(命名为24 h-FITC+DiI@Lips)后的荧光光谱,激发波长460 nm,发射波长490−620 nm。(M)BALF中脂质体颗粒尺寸在12小时内变化情况(n = 3)。
图A、K等标签均通过https://获取,使用https://的许可协议授权。
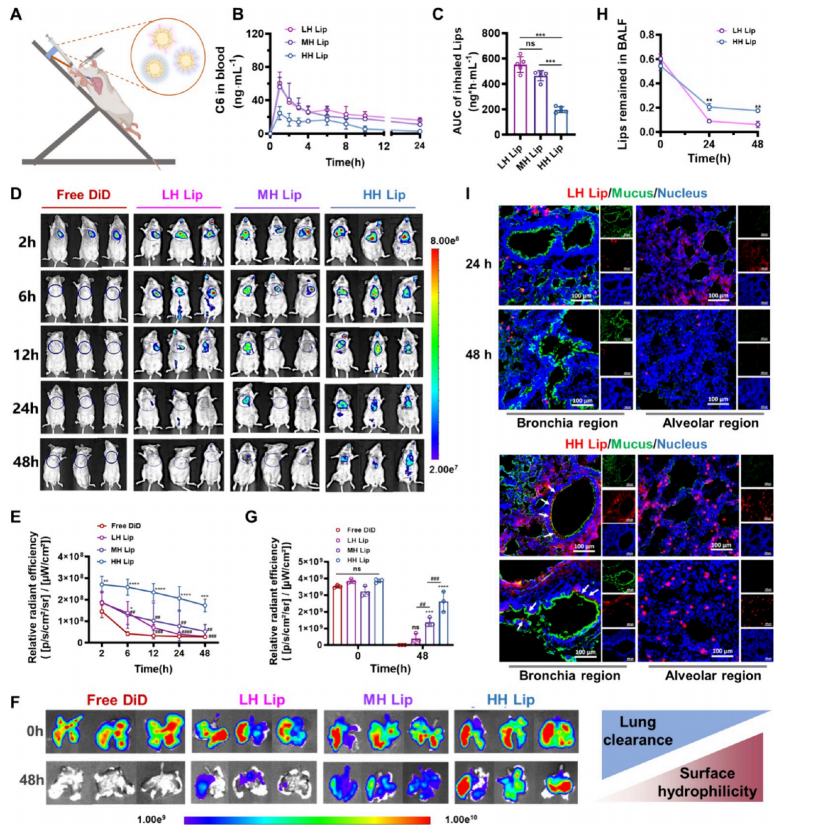
图2:表面疏水性调控决定吸入脂质体在体内的分布
(A) 小鼠通过微喷雾器吸入脂质体悬浮液的示意图。实验过程中,小鼠被麻醉后固定在45°倾斜平台上,头部向上,身体保持直立。在钝性镊子和喉镜引导下,预先装载脂质体溶液的微雾化喷雾器通过暴露的气管开口插入气道约2.6厘米,随后快速注射(给药量<50 μL)完成雾化过程。
(B、C) 小鼠吸入后24小时内血药浓度曲线及LH Lip、MH Lip和HH Lip负载荧光染料香豆素-6(C6)的曲线下面积(AUC)转换值,n = 5。
(C、E) 实时IVIS成像与定量感兴趣区域(ROI)分析显示正常小鼠吸入DiD标记的LH Lip、MH Lip和HH Lip后的分布情况,n = 3。(*、#)各组在特定时间点与游离DiD及DiD@HH Lip的平均值对比。
(F、G) DiD标记的LH Lip、MH Lip和HH Lip吸入48小时后肺组织的IVIS成像及荧光定量分析,n = 3。(H)0、24、48小时吸入不同亲水性脂质体的小鼠支气管肺泡灌洗液(BALF)中DiI荧光强度,n = 3。(*)各组在特定时间点与DiD@LH Lip的平均值对比。
(I) 共聚焦显微图像显示肺组织中黏液与不同亲水性脂质体共定位情况(孵育24或48小时),图例说明:红色为DiI标记脂质体;绿色为AF488标记的WGA黏液;蓝色为细胞核。统计学显著性通过单因素方差分析(ANOVA)计算,随后采用Tukey多重比较法进行校正。符号说明:(*)表示P < 0.05,(**、##)表示P < 0.01,(***、###)表示P < 0.001,(****、####)表示P<0.0001。
标签(A)是使用https:/www.biorender.com软件创建的,并附有许可协议。
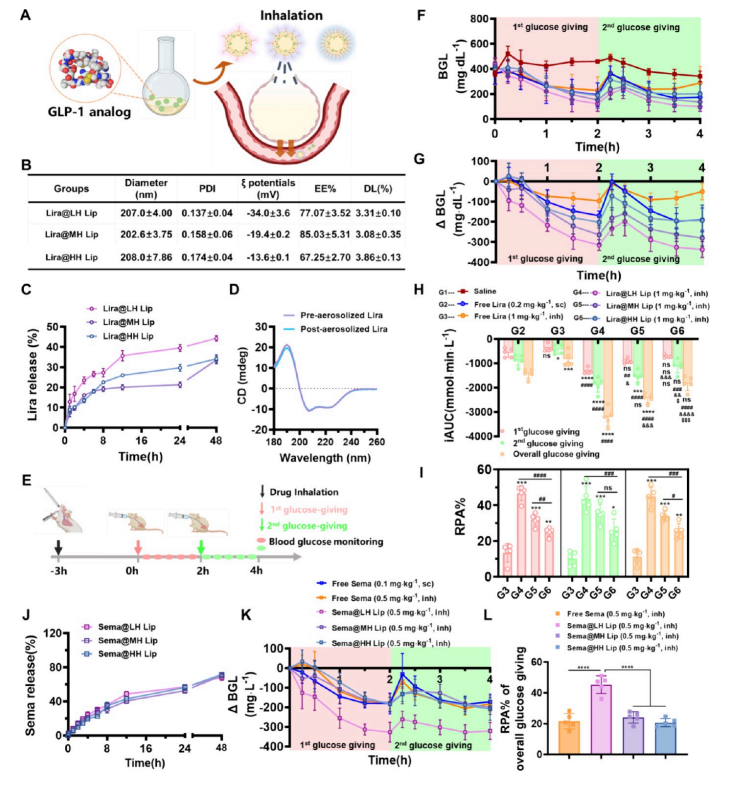
图3:载有GLP-1激动剂的低亲水性脂质体比高亲水性脂质体具有更好的降糖效果
(A) 吸入后不同表面亲水性GLP-1受体拮抗剂载脂质体的示意图,包括GLP-1受体拮抗剂的药物包封、吸入过程及进入血液循环的吸收路径。
(B) 不同表面亲水性载脂质体包裹Lira的表征结果(n=3)。
(C) 模拟肺生理培养基PBS(pH 7.4)中不同表面亲水性Lira@Lip的体外释放行为(n=3)。
(D) 雾化前后的Lira圆二色光谱表征。
(E) 口服葡萄糖耐量试验(OGTT)流程示意图。对经过过夜禁食的T2DM KKAy小鼠进行空腹血糖(FBG)水平检测。分别雾化给予生理盐水(G1)、游离Lira溶液(1 mg·kg−1,G3)、Lira@LH Lip(1 mg·kg−1,G4)、Lira@ MH Lip(1 mg·kg−1,G5)或Lira@HH Lip(1 mg·kg−1,G6),G2组小鼠皮下注射游离Lira溶液(0.2 mg·kg−1)。在口服葡萄糖溶液(0.2克/千克−1)给药后0、15、30、60、90和120分钟测量血糖水平。
(F) 吸入不同Lira制剂后,T2DM KKAy小鼠在口服葡萄糖耐量试验(OGTT)中的原始血糖水平(BGL),n = 5。
(G) 吸入不同Lira制剂后OGTT期间血糖水平增量(以FBG为基准减去,单位:ΔBGL)(n=5)。(H)吸入不同Lira制剂后OGTT期间血糖增量曲线下面积(iAUC)(n=5)。(*、#、$)分别表示与G2、G3、G4和G5组的平均值对比。
(H) Lira制剂的相对药理学生物利用度(RPA),RPA = (iAUCGx /Lira剂量Gx)/(iAUCG2/Lira剂量G2),n = 5。(*)表示与G3组对比,#表示组间比较。
(J) Sema@Lip制剂在模拟肺生理培养基PBS(pH 7.4)中的体外释放行为,n = 3。
(K) OGTT期间血糖水平增量(以FBG为基准减去,单位:ΔBGL)(n=5)。小鼠分别吸入游离Sema、Sema@LH Lip、Sema@MH Lip和Sema@HH Lip (0.5毫克/千克−1),皮下注射游离Sema (0.1毫克/千克−1)。
(L) Sema制剂在整个葡萄糖给药期间的相对药理学生物利用度(RPA),RPA = (iAUCGx /Sema剂量Gx)/(iAUCG2/Sema剂量G2),n = 5。(*)表示与Sema@LH Lip组对比。[数据以均值±标准差表示。统计学显著性通过单因素方差分析(ANOVA)计算,随后采用Tukey多重比较法进行校正。(*、#、&、$)表示P < 0.05,(**、##、&&、$$)表示P < 0.01,(***、###、&&、$$$)表示P<0.001。
图A和E使用https:/www.biorender.com软件创建,相关授权协议详见说明。
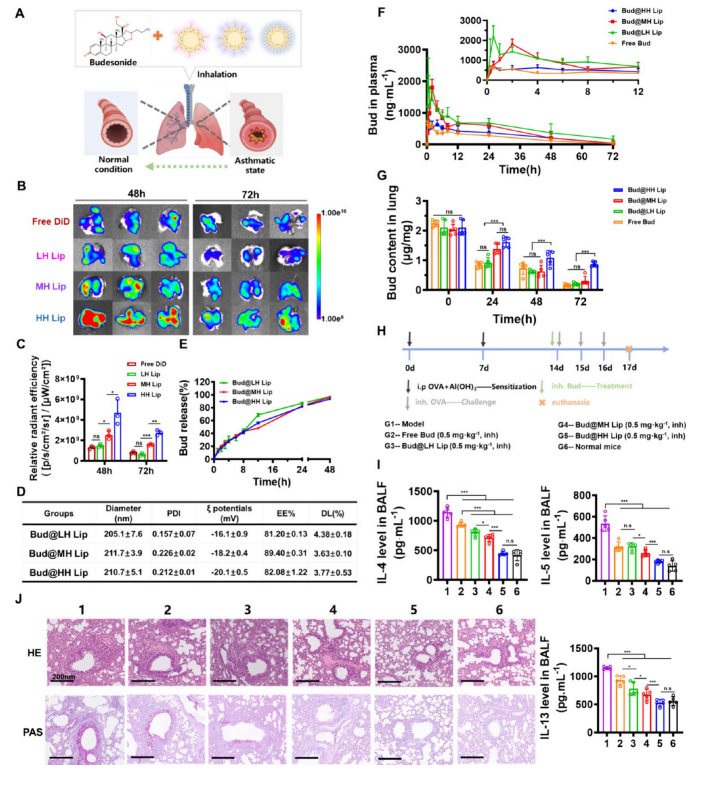
图4:高亲水性脂质体显著增强了布地奈德对急性哮喘的肺部滞留能力及疗效
(A) 在卵黄酸诱导的急性哮喘小鼠模型中,吸入载有布地奈德(Bud)的脂质体后,肺组织从哮喘状态恢复至正常状态的示意图。
(B,C) IVIS成像及定量感兴趣区域(ROI)分析显示,48小时和72小时后卵黄酸诱导急性哮喘小鼠体内DiD标记的DiD-labeled LH Lip、MH Lip、HH Lip及游离DiD的分布情况,n = 3。
(D) 不同表面亲水性载药脂质体的布地奈德特性分析,n = 3。
(E) 不同表面亲水性脂质体中Bud在模拟肺生理培养基中48小时的释放曲线,PBS(pH 7.4),n = 3。
(F) 蛋黄酸诱导急性哮喘小鼠吸入后Bud@LH Lip、Bud@MH Lip、Bud@HH Lip及游离Bud的血浆浓度曲线,n = 5。
(G) 蛋黄酸诱导急性哮喘小鼠吸入Bud@LH Lip、Bud@MH Lip、Bud@HH Lip及游离Bud后0小时、24小时、48小时和72小时肺部布地奈德含量,n = 5,(*)表示组间比较,(ns)表示无显著性差异。
(H) 蛋黄酸诱导急性哮喘小鼠模型中Bud治疗的实验设计示意图。哮喘小鼠分别接受生理盐水(G1)、游离Bud悬浮液(G2)、Bud@LH Lip(G3)、Bud@MH Lip(G4)或Bud@HH Lip(G5)吸入给药,正常小鼠则给予生理盐水(G6)。
(I)支气管肺泡灌洗液中炎症细胞因子IL-4、IL-5和IL-13的表达水平,样本量n = 5。
(J) OVA诱导急性哮喘小鼠在实验终点时肺组织切片的苏木精-伊红(HE)染色及过碘酸希夫(PAS)染色结果。[数据以均值±标准差表示。统计学显著性通过单因素方差分析后采用Tukey多重比较法计算。(*)P < 0.05,(***)P<0.01,(***)P<0.001]。
标签(A)使用https:/www.biorender.com软件创建并附有许可协议。
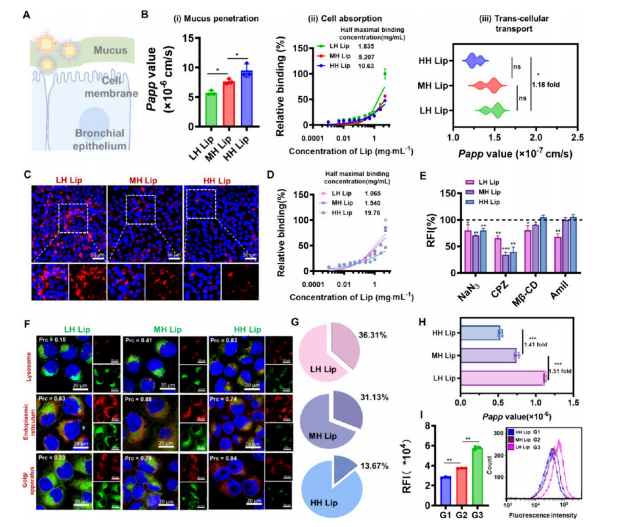
图5:不同亲水性的脂质体对不同肺细胞表现出差异化的生物学特性
(A) 不同亲水性脂质体在支气管上皮细胞中的转运过程示意图。
(B) 不同亲水性脂质体在支气管上皮细胞中的转运过程研究,包括:(i)在模拟支气管黏液构建的3D transwell小室中,不同疏水性脂质体的表观渗透系数(Papp);(ii)采用Calu-3细胞进行膜亲和力检测,4°C条件下脂质体的细胞结合率。通过Graphpad软件拟合计算脂质体浓度-结合率曲线及半最大结合浓度(n=3);(iii)不同疏水性脂质体在Calu-3单层上皮细胞中的表观渗透系数(Papp),n = 3。
(C) 共聚焦显微镜代表性图像显示不同疏水性脂质体在NCI-H441细胞中的内化过程,比例尺= 50 μm。图例说明:蓝色为细胞核,红色为DiI标记的脂质体。
(D) 采用4°C条件对NCI-H441细胞进行膜亲和力检测时,不同疏水性脂质体的细胞结合率。脂质体浓度-结合速率曲线及半最大结合浓度通过Graphpad软件进行拟合计算,样本量n = 3。
(E) 采用多种内吞阻断抑制剂(包括能量阻断用叠氮化钠、网格蛋白介导内吞阻断用CPZ、洞蛋白介导内吞阻断用β-CD以及微胞饮途径阻断用阿米洛利Amil)研究脂质体的细胞摄取途径,(*)表示与未使用化学抑制剂处理的对照组相比,样本量n = 5。
(F) 共聚焦显微镜代表性图像显示脂质体与溶酶体、内质网及高尔基体等细胞器的共定位情况,Pearson相关系数(Prc)通过ImageJ软件计算;比例尺= 20 μm。图例说明:蓝色表示细胞核,红色表示细胞器,绿色表示DiI标记的脂质体。
(G) 不同疏水性的脂质体在NCI-H441细胞中的平均胞吐速率,样本量n = 3。(H)不同疏水性脂质体在NCI-H441单层上皮细胞中的表观渗透系数(Papp),样本量n = 3。
(I) 通过流式细胞术检测巨噬细胞对HH Lip(G1期)、MH Lip(G2期)和LH Lip(G3期)的摄取情况,样本量n = 3。[数据以均值±标准差表示。统计学显著性通过单因素方差分析结合Tukey多重比较法计算。(*)P < 0.05,(**)P < 0.01,(***)P<0.001]。
图A标签使用https:/www.biorender.com软件创建并附有授权协议。
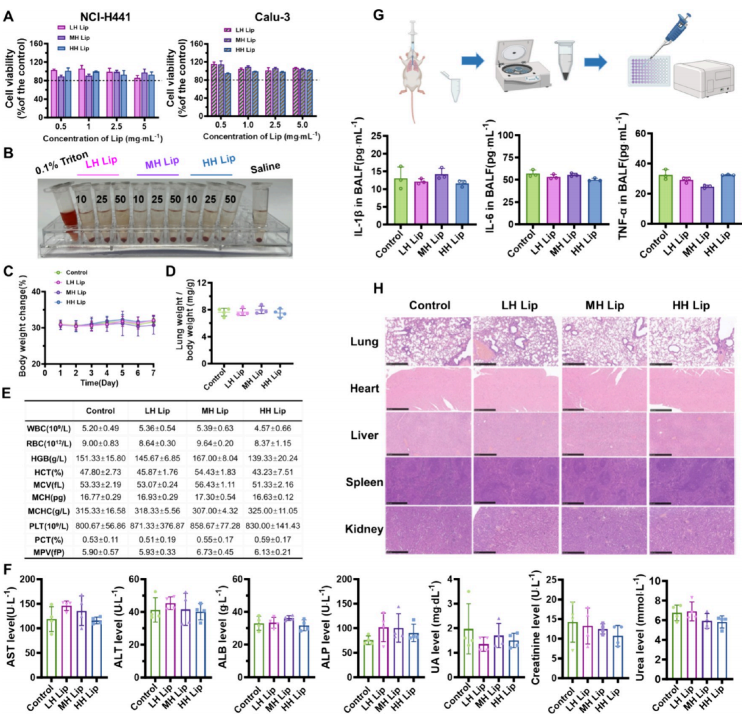
图6:具有不同亲水性的吸入脂质体表现出良好的体外和体内生物相容性
(A) NCI-H441肺泡上皮细胞与Calu-3支气管上皮细胞在脂质体孵育3小时后的存活率研究,n = 5。
(B)脂质体孵育3小时后红细胞溶血的物理图像,n = 3。
(C) ICR小鼠两次吸入空白脂质体(LH Lip、MH Lip或HH Lip)或生理盐水后7天体重变化,n = 5。
(D) 实验终点时肺重与体重比值。
(E) ICR小鼠两次吸入脂质体或生理盐水后的血常规指标汇总表。
(F) 实验终点时血液中肝功能酶(AST、ALT、ALB、ALP)及肾功能酶(UA、肌酐、尿素)表达水平。
(G) 小鼠支气管肺泡灌洗液中炎症因子IL-1β、IL-6和TNF-α的表达水平。
(H) 实验终点时小鼠肺、心、肝、脾、肾组织切片的苏木精-伊红(HE)染色结果。[数据以均值±标准差表示。统计学显著性通过单因素方差分析结合Tukey多重比较法计算。
(*)P < 0.05,**P<0.01,***P<0.001]图6G部分使用需授权协议的https:/www.biorender.com软件制作。
1. 靶向性与疗效
LH Lip组GLP-1 RAs的血药浓度AUC较HH Lip高2.1倍,相对药理生物利用度达45%。
HH Lip组布地奈德在肺部的滞留时间延长至72小时,炎症因子水平恢复至正常。
2. 免疫机制
LH Lip激活肺泡上皮细胞转运通路,HH Lip通过PEG屏蔽效应减少巨噬细胞摄取。
3. 安全性
所有脂质体在体外(细胞活力)和体内(血清生化、组织病理)均显示良好生物相容性。
4. 转化意义
为肺部递送系统设计提供“亲水性-递送目标”匹配策略:低亲水性用于全身给药,高亲水性用于局部治疗。
减少布地奈德给药频率,提升GLP-1 RAs口服替代方案的可行性。
5. 机制创新
首次揭示表面亲水性通过调控内吞-胞吐全流程影响纳米颗粒的肺部分布命运。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:RXR 激动剂 S169:靶向 NTCP 转运,为 HBV/HDV 治疗提供新希望
下一篇:类风湿关节炎新机制:GRK2 “勾结” TRAF2 激活炎症信号,靶向抑制或成新疗法!