常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-08-13 17:32:55 细胞资源库平台 访问量:99
肺癌是全球范围内最常见的恶性肿瘤之一,每年新发病例约220万例,死亡病例约180万例。免疫检查点抑制剂(ICI)的出现彻底改变了癌症治疗格局,特别是对晚期肺癌患者的临床疗效显著改善。然而,ICI治疗的显著应答仅限于少数患者,大多数患者对治疗反应有限。目前已有多种肿瘤特征被用作ICI应答的预测性生物标志物,如PD-L1表达、T细胞浸润、肿瘤突变负荷等,但这些指标在临床应用中并不完全可靠。
抗肿瘤免疫反应需要肿瘤局部微环境与全身免疫系统的协调配合。近期研究表明,ICI治疗后的T细胞显著富集了新的克隆型,这些克隆型可能从肿瘤外部位点(如外周血和引流淋巴结)募集而来。外周血中循环的新抗原特异性CD8+ T细胞的识别进一步证实了循环T细胞在抗肿瘤免疫监视和治疗中的重要作用。然而,由于缺乏有效的追踪工具,肿瘤循环系统中的细胞如何动态响应ICI并与局部肿瘤微环境相互作用仍不清楚。
目前的研究方法存在明显局限性。先进技术如单细胞测序、多重高分辨率成像技术和空间转录组学虽然能提供高分辨率的细胞图谱,但由于获取患者纵向肿瘤样本的固有挑战,只能获得治疗前后特定时间点的快照,无法直接追踪T细胞的分化、增殖和肿瘤杀伤过程。肿瘤类器官模型的兴起为基础研究与临床实践搭建了桥梁,但现有模型能否模拟局部肿瘤与全身免疫系统的相互作用,以及如何用于解析ICI诱导的动态免疫反应仍不明确。
近期,清华大学生物医学工程学院刘鹏副教授、北京航空航天大学生物与医学工程学院陈晓芳副教授、北京大学人民医院杨帆教授团队合作,在Cell Stem Cell 期刊上发表了一篇题为An organoid co-culture model for probing systemic anti-tumor immunity in lung cancer 的研究论文,该研究建立的GLI共培养模型为理解肿瘤局部微环境与全身免疫系统的相互作用提供了重要工具。该模型不仅保留了PDOs中的原有免疫细胞,还整合了循环PBMCs,提供了比现有策略更全面的体外肿瘤模型。GLI模型能够准确预测患者对免疫治疗的反应,为个体化免疫治疗策略的制定提供了有力支持。
1,GLI共培养模型的建立与验证:研究团队开发了一种新颖的凝胶-液体界面(GLI)共培养模型,将患者来源的肺癌类器官(LCOs)置于Matrigel与培养基的界面处,与来自同一患者的外周血单核细胞(PBMCs)进行高效相互作用。该模型基于超疏水微孔阵列芯片(GLI-SMARchip)构建,包含1.5μL微孔阵列,底部为薄玻璃便于共聚焦成像,上层覆盖超疏水聚合物实现微孔隔离。通过优化沉降时间(10分钟)和Matrigel浓度(80%),LCOs能稳定保持在凝胶边缘长达6天。与传统共培养方法相比,GLI模型在αPD1处理下显示出最有效的PBMC浸润和肿瘤细胞杀伤效果。
2,小鼠模型验证ICI体内免疫反应的重现:使用MC38和LLC小鼠肿瘤衍生的类器官(MDOs)验证GLI模型的有效性。体内实验显示,αPD1治疗能抑制MC38但不能抑制LLC肿瘤生长,与已知的ICI敏感性(MC38)和抗性(LLC)表型一致。相应的GLI模型表现出类似的反应模式,αPD1处理的MC38模型出现显著细胞死亡,而LLC模型则无明显变化。流式细胞术分析显示,αPD1处理后MC38来源的GLI模型和肿瘤组织中CD3+ T细胞浸润显著增加,而LLC来源的模型则呈现下降趋势。此外,MC38来源的样本中CD8+ T细胞的IFNγ和CD107a产生显著上调,表明T细胞激活和细胞毒性功能增强。
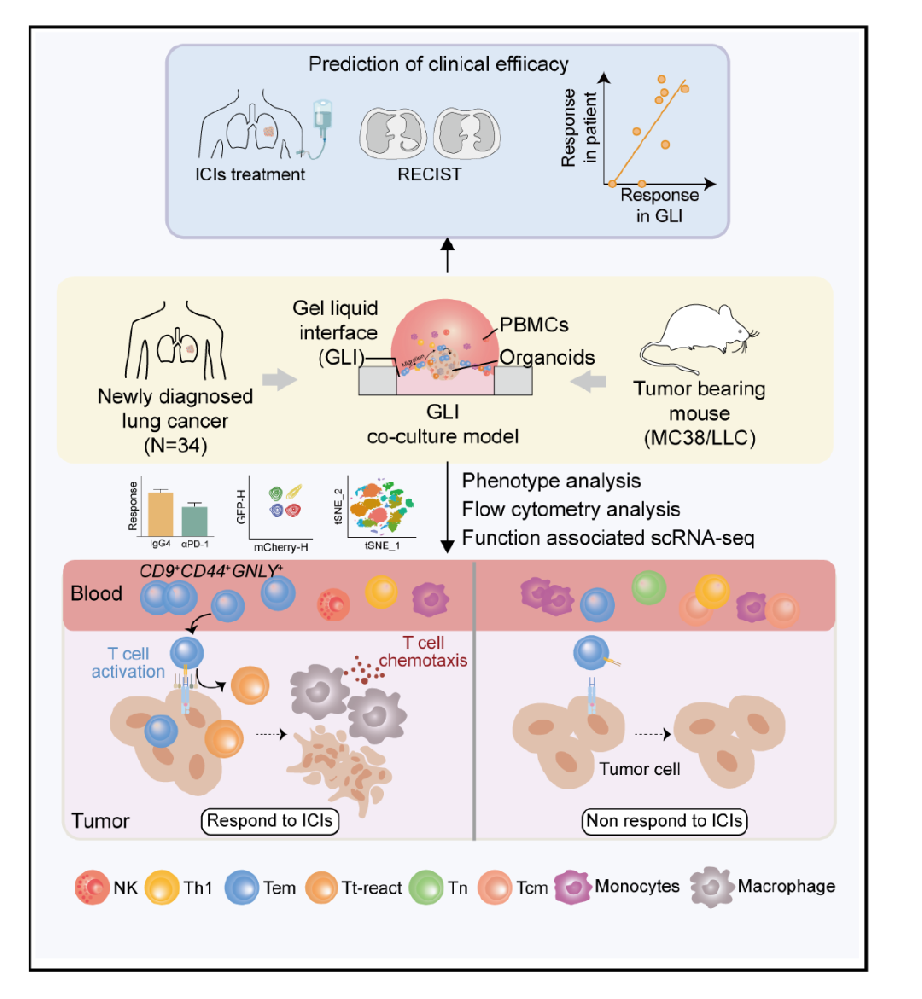
图1 流程示意图
3,GLI模型准确预测患者免疫治疗反应:在34例治疗初始肺癌患者中建立GLI共培养模型,包括25例腺癌、5例鳞癌和3例小细胞肺癌。通过响应指数(Ri,死亡肿瘤细胞与总肿瘤细胞的比值)评估细胞毒性效应。结果显示,αPD1和αPD1/化疗组合显著提高了Ri值,与临床试验结果一致。以Ri=0.245为阈值区分免疫治疗应答者(R)和非应答者(NR)。9例接受αPD1治疗的患者中,4例部分缓解(PR)、3例疾病稳定(SD)、2例疾病进展(PD)。GLI模型的反应与临床结果高度一致,而LCO单独培养的结果与临床不符,表明循环T细胞在抗肿瘤免疫中的关键作用。
4,外周血肿瘤反应性T细胞的鉴定与功能验证:通过悬浮共培养激活肿瘤反应性T细胞,发现应答组(R组)中表达IFNγ和CD107a的CD8+ T细胞频率显著上调,而非应答组(NR组)无明显变化。使用激活后的CD8+ T细胞与自体肿瘤类器官建立GLI模型,观察到R组肿瘤细胞死亡增强。重要的是,患者来源的PBMCs无法被异体类器官激活,也不能杀伤异体类器官,证明了类器官诱导的循环T细胞激活和细胞毒性效应具有抗原特异性。相关性分析显示,GLI模型的Ri与循环T细胞的肿瘤反应性显著相关,而与总T细胞频率无关。
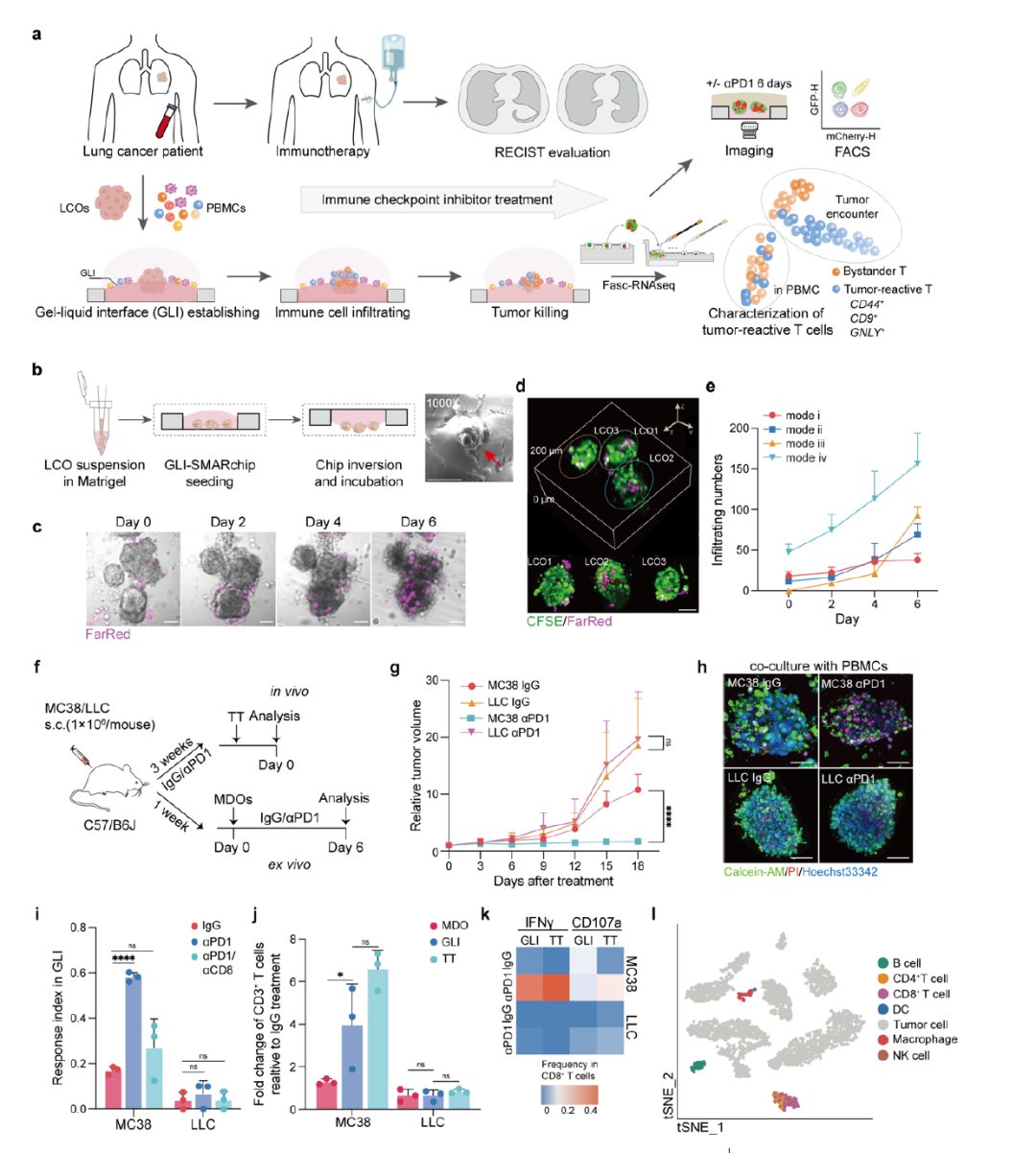
图2 GLI 共培养模型的建立与验证
5,单细胞测序揭示肿瘤反应性T细胞特征:通过FascRNA-seq分析8例患者样本的21,162个细胞,结合47例接受αPD1治疗的肺癌患者参考数据集,构建了包含154,254个T细胞的图谱。分析发现,R组PBMCs中的T细胞主要由效应记忆T细胞(Tem)和增殖T细胞(Tprof)组成,而NR组主要包含初始T细胞(Tn)和中央记忆T细胞(Tcm)。R组的PBMC-T细胞表现出效应记忆和新抗原特异性循环T细胞的特征,上调了干性(TCF7)和迁移(ITGB2, ITGB7)相关基因表达。在GLI共培养中,R组T细胞频率显著增加,特别是Tem、Tprof和一个特定的T细胞亚群(Tt-react),后者表现出促进的效应和激活特征。
6,CD9+CD44+GNLY+标记肿瘤反应性T细胞:通过生物信息学方法鉴定具有肿瘤反应性潜能的Tem细胞的基因表达特征。在与αPD1诱导的肿瘤细胞死亡最显著相关的基因中,CD9、CD44和GNLY被确定为循环T细胞肿瘤反应性潜能的标志物。CD44是免疫反应的关键调节因子,特别在T细胞激活和记忆细胞维持中发挥重要作用;GNLY主要由激活的CD8+ T细胞产生,与细胞毒性相关;CD9作为CD28的共刺激信号,在T细胞激活和迁移中发挥重要作用。在R组患者中,这三个基因在PBMC-T细胞和GLI共培养收获的T细胞中的表达水平均显著高于NR组。TCGA数据库分析显示,GNLY、CD9和CD44的高表达与显著更好的总生存率相关。
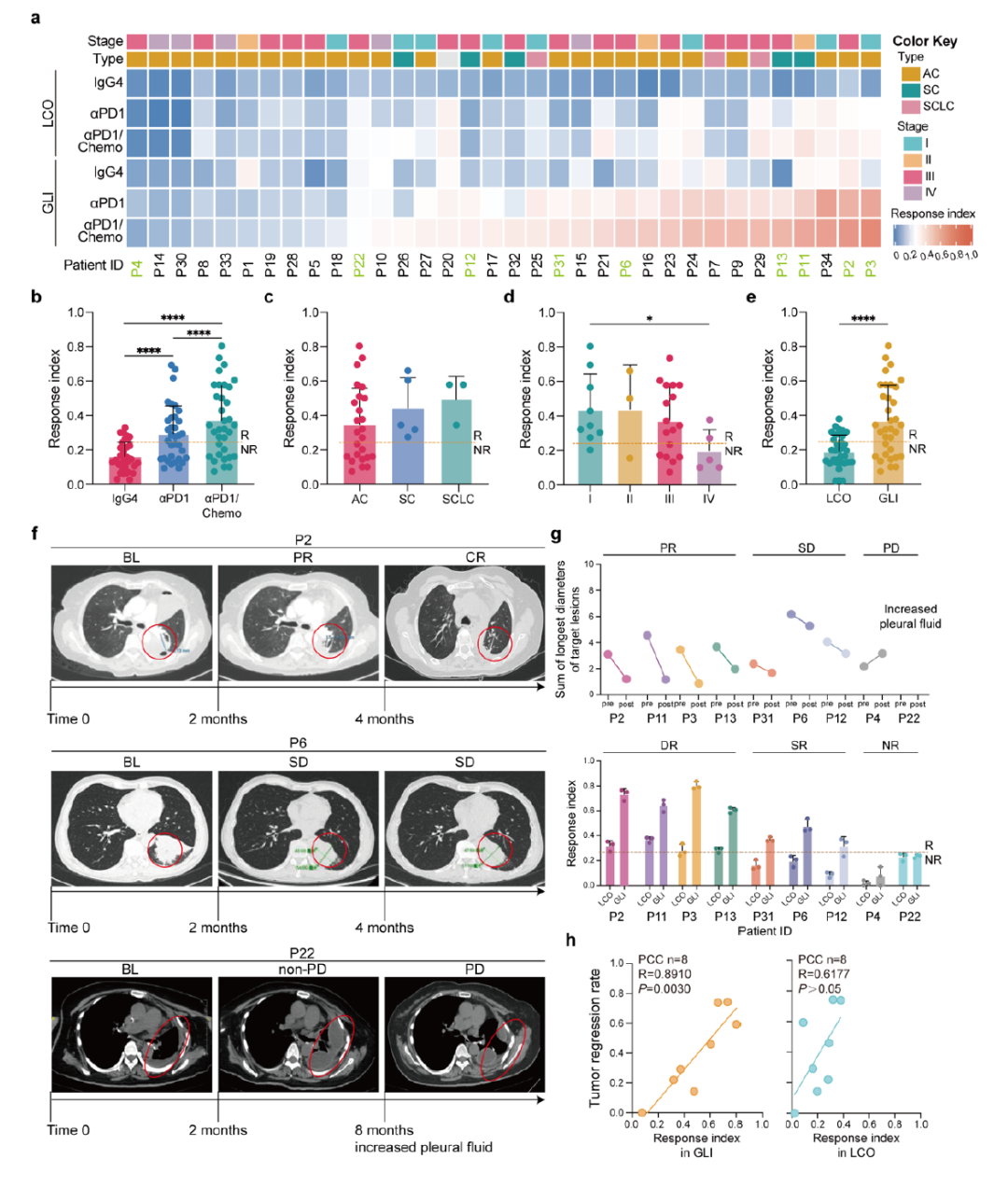
图3 GLI 共培养模型的反应特征体现了免疫治疗的临床结果
该研究系统性地证明了外周血中存在肿瘤反应性T细胞,这些细胞可作为免疫治疗疗效的指标。CD9+CD44+GNLY+ Tem细胞的鉴定为临床诊断提供了新的生物标志物,有望用于筛选免疫治疗获益患者。此外,本研究揭示了不同反应模式(DR和SR)对应不同的局部和全身免疫状态,为理解免疫治疗机制提供了新的视角。该研究对癌症免疫治疗领域具有重要的临床转化价值,为开发更有效的免疫治疗策略和个体化治疗方案奠定了基础。同时,GLI模型的建立也为其他实体肿瘤的免疫治疗研究提供了借鉴和参考。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:破解免疫密码:人类巨噬细胞中病原体敏感的长非编码 RNA 网络图谱