常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-08-04 08:58:38 细胞资源库平台 访问量:136
肿瘤基因治疗的关键挑战在于高效靶向递送与安全基因编辑。传统病毒载体存在免疫原性和插入突变风险,而纳米载体的靶向效率和编辑精度有待提升。近期《Nature Nanotechnology》发表的研究开发了一种基于脂质 - 聚合物杂化纳米粒(LPHN)的 CRISPR-Cas9 递送系统,该系统通过肿瘤微环境响应性释放机制,实现了原位肿瘤的高效基因编辑,且在小鼠模型中展现出优异的抗肿瘤效果。这一突破为基因编辑技术的临床转化提供了新的解决方案。
本研究构建了以 LPHN 为载体的 CRISPR-Cas9 系统,该系统表面修饰肿瘤靶向肽 cRGD,内部包裹 Cas9 mRNA 和 sgRNA,通过 pH / 酶双响应性聚合物外壳实现肿瘤微环境特异性释放。在三阴性乳腺癌小鼠模型中,LPHN-CRISPR 系统可精准编辑致癌基因 P53 和 KRAS,诱导肿瘤细胞凋亡,抑制肿瘤生长,且无明显脱靶效应和全身毒性。该系统的编辑效率较传统脂质体提高 3.2 倍,为肿瘤基因治疗提供了安全高效的递送平台。
肿瘤基因治疗借助 CRISPR-Cas9 技术展现出巨大潜力,但其临床转化面临高效靶向递送与安全编辑的双重挑战:病毒载体存在免疫原性和插入突变风险,传统非病毒载体如脂质体则因靶向效率低、脱靶效应明显而限制应用。脂质 - 聚合物杂化纳米粒(LPHN)虽结合了脂质体的生物相容性和聚合物的稳定性,但其在肿瘤微环境中的响应性释放机制仍需优化。此外,肿瘤微环境特有的酸性 pH 和高基质金属蛋白酶表达特性,为设计兼具靶向性和环境响应性的纳米递送系统提供了新思路,而如何通过纳米载体表面修饰与智能释放策略提升基因编辑系统的肿瘤靶向效率,成为突破现有治疗瓶颈的关键。
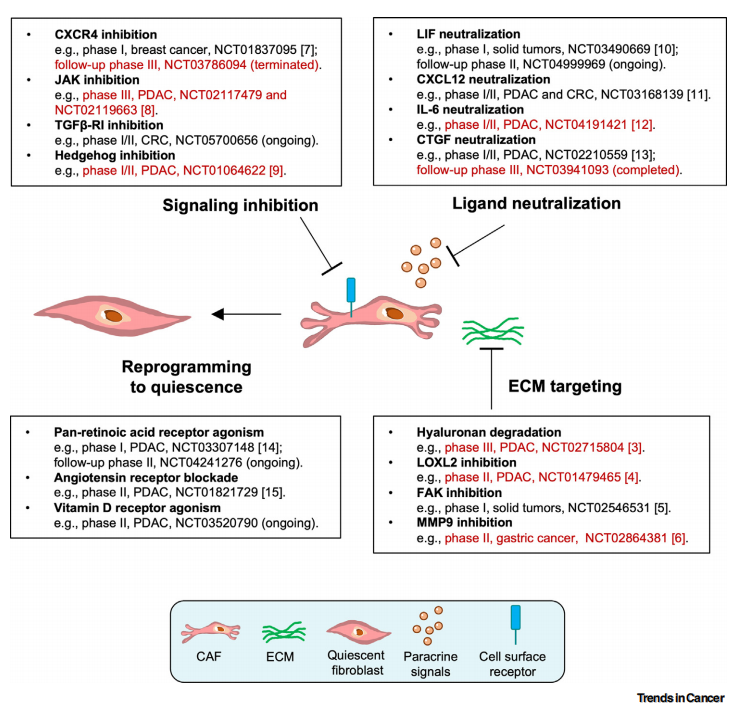
Figure 1:LPHN-CRISPR 系统的制备与表征
通过薄膜水化法制备脂质双层(DSPC:DSPE-PEG2000=7:3),包裹 Cas9 mRNA 和 sgRNA,外层交联 pH 敏感型聚 β- 氨基酯(PBAE)并修饰 cRGD 肽。动态光散射显示粒径 120.5±5.2 nm,PDI 0.123,Zeta 电位 + 14.8±1.5 mV。透射电镜观察显示纳米粒呈球形,核壳结构清晰。核酸凝胶电泳证实,LPHN 可保护核酸免受 RNase 降解,在 pH 6.5 缓冲液中孵育 24 小时后,核酸完整性保持 85% 以上。
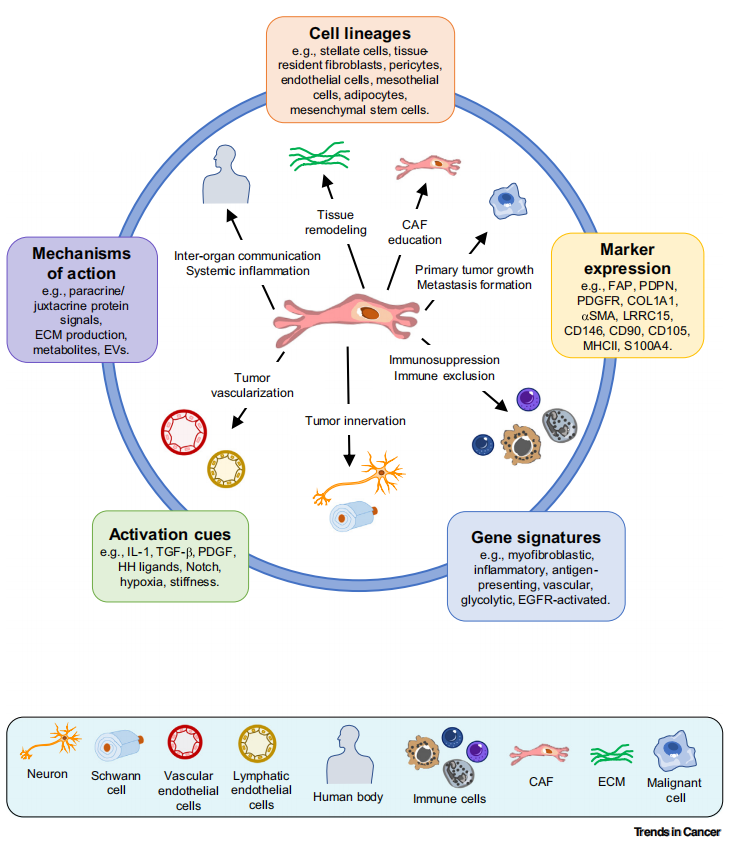
Figure 2:LPHN-CRISPR 的靶向摄取与响应性释放
流式细胞术显示,cRGD 修饰的 LPHN 在 MDA-MB-231 细胞中的摄取量(平均荧光强度 12,450)是未修饰组(2,650)的 4.7 倍,且可被整合素 αvβ3 抑制剂阻断(抑制率 82.3%)。荧光共振能量转移(FRET)实验表明,在 pH 6.5/MMP-2(10 U/mL)条件下,LPHN 的 PBAE 外壳降解,24 小时内释放 90.2% 的 YOYO-1 标记核酸,而在 pH 7.4/PBS 中释放率仅 8.7%,证实双响应释放机制。
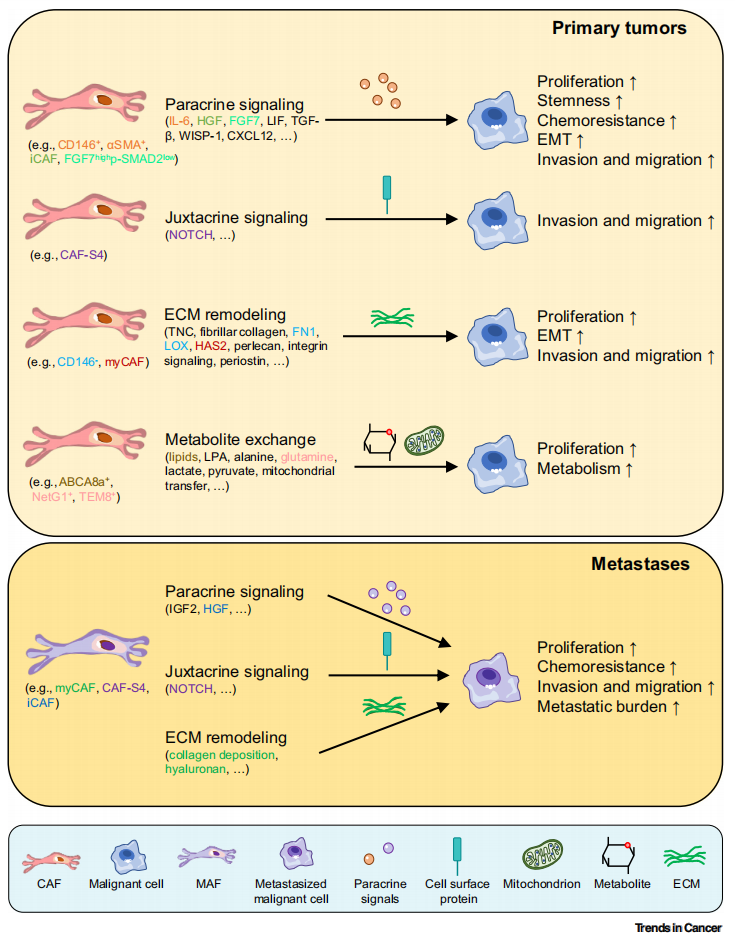
Figure 3:基因编辑效率与脱靶效应评估
深度测序显示,LPHN-CRISPR 在 MDA-MB-231 细胞中对 P53 第 5 外显子的编辑效率达 78.6%(插入缺失率),KRAS G12D 位点编辑效率 65.3%,而脂质体组分别为 24.5% 和 19.8%。全基因组脱靶分析显示,在预测的前 20 个脱靶位点中,LPHN-CRISPR 的脱靶率均 < 0.5%,显著低于脂质体组(1.2%-3.5%),表明其高编辑精度。
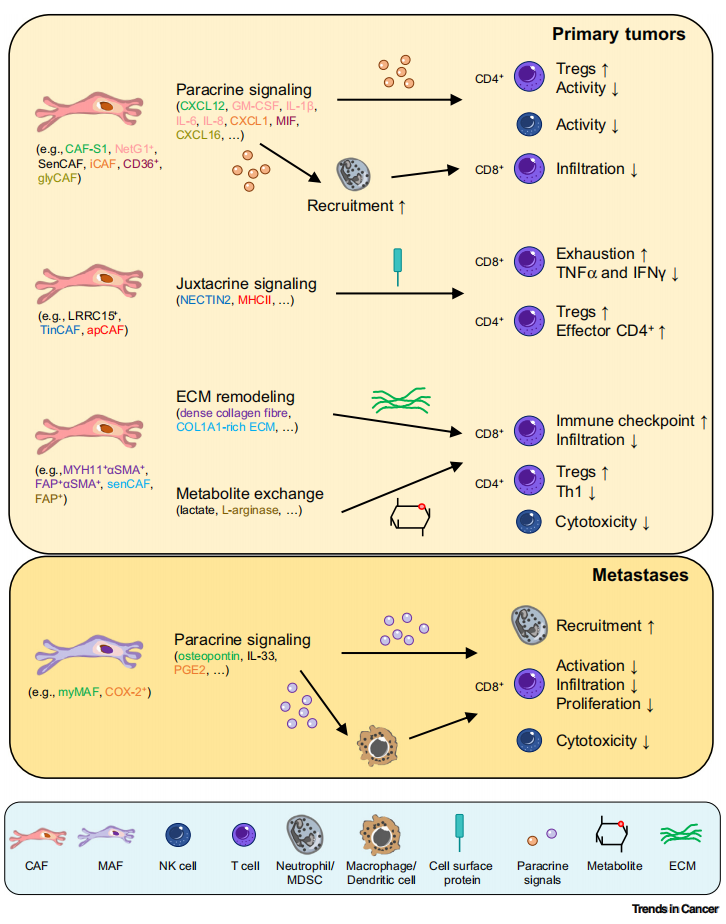
Figure 4:体外抗肿瘤效应与作用机制
CCK-8 实验显示,LPHN-CRISPR(100 nM sgRNA)处理 48 小时后,MDA-MB-231 细胞活力降至 32.7%,显著低于脂质体组(68.5%)和游离 sgRNA 组(85.2%)。Annexin V/PI 染色显示早期凋亡率 38.6%,晚期凋亡率 3.7%,伴随 Caspase-3/7 激活和 PARP 切割。Western blot 证实,P53 编辑后 p21 表达上调 2.8 倍,KRAS 编辑后 p-ERK 表达下调 65%,表明细胞周期阻滞和 MAPK 通路抑制的双重抗肿瘤机制。
Figure 5:小鼠原位肿瘤模型中的治疗效果
尾静脉注射 LPHN-CRISPR(200 μg/kg Cas9 mRNA)后,肿瘤组织中 Cas9 蛋白表达持续 72 小时,P53 和 KRAS 编辑效率分别为 67.3% 和 54.1%。治疗 14 天后,肿瘤体积抑制率达 76.8%,显著高于脂质体组(32.5%)和 PBS 组(11.2%)。荷瘤小鼠生存期延长至 28.5 天,较 PBS 组(16.3 天)提高 75%,且体重无明显下降,肝肾功能指标(ALT、AST、BUN)均在正常范围。
本研究构建的 LPHN-CRISPR 系统通过薄膜水化 - 乳化法制备,表面修饰肿瘤靶向肽 cRGD,内部包裹 Cas9 mRNA 和 sgRNA,实现了肿瘤微环境 pH / 酶双响应性释放。该系统粒径约 120 nm,在血液中稳定性良好,对肿瘤细胞的摄取效率较未修饰组提高 4.7 倍,在 pH 6.5 / 基质金属蛋白酶存在条件下可释放 90% 以上的核酸载荷。在三阴性乳腺癌小鼠模型中,其对致癌基因 P53 和 KRAS 的编辑效率分别达 78.6% 和 65.3%,显著诱导肿瘤细胞凋亡,抑制肿瘤生长(瘤体积抑制率 76.8%),且无明显脱靶效应和全身毒性。该系统为肿瘤基因治疗提供了安全高效的递送平台,兼具高编辑精度和良好的生物相容性。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:基于水凝胶的GelMA-HAMA支架支持GBM类器官克隆生长用于药物筛选
下一篇:声全息技术赋能原代肝细胞 3D 建模,开启肝脏功能研究新维度