常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-07-29 17:39:56 细胞资源库平台 访问量:223
头颈癌(HNC)在发展中国家男性中发病率较高,尤其在中南亚地区,其死亡率在所有癌症中排名第三。作为一种异质性疾病,HNC影响头颈部多个部位。尽管手术、放化疗等联合治疗已显著延缓疾病进展并延长患者生存期,但这些治疗常伴随严重副作用,严重影响患者生活质量。因此,迫切需要开发安全有效的新型治疗方法。
2025年6月12日,发表在Front Immunol上题为Generating tumor-specific T cells based on a head and neck cancer organoid for adoptive cell therapy 的研究旨在探索基于头颈癌类器官(HNCO)的体外共培养模型是否能够诱导外周血T细胞分化为肿瘤反应性T细胞,并评估这些T细胞对自体肿瘤类器官的杀伤活性。研究结果为利用该模型作为头颈癌过继性细胞免疫治疗(ACT)平台的可行性和有效性提供了理论和实验依据。
1,头颈癌类器官模型建立与形态学验证。
研究成功建立了27个患者来源的HNCO模型,所有入组患者均诊断为原发性头颈癌,未接受过任何抗肿瘤治疗。HNCO在培养3-5天后形成100-150微米的球形结构,能够稳定扩增超过四代而无形态学变化。通过H&E染色和免疫组化分析,HNCO在形态学和组织学特征方面与亲本肿瘤组织密切相似,特别是在核异型性方面。免疫组化分析显示经典肿瘤标志物高表达,包括泛细胞角蛋白、肿瘤蛋白p53和Antigen Kiel 67,证实了组织病理学一致的HNCO的成功建立。
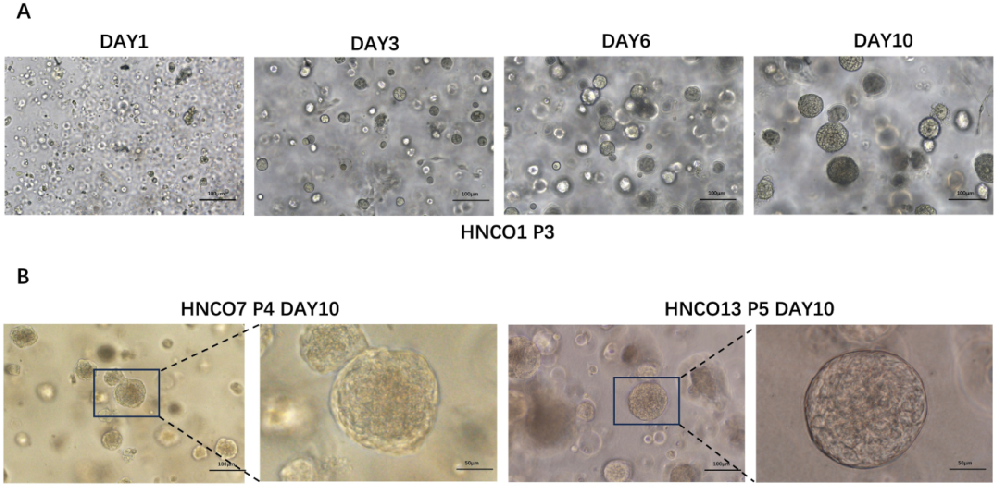
图1
2,共培养后IFN-γ和TNF-α水平显著增加。
为评估HNCO是否能诱导T细胞介导的抗肿瘤反应,将27个HNCO的单细胞与自体外周血淋巴细胞来源的T细胞共培养。HNCO单细胞在共培养前用IFN-γ和尼沃卢单抗(抗PD-1抗体)预处理,以增强抗原呈递并对抗PD-L1诱导的T细胞活化抑制。使用ELISA试剂盒检测第0天和第14天的上清样本中IFN-γ和TNF-α浓度。共培养14天后,23个共培养系统中IFN-γ和TNF-α水平显著增加,而其余4个系统保持不变。效应细胞因子IFN-γ和TNF-α对CTL的活化、分化和肿瘤杀伤活性至关重要,这些结果证实了HNCO能够有效诱导T细胞免疫反应。
图2
3,T细胞活化和肿瘤反应性标志物表达上调。
活化和分化的CD8+ T细胞表达特异性标志物,如CD107a和CD137。采用流式细胞术评估与HNCO共培养后CD8+ T细胞上CD107a和CD137的脱颗粒和细胞毒性表达。与ELISA结果一致,除HNCO21外,与22个患者来源HNCO共培养后CD8+ T细胞中CD107a和CD137表达上调,其中HNCO21未观察到显著增加。在某些患者样本中,CD8+ T细胞在2周共培养后表现出增强的肿瘤反应性和细胞毒性。例如,在HNCO6中,平均IFN-γ浓度从共培养前的17.48 pg/mL增加到14天后的206.6 pg/mL(约12倍),TNF-α浓度从1.403 pg/mL增加到20.09 pg/mL(约14倍)。CD107a+细胞百分比从0.45%增加到10.4%,CD137+ CD8+ T细胞从0.20%增加到6.03%。
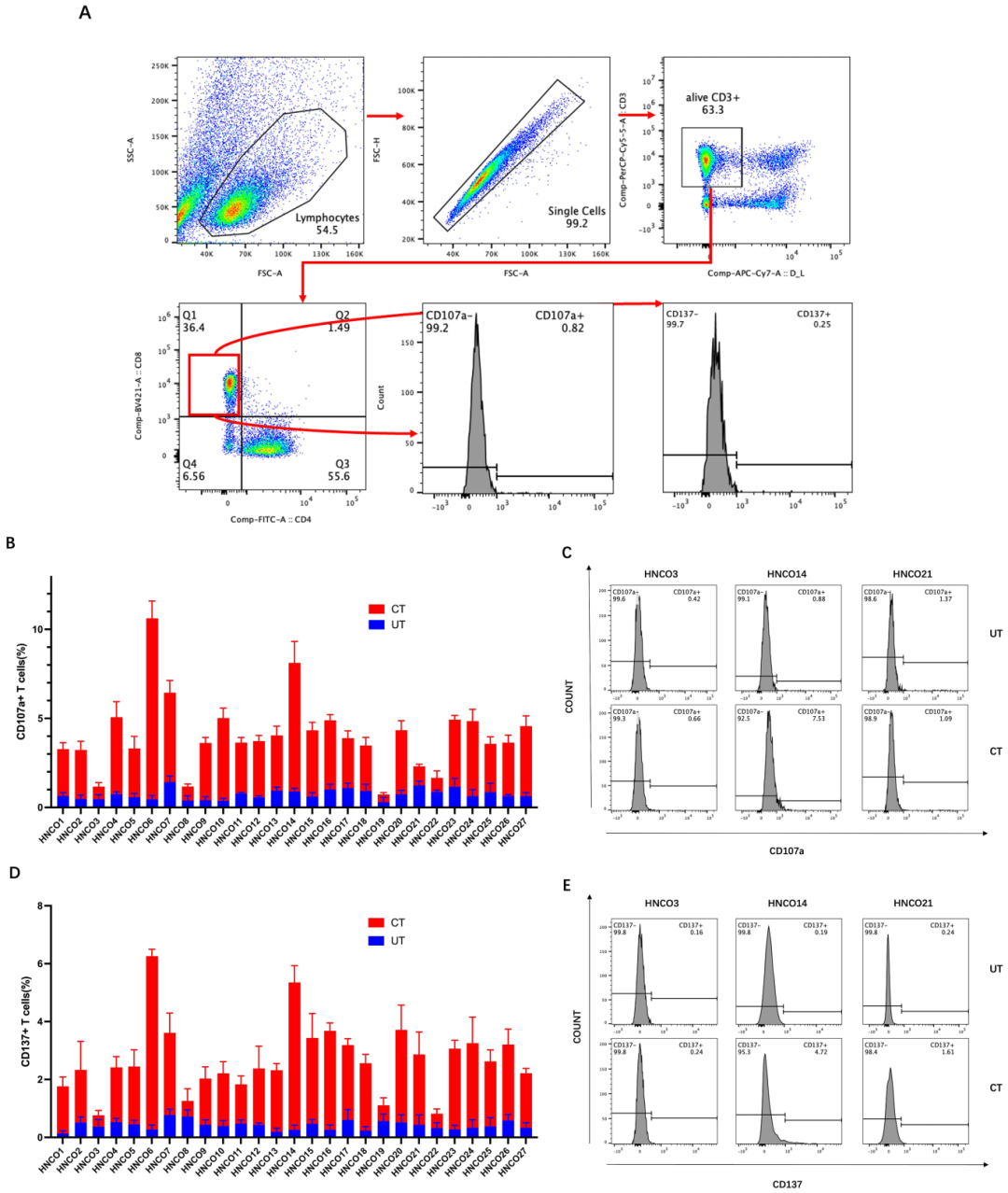
图3
4,诱导的CD8+ T细胞对成熟HNCO具有杀伤活性。
为确定诱导的CD8+ T细胞对自体成熟HNCO的细胞毒性,将这些细胞共培养24小时并评估肿瘤细胞活力。通过测量效应细胞与靶细胞(E/T)比例为1:1、2:1、5:1、10:1和20:1时24小时共培养后的肿瘤细胞活力,评估CD8+ T细胞毒性与E/T比例的关系。倒置显微镜显示随着E/T比例增加,肿瘤细胞裂解明显增加。CCK-8检测证实CD8+ T细胞在所有E/T比例下均介导肿瘤细胞杀伤,肿瘤杀伤效果随比例增加而增强。
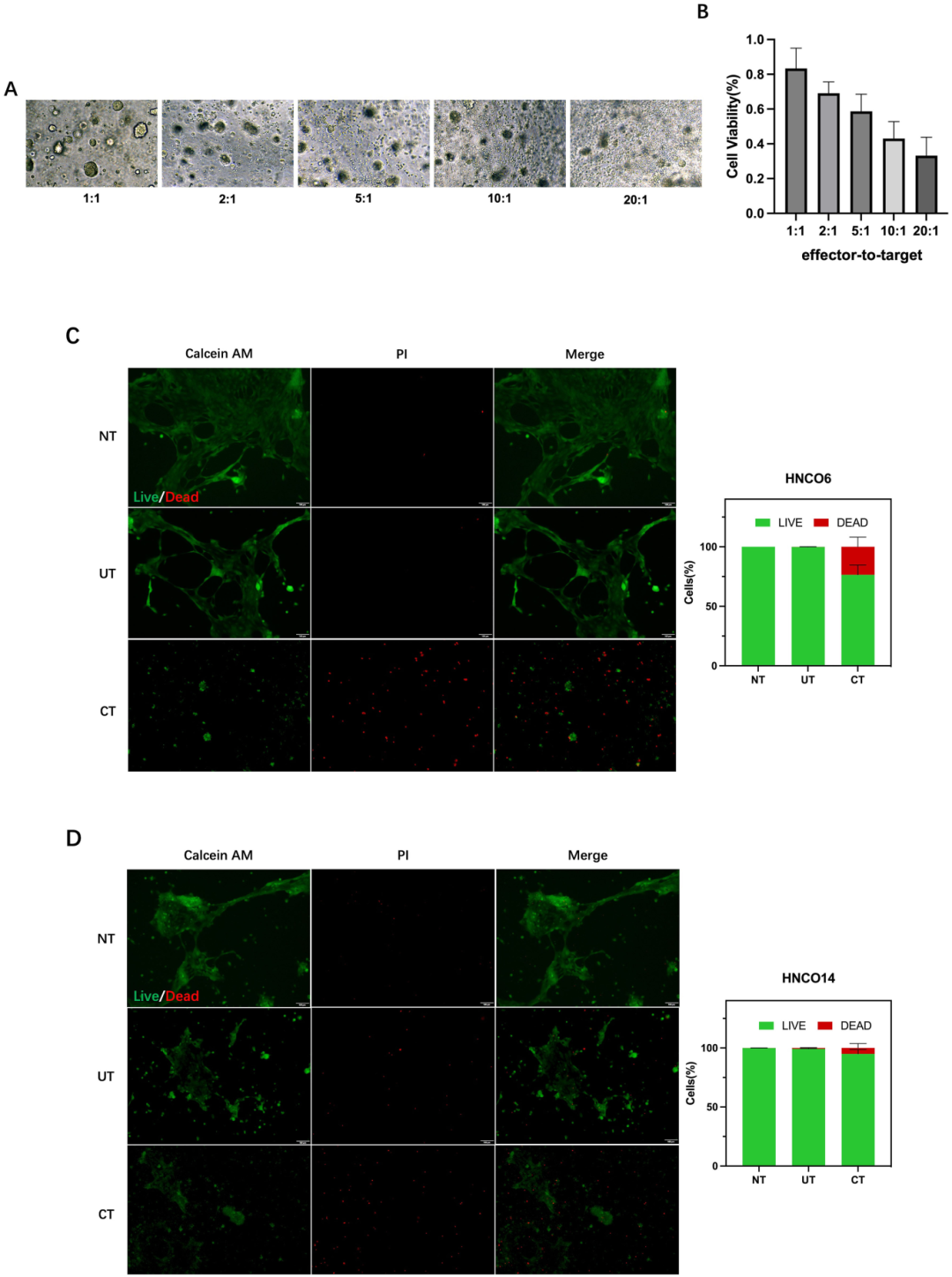
图4
5,特异性肿瘤杀伤活性的荧光标记验证。
在20:1 E/T比例下进一步研究HNCO6和HNCO14共培养模型中CD8+ T细胞的肿瘤杀伤活性。对照组包括不含T细胞的培养基(NT)和未经预诱导的T细胞(UT)。CD8+ T细胞(CT)与成熟HNCO共培养导致HNCO6细胞死亡率为23.5%,HNCO14为5.07%,显著超过对照组。使用Calcein-AM/PI试剂盒染色,Calcein-AM标记活细胞,PI标记死细胞。荧光显微镜观察和ImageJ定量分析证实,诱导的CD8+ T细胞介导对成熟HNCO的特异性杀伤。这一结果表明体外培养的肿瘤反应性T细胞具有直接的抗肿瘤效应。
本研究成功构建患者来源HNCO-T细胞共培养模型,有效诱导外周血淋巴细胞分化为高活性肿瘤反应性CD8+ T细胞,显著增强其肿瘤杀伤能力。模型精准复现患者肿瘤异质性及微环境,为个体化治疗提供宝贵平台。通过配对类器官与自体T细胞,实现个体化HNCO-T细胞共培养,为研究肿瘤-T细胞相互作用及评估免疫治疗敏感性提供有力工具。尽管临床疗效待验证,本研究仍为头颈癌ACT效应细胞扩增提供新方法及实验基础,推动T细胞培养方案标准化,助力临床转化。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:靶向谷氨酰胺代谢转运体SLC25A22增强宫颈鳞癌CD8+ T细胞功能研究背景
下一篇:癌症疫苗 VSV-GP 如何激发抗瘤 T 细胞?剂量、接种方式等关键因素揭秘