常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-07-25 09:16:24 细胞资源库平台 访问量:187
英文标题:Gelsolin’s Protective Role in MASH through F-Actin
Regulation and P53 Degradation
中文标题:凝溶胶蛋白通过F-肌动蛋白调控和P53降解在MASH中的保护作用
发表期刊:《Advanced Science》
影响因子:14.3
作者单位:浙江大学医学院附属邵逸夫医院普外科,国家微创器械创新与应用工程技术研究中心,浙江省腹腔镜技术重点实验室
作者信息:
Yiwei Lu, Tong Ji, Zhichao Ye, Jianing Yan, Chao Wang, Jiachen Chen, Ziyang Jin,
Yongji Zhu, Xiujun Cai,* and Yifan Wang
MASH的现状与挑战
MASH(代谢相关脂肪性肝炎)是代谢功能障碍相关脂肪肝病(MAFLD)的进展阶段,以肝脂肪变性、炎症和纤维化为特征,可发展为肝硬化甚至肝癌。
目前MASH的治疗选择有限,亟需探索新的分子机制和治疗靶点。
Gelsolin(GSN)的功能
GSN是一种肌动蛋白结合蛋白,调控细胞骨架动态和炎症反应,但其在MASH中的作用尚未明确。
研究创新点
首次揭示GSN在MASH中通过调控F-肌动蛋白和P53降解发挥保护作用。
发现GSN通过抑制YAP活性和促进P53泛素化降解,减轻肝脂肪变性和纤维化
动物模型
构建全球性GSN敲除(Gsn−/−)小鼠,并采用三种饮食模型(MCD、CDAHFD、HFD)诱导MASH。
通过AAV8载体恢复GSN表达,验证其治疗潜力。
细胞实验
使用PA(棕榈酸)处理AML12肝细胞,模拟MASH代谢压力。
通过siRNA和过表达技术调控GSN、ATF3、MDM2和P53的表达。
分子机制
免疫共沉淀(Co-IP)验证GSN与MDM2的相互作用。
染色质免疫沉淀(ChIP)和荧光素酶报告基因实验证实ATF3对GSN的转录调控。
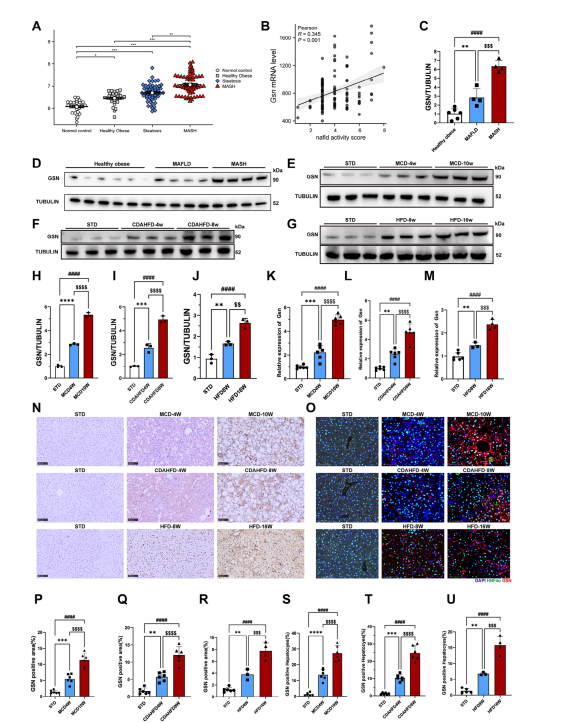
图1:GSN表达水平与MASH样本疾病严重程度呈正相关
研究整合了来自GEO数据库(GSE48452、GSE61620、GSE33814和GSE63067)的183例患者数据,计算不同病程阶段患者的Gsn表达水平;同时采集106例不同NAFLD活动度评分患者的肝脏样本进行转录组分析。Gsn mRNA表达量以均值±标准差(SD)形式呈现。
(A、B)采用Pearson相关性分析评估Gsn mRNA水平与NAFLD活动评分的关联性。
(C)Western blot定量数据对应D组实验结果;
(D)通过Western blot检测人类肝脏组织中GSN蛋白表达水平。组织样本(每组n=4-6);(E-G)通过蛋白质印迹分析评估了喂食蛋氨酸和胆碱缺乏饮食(MCD,E)、胆碱缺乏L-氨基酸定义高脂饮食(CDAHFD,F)和高脂饮食(HFD,G)的小鼠肝组织中GSN表达水平在不同时间点的变化,以标准饮食(STD)组小鼠作为每种饮食干预的对照组(每组n=3-6);(H-J)图(E)-(G)蛋白质印迹结果的定量数据;通过定量PCR分析评估了喂食K)MCD、L)CDAHFD和M)HFD的小鼠肝组织中Gsn表达水平在不同时间点的变化,以STD组小鼠作为每种饮食干预的对照组(每组n=3-6);
(N)采用代表性免疫组化染色评估喂食MCD、CDAHFD和HFD饮食的小鼠肝组织切片中GSN表达,以STD组小鼠作为每种饮食干预的对照组(每组n=3-6),比例尺为100微米;O)通过代表性免疫荧光染色评估喂食MCD饮食、CDAHFD和HFD的小鼠肝切片中GSN表达,以STD组小鼠作为每种饮食干预的对照组(每组n=3-6),比例尺为100微米;P-R)图(N)免疫组化中GSN阳性区域的定量分析。
(S-U)图(O)免疫荧光染色中GSN阳性肝细胞的定量分析;数据以均值±标准差(SD)表示。采用单因素方差分析确定显著性差异。双尾p<0.05被认为具有统计学意义(*p<0.05,**p<0.01,***p<0.005,****p<0.001,n.s.无显著性)。
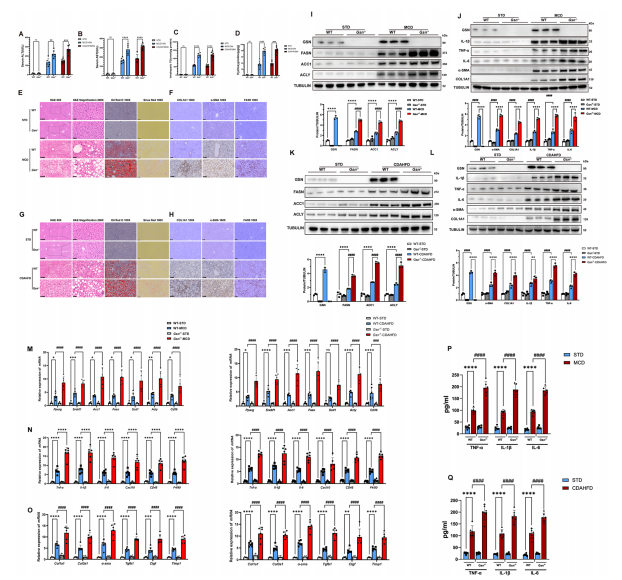
图2:GSN缓解体内小鼠模型中MASH的疾病进展
A,B) 各组小鼠血清ALT和AST水平(n=6/组);
C)各组小鼠肝组织甘油三酯水平(n=6/组);
D)各组小鼠肝组织羟脯氨酸水平(n=6/组);
E)MCD饲料组小鼠肝组织苏木精-伊红(H&E)染色(50×,标尺:250μm)、H&E放大(200×,标尺:50μm)、油红O染色(100×,标尺:250μm)、天狼星红染色(100×,标尺:250μm)代表性图像(n=6/组);F) MCD饲料组𝛼-SMA(100×,标尺:100μm)、COL1A1(100×,标尺:100μm)、F4/80(100×,标尺:100μm)免疫组化染色代表性图像(n=6/组);
F)CDAHFD饲料组H&E染色(50×,标尺:250μm)、H&E放大(200×,标尺:50μm)、油红O染色(100×,标尺:250μm)、天狼星红染色(100×,标尺:250μm)代表性图像(n=6/组);H) CDAHFD饲料组𝛼-SMA(100×,标尺:100μm)、COL1A1(100×,标尺:100μm)、F4/80(100×,标尺:100μm)免疫组化染色代表性图像(n=6/组);
(I,J) Western blot分析MCD饲料组小鼠肝组织GSN、FASN、ACC1、ACLY、IL-1𝛽、TNF-𝛼、IL-6、𝛼-SMA和COL1A1在不同时间点的表达水平(n=3/组);K,L) Western blot分析CDAHFD饲料组小鼠肝组织GSN、FASN、ACC1、ACLY、IL-1𝛽、TNF-𝛼、IL-6、𝛼-SMA和COL1A1在不同时间点的表达水平(n=3/组);实时荧光定量PCR分析各组小鼠肝组织M)脂代谢分子、N)炎症反应标志物和O)纤维化相关标志物的表达(n=6/组);P) MCD饲料组小鼠血清炎症因子(TNF-𝛼、IL-1𝛽、IL-6)ELISA检测结果(n=6/组);Q) CDAHFD饲料组小鼠血清炎症因子(TNF-𝛼、IL-1𝛽、IL-6)ELISA检测结果(n=6/组)。数据以均值±标准差(SD)表示,采用Student's t检验或单因素方差分析进行显著性检验,双尾p<0.05视为具有统计学意义(*p<0.05,**p<0.01,***p<0.005,****p<0.001,n.s.表示无显著性差异)。
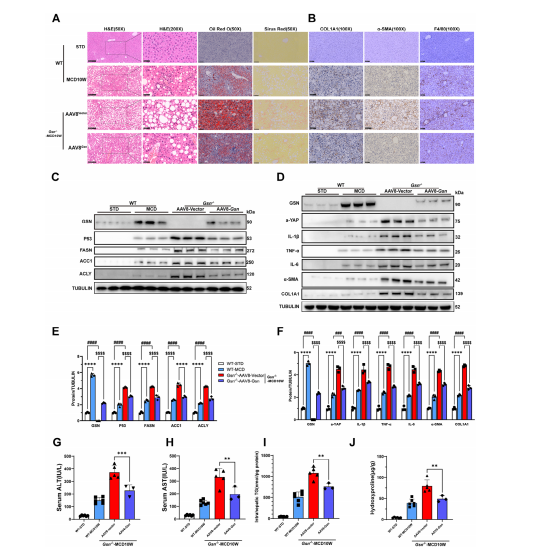
图3:GSN恢复可减轻MCD喂养Gsn−/−小鼠的肝损伤
A)各实验组(n=3-6/组)的代表性图像:苏木精-伊红(H&E)染色(50×,比例尺:250μm)、H&E放大图(200×,比例尺:50μm)、油红O染色(50×,比例尺:250μm)、天狼星红染色(50×,比例尺:250μm);
B)各实验组(n=3-6/组)的代表性免疫组化(IHC)染色图像:α-SMA(100×,比例尺:100μm)、COL1A1(100×,比例尺:100μm)、F4/80(100×,比例尺:100μm);
C-F) 采用Western blot分析评估MCD喂养小鼠肝组织中GSN、FASN、ACC1、ACLY、IL-1β、TNF-α、IL-6、α-SMA和COL1A1在不同时间点的表达水平(n=3/组);
G,H) 指定组小鼠血清ALT和AST水平(n=3-6/组);
I)指定组小鼠肝组织中的甘油三酯水平(n=3-6/组);
J) 指定组小鼠肝组织中的羟脯氨酸水平(n=3-6/组);数据以均值±标准差(SD)表示。采用Student t检验或单因素方差分析判定显著性差异。双尾p<0.05被认为具有统计学意义(*p<0.05,**p<0.01,***p<0.005,****p<0.001,n.s.表示无显著性差异)。
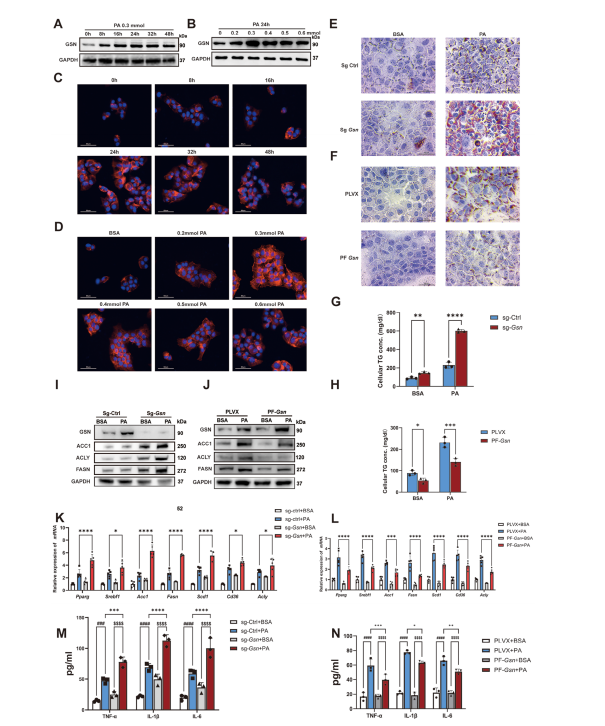
图4:
A) GSN抑制AML12细胞的炎症反应和脂质蓄积。
B) 通过蛋白质印迹分析评估AML12细胞在不同时间点经0.3×10−3摩尔棕榈酸(PA)处理后的GSN表达水平,以及经不同浓度PA处理24小时后的表达情况;
C,D) 采用免疫荧光分析评估AML12细胞在不同时间点经0.3×10−3摩尔棕榈酸(PA)处理后的GSN表达水平,以及经不同浓度PA处理24小时后的表达情况;
E,F) Gsn基因敲除细胞、过表达细胞及经BSA或PA处理24小时的对应对照组细胞的油红O染色代表性图像;
G,H) 甘油三酯水平在Gsn敲低细胞、过表达细胞及经BSA或PA处理24小时的相应对照细胞。数据来自三次独立实验。比例尺为20和25微米;
I,J) PA处理下Gsn敲除和过表达细胞中脂质代谢相关基因的蛋白表达水平。K,L) PA处理下Gsn敲除和过表达细胞中脂质代谢相关基因的相对mRNA水平(n=3次独立实验,mRNA表达水平以β-肌动蛋白为内参标准化)。M,N) BSA或PA处理下Gsn敲除和过表达细胞上清液中炎症细胞因子(TNF-α、IL-1β、IL-6)的ELISA检测结果(n=3次独立实验);数据以均值±标准差(SD)表示。采用Student t检验或单因素方差分析判定显著性差异,双尾p<0.05视为具有统计学意义(*p<0.05,**p<0.01,***p<0.005,****p<0.001,n.s.表示无显著性差异)。
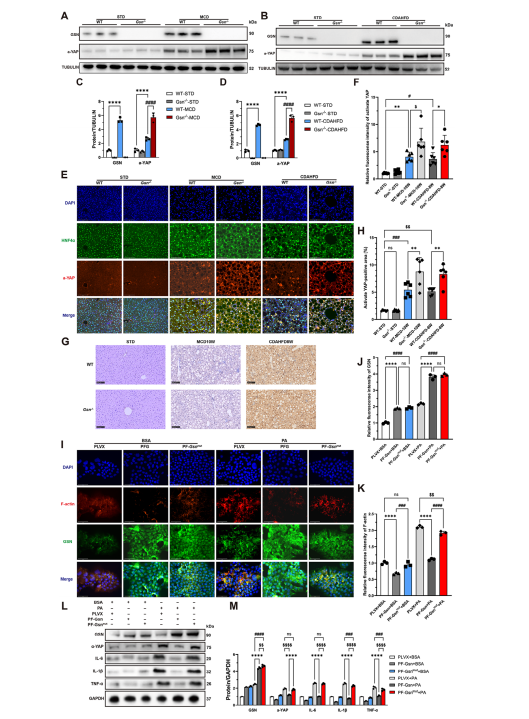
图5:Gsn缺失导致的F-肌动蛋白解聚异常引发YAP过度激活,加剧MASH中的肝纤维化和炎症
C)Western blot结果显示MCD或CDAHFD饮食喂养的WT/Gsn−/−小鼠肝组织中活化YAP的表达情况,以标准饮食(STD)组小鼠作为各饮食干预的对照组(n=3/组);
C,D) 图(A)和(B)Western blot结果的定量数据;MCD或CDAHFD饮食喂养小鼠肝组织的代表性免疫荧光图像,STD饮食组作为对照组(n=6/组,红色:活化YAP,绿色:HNF4𝛼,蓝色:DAPI);图(E)免疫荧光染色的定量分析;
G)采用MCD或CDAHFD饲料喂养的小鼠肝脏组织中活化YAP的代表性免疫组化染色图像,以STD饲料组小鼠作为对照组(n=6/组)。(H)对(G)组免疫组化染色结果的定量分析。(I)不同实验组AML12细胞中经BSA或PA处理的GSN与F-肌动蛋白代表性免疫荧光染色图像(n=3/组);(J)对(I)组GSN免疫荧光染色的定量分析;(K)对(I)组F-肌动蛋白免疫荧光染色的定量分析;(L)不同实验组AML12细胞经BSA或PA处理后GSN、活化YAP、IL-1β、TNF-α及IL-6表达水平(n=3/组);(M)对(L)组Western blot结果的定量数据。数据以均值±标准差(SD)表示,采用单因素方差分析判定显著性差异,双尾检验p<0.05视为具有统计学意义(*p<0.05,**p<0.01,***p<0.005,****p<0.001,n.s.表示无显著性差异)。
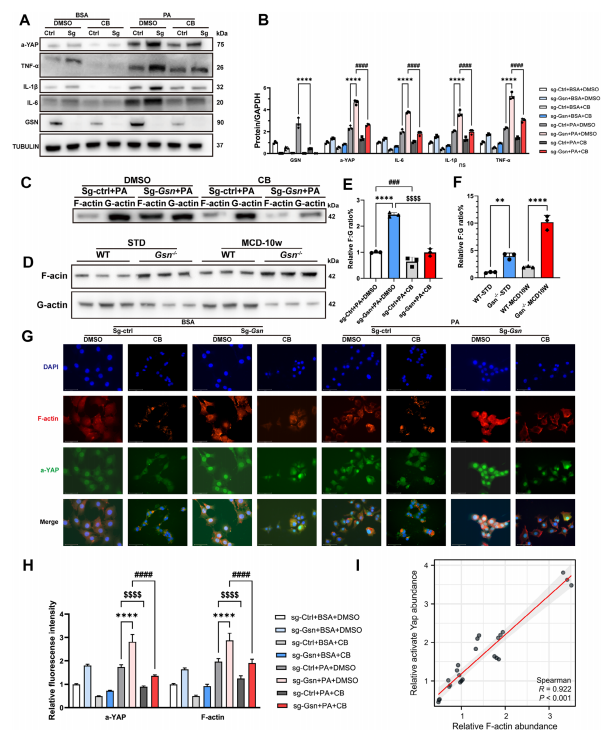
图6:细胞松弛素B逆转了由Gsn缺失引起的YAP激活增强
A)不同实验组(每组n=3)经BSA或PA处理的AML12细胞中GSN、活化态YAP、TNF-𝛼、IL-1𝛽、IL-6的蛋白表达水平;
B)图(A)中Western blot结果的定量数据
D-F) 测量不同处理组细胞及小鼠肝组织各组中F-actin与G-actin的比例;
G)经BSA或PA处理的不同组AML12细胞中a-YAP和F-actin的代表性免疫荧光染色图像实验组(每组n=3);H)对(G)组免疫荧光染色进行定量分析;
I)AML12细胞中活化YAP与F-肌动蛋白的相关性分析。数据以均值±标准差(SD)表示。采用单因素方差分析判定显著性差异。双尾检验p<0.05视为具有统计学意义(*p<0.05,**p<0.01,***p<0.005,****p<0.001,n.s.无显著性差异)。
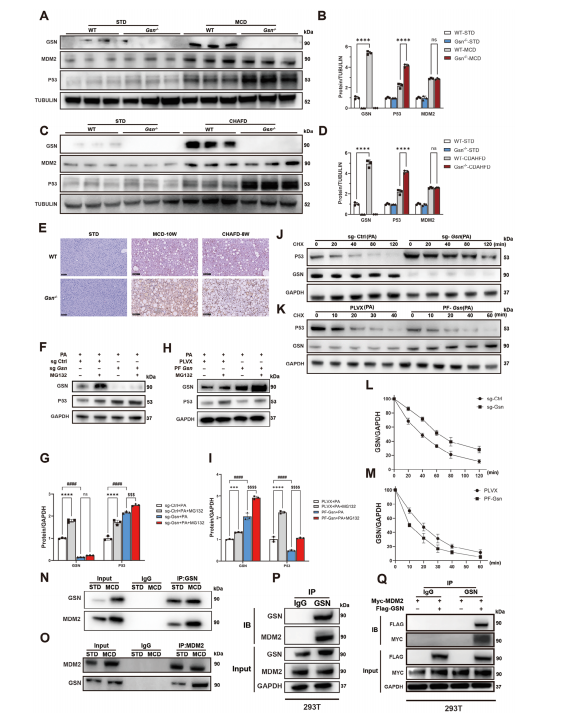
图7:GSN与MDM2共表达并促进P53泛素
A-C) Western blot检测结果:喂食MCD或CDAHFD饲料的WT/Gsn−/−小鼠肝组织中P53和MDM2的表达情况,以标准饲料(STD)喂养的小鼠作为各饮食干预的对照组(n=3/组);
D)代表性免疫组化(IHC)染色图像:展示MCD或CDAHFD饲料喂养小鼠肝组织中P53的表达情况,以STD喂养小鼠作为对照组(n=6/组)。
E-I) Western blot分析显示GSN和P53蛋白水平,以GAPDH作为上样对照。F,G) 实验条件:棕榈酸(PA)、对照sgRNA(sg-Ctrl)、Gsn sgRNA(sg-Gsn)和MG132处理下的细胞。H,I) 实验条件:棕榈酸(PA)、PLVX载体、Gsn过表达(PF-Gsn)及MG132处理组。J-M)环己酰亚胺(CHX)追踪实验显示P53和GSN蛋白随时间变化的稳定性,以GAPDH作为上样对照。J,L)分别展示转导对照sgRNA(sg-Ctrl)和Gsn sgRNA(sg-Gsn)的细胞在不同时间点(0、20、40、80、120分钟)的蛋白水平。K,M)展示转导PLVX载体和Gsn过表达(PF-Gsn)的细胞在不同时间点(0、10、20、30、40、60分钟)的蛋白水平。
O)蛋白质印迹分析不同处理对P53、MDM2和GSN蛋白水平的影响,以GAPDH作为上样对照。实验组分别采用棕榈酸(PA)、PLVX载体、Gsn过表达(PF-Gsn)、对照siRNA(si-Ctrl)和Mdm2 siRNA(si-Mdm2)处理。
P,Q)免疫共沉淀分析显示STD和MCD处理条件下GSN与MDM2的相互作用。P)使用抗GSN抗体进行免疫沉淀检测结合的MDM2水平。Q)使用抗MDM2抗体进行免疫沉淀检测结合的GSN水平。实验包含Input和IgG对照。
N,O)体内免疫共沉淀实验证实MDM2与GSN的共表达,实验包含Input和IgG对照。
S)在293T细胞中进行的体外免疫共沉淀实验观察到MDM2与GSN共表达。Input样本显示蛋白表达水平,以GAPDH作为上样对照。数据以均值±标准差(SD)表示,采用单因素方差分析进行显著性检验。双尾检验p<0.05视为具有统计学意义(*p<0.05,**p<0.01,***p<0.005,****p<0.001,n.s.表示无显著性差异)。
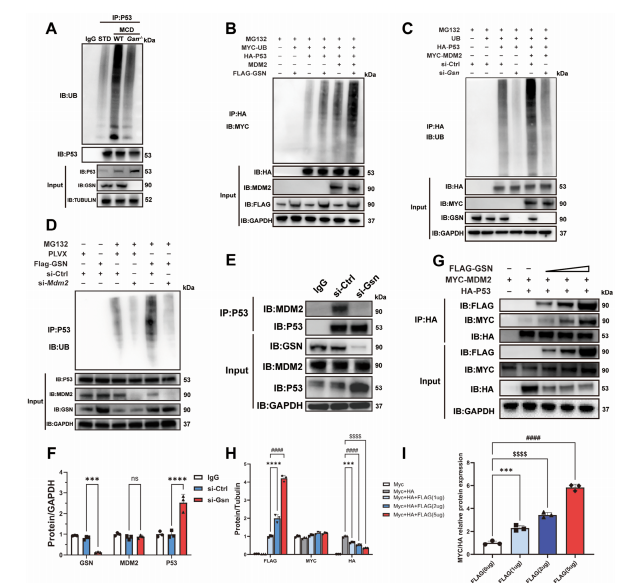
图8:GSN通过增强MDM2介导的P53泛素化减轻肝脏脂肪变性
A)采用免疫共沉淀(IP)和泛素化实验检测野生型/Gsn基因敲除小鼠在MCD或CDAHFD饮食喂养下肝组织中P53的修饰情况,标准饮食(STD)组小鼠作为各饮食干预的对照组(n=3/组);
B,C)在过表达或敲低Gsn的293T细胞中进行P53免疫共沉淀及泛素化检测,实验中使用MG132抑制蛋白酶体降解途径,采用HA标签标记的P53进行IP后,通过免疫印迹(IB)检测MYC标签泛素(MYC-UB)或泛素;
E)在敲低MDM2的293T细胞中检测P53免疫共沉淀及泛素化水平,使用MG132处理细胞抑制蛋白酶体降解,采用P53抗体进行IP后通过IB检测泛素;
E,F)P53免疫共沉淀后通过IB检测其相互作用蛋白MDM2和GSN;G–I)分析FLAG-GSN表达量增加对MYC-MDM2与HA-P53相互作用的影响,采用P53抗体进行IP后通过IB检测FLAG、MYC和HA标签。数据以均值±标准差(SD)表示,采用单因素方差分析进行显著性检验,双尾检验p<0.05视为具有统计学意义(*p<0.05,**p<0.01,***p<0.005,****p<0.001,n.s.表示无显著性差异)。
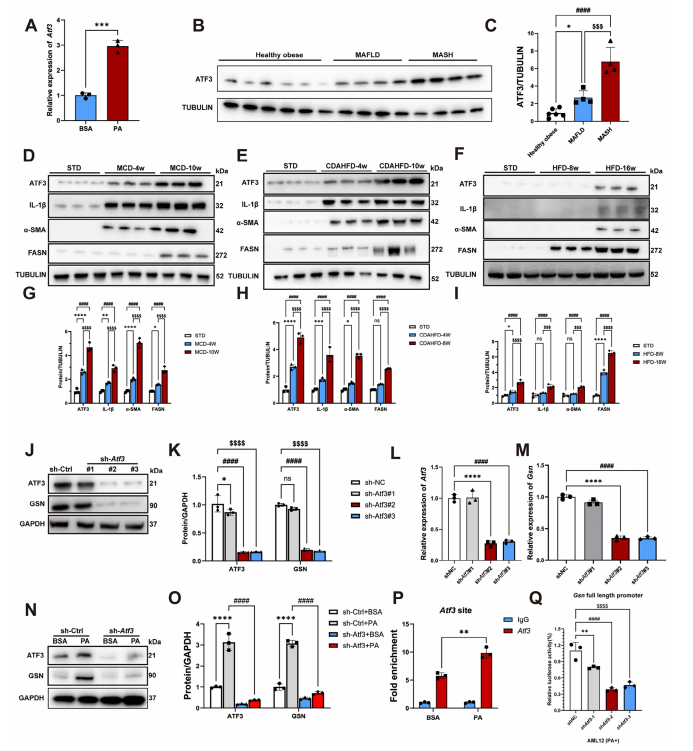
图9:转录因子ATF3在MASH进展过程中上调GSN表达
A)AML12细胞经BSA或PA处理24小时后Atf3 mRNA表达的Q-PCR分析;
B)采用蛋白质印迹法评估人肝组织样本中ATF3蛋白表达(n=4-6/组);
C)图(B)蛋白质印迹结果的定量数据;
D-I) 通过蛋白质印迹分析评估蛋氨酸胆碱缺乏饮食(MCD,D,G)、胆碱缺乏L-氨基酸限定高脂饮食(CDAHFD,H)和高脂饮食(HFD,I)喂养小鼠不同时间点肝组织中ATF3及其他分子的表达水平及定量数据,以标准饮食(STD)小鼠作为各饮食干预的对照组(n=3/组);
J)蛋白质印迹分析显示ATF3和GSN蛋白水平,GAPDH作为上样对照。细胞处理条件:对照shRNA(sh-Ctrl)、Atf3-shRNA#1(sh-Atf3#1)、Atf3-shRNA#2(sh-Atf3#2)、Atf3-shRNA#3(sh-Atf3#3);K) 图(J)蛋白质印迹结果的定量数据;L,M) Q-PCR分析显示Atf3(L)和Gsn(M)转录水平。细胞处理条件:对照shRNA(sh-Ctrl)、Atf3-shRNA#1(sh-Atf3#1)、Atf3-shRNA#2(sh-Atf3#2)、Atf3-shRNA#3(sh-Atf3#3);N) 蛋白质印迹分析显示ATF3和GSN蛋白水平,以GAPDH作为上样对照。细胞处理条件:BSA或PA,对照shRNA(sh-Ctrl),Atf3-shRNA(sh-Atf3);
P)图(N)中Western印迹结果的定量数据;
Q)在BSA或PA处理24小时的AML12细胞中,ATF3蛋白在Gsn启动子区域富集的染色质免疫沉淀分析,IgG作为阴性对照;
Q)在PA处理24小时的shNC或shAtf3感染AML12细胞中,Gsn启动子活性的双荧光素酶报告基因检测,荧光素酶活性通过内部海肾荧光素酶对照进行标准化(n = 3)。数据以均值±标准差(SD)表示。采用单因素方差分析确定显著性差异,双尾检验p < 0.05视为具有统计学意义(*p < 0.05,**p < 0.01,***p < 0.005,****p < 0.001,n.s.表示无显著性)。
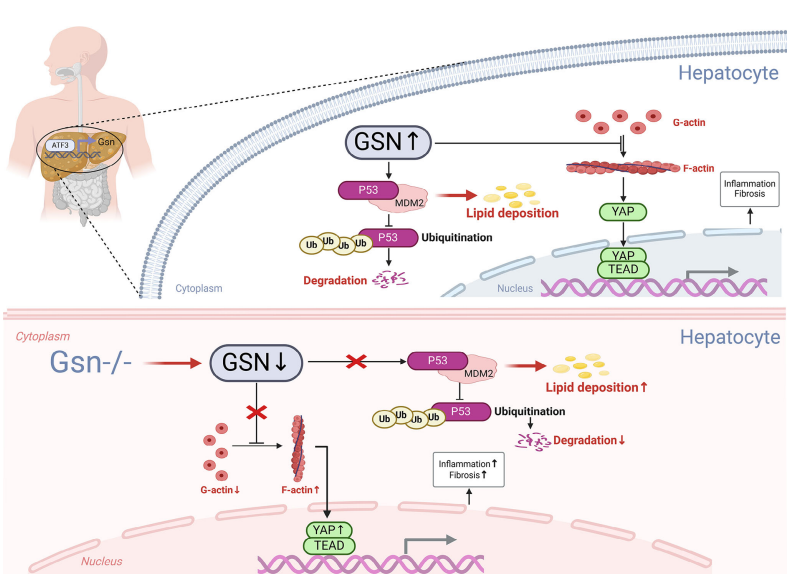
图10:本研究探讨的分子机制示意图。GSN通过促进P53蛋白的泛素化降解来抑制脂质沉积
在GSN正常表达情况下,肝脏中GSN与MDM2相互作用,增强MDM2介导的P53泛素化降解,导致P53表达水平降低并阻碍其有效核转位。这一机制在MASH病程中调控肝脏脂质代谢,减轻脂质蓄积和肝脏脂肪变性。而在GSN缺失(Gsn−/−)状态下,MDM2介导的P53降解受阻,导致脂质沉积增加,加剧肝脏脂肪变性和代谢功能障碍。
除调控P53外,GSN作为关键细胞骨架蛋白,通过动态调节F-肌动蛋白与G-肌动蛋白的比例,确保过量F-肌动蛋白被降解为G-肌动蛋白。这一机制可防止F-肌动蛋白过度积累,维持细胞稳定性。该调控过程间接抑制Hippo通路关键效应因子YAP的过度激活。在Gsn−/−肝细胞中,F-肌动蛋白与G-肌动蛋白的失衡导致过量F-肌动蛋白无法及时解聚为G-肌动蛋白单体。F-肌动蛋白的病理性积累使得YAP在Hippo通路调控前即被过度激活,进而促进MASH病程中肝纤维化加剧和炎症信号通路激活,进一步恶化肝损伤。
GSN通过调控F-肌动蛋白、YAP活性以及促进MDM2介导的P53降解,在维持肝脏代谢稳态、调节脂质代谢和控制炎症反应中发挥核心作用。这些发现揭示了GSN在肝脏功能中的多维调控机制,为MASH治疗提供了潜在靶点。
GSN表达与MASH严重程度相关:GSN在MASH患者和小鼠模型中表达上调,且与疾病进展呈正相关。GSN缺失加剧MASH病理,Gsn−/−小鼠表现出更严重的肝脂肪变性、炎症和纤维化。细胞实验中,GSN缺失导致F-肌动蛋白积累和YAP过度激活。GSN恢复改善肝损伤,AAV介导的GSN恢复显著减轻肝损伤和纤维化。GSN通过促进MDM2介导的P53泛素化降解,减少肝脂肪变性。GSN抑制F-肌动蛋白积累,从而抑制YAP的核转位和激活。ATF3是GSN的上游转录调控因子。
创新策略:
揭示GSN通过双重机制(F-肌动蛋白/YAP和MDM2/P53通路)保护MASH。
转化意义:
GSN是MASH的潜在治疗靶点,其调控机制为开发新型疗法提供理论基础。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:人参皂苷 Rb2 直击寨卡病毒,体内外实验证实强效抑制力
下一篇:肺动脉高压不用愁?天然成分紫檀芪来帮忙,抑制血管重塑有新机制!