常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-07-24 12:22:30 细胞资源库平台 访问量:319
颌骨是口腔区域最大的生物矿化器官,包括上颌骨和下颌骨,在咀嚼、呼吸、发音和面部美学中发挥关键作用。颌骨极易受到细菌感染、外伤、肿瘤和先天性畸形等各种病理因素的不可逆损伤,严重影响患者的生活质量。然而,目前尚无研究建立了能够真实模拟人类颌骨病理生理学的可靠模型,这严重限制了对颌骨疾病机制的研究和治疗方法的开发。
与轴向和附肢骨骼起源于中胚层不同,颌骨源自第一咽弓(PA1)的颅神经嵴细胞(NCC)衍生的外胚间质。在脊椎动物胚胎发育过程中,NCCs动态迁移至颅部各区域,分化为多种细胞类型,包括外胚间质。它们的区域特化受到NCCs前后轴身份的约束,这种身份由Hox基因建立。与表达特定Hox基因组合的其他后部咽弓不同,产生PA1外胚间质的中脑-前后脑NCCs不表达Hox基因。在咽弓内阶段,PA1分为上颌突和下颌突,下颌突外胚间质(mdEM)表现出特异的区域模式化。
在下颌骨形成过程中,模式化后的mdEM首先形成Meckel软骨,这是下颌骨发育的指导结构,随后开始序贯骨化。与主要通过软骨内骨化形成的中胚层源性骨骼不同,下颌骨经历特殊的骨化模式。虽然下颌骨的远端和近端部分通过软骨内骨化形成,但下颌骨主要经历膜内骨化过程,其中mdEM凝聚、直接分化为成骨细胞,分泌富含I型胶原的细胞外基质并部分嵌入其中。最终,这些细胞分化为骨细胞,在矿化骨基质中形成三维细胞网络。
近期,发布在Nature biomedical engineering期刊,题为Jawbone-like organoids generated from human pluripotent stem cells的研究开发了一种三维培养系统,用于诱导人类诱导多能干细胞(iPSCs)定向分化为微米级胚胎(mdEM),并成功培育出类颌骨器官模型。
1, 三维培养系统高效诱导HOX阴性神经嵴细胞
研究者首先建立了从人诱导多能干细胞(iPSCs)三维培养诱导HOX阴性NCCs的培养体系。通过优化BMP4浓度和处理时间,在无异种成分的培养条件下,使用SB431542(TGF-β抑制剂)、CHIR99021(GSK3β抑制剂)和BMP4的组合,成功将iPSCs聚集体诱导为NCCs。流式细胞分析显示,经过5天培养后,CD271高表达的NCCs达到94.9±1.9%的高效率。这些细胞表达典型的NCC标记物SOX10、NGFR、TFAP2A和PAX3,同时不表达HOX基因,证实其为来源于中脑-前后脑区域的HOX阴性NCCs。进一步验证显示,这些NCCs具有分化为外周神经元、黑色素细胞和间充质干细胞的多向分化潜能。
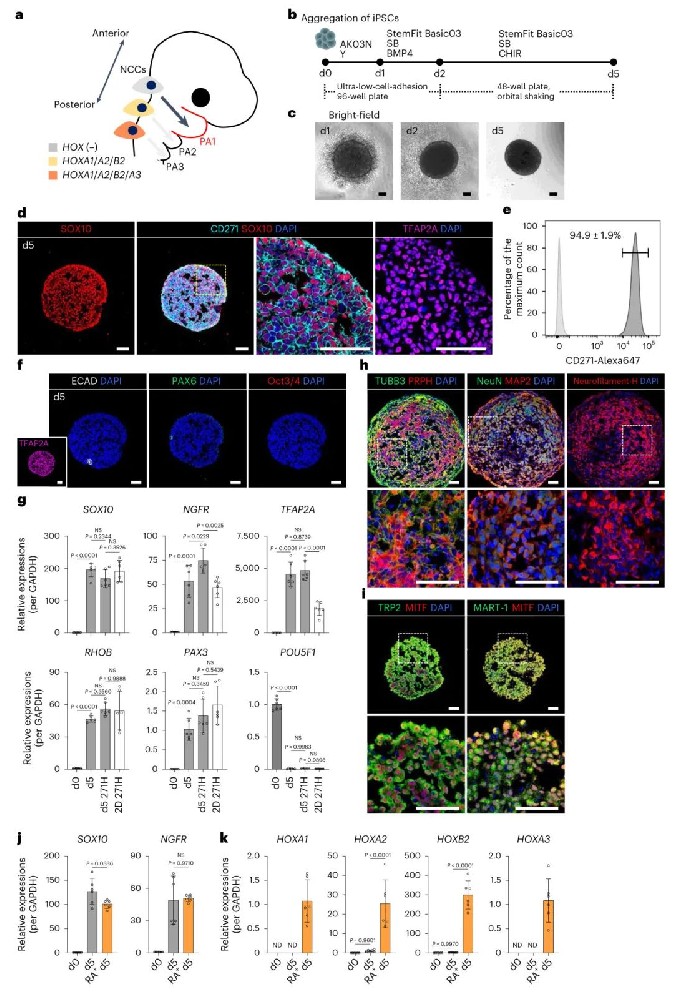
图1 从iPSCs中高效诱导HOX阴性NCCs
2,选择性诱导下颌突外胚间质并重现近远端模式化
基于胚胎发育过程中的信号通路,研究者使用FGF8、EDN1和BMP4的组合(FEDB)成功将HOX阴性NCCs诱导为mdEM。免疫荧光染色显示,FEDB处理能够有效地使SOX10阳性的NCCs转化为TWIST1阳性的外胚间质,并形成具有肌动蛋白应力纤维的间充质迁移形态。重要的是,这些聚集体重现了胚胎mdEM的近远端模式化特征:中央区域含有DLX2单阳性细胞,中间区域含有DLX2+DLX5+细胞,表面区域含有DLX2+DLX5+HAND2+细胞。通过使用EDN1受体拮抗剂BQ-123,证实了EDN1信号对于上颌-下颌选择的关键作用。此外,实验还证明了NCCs初始前后轴身份对mdEM分化的重要性。
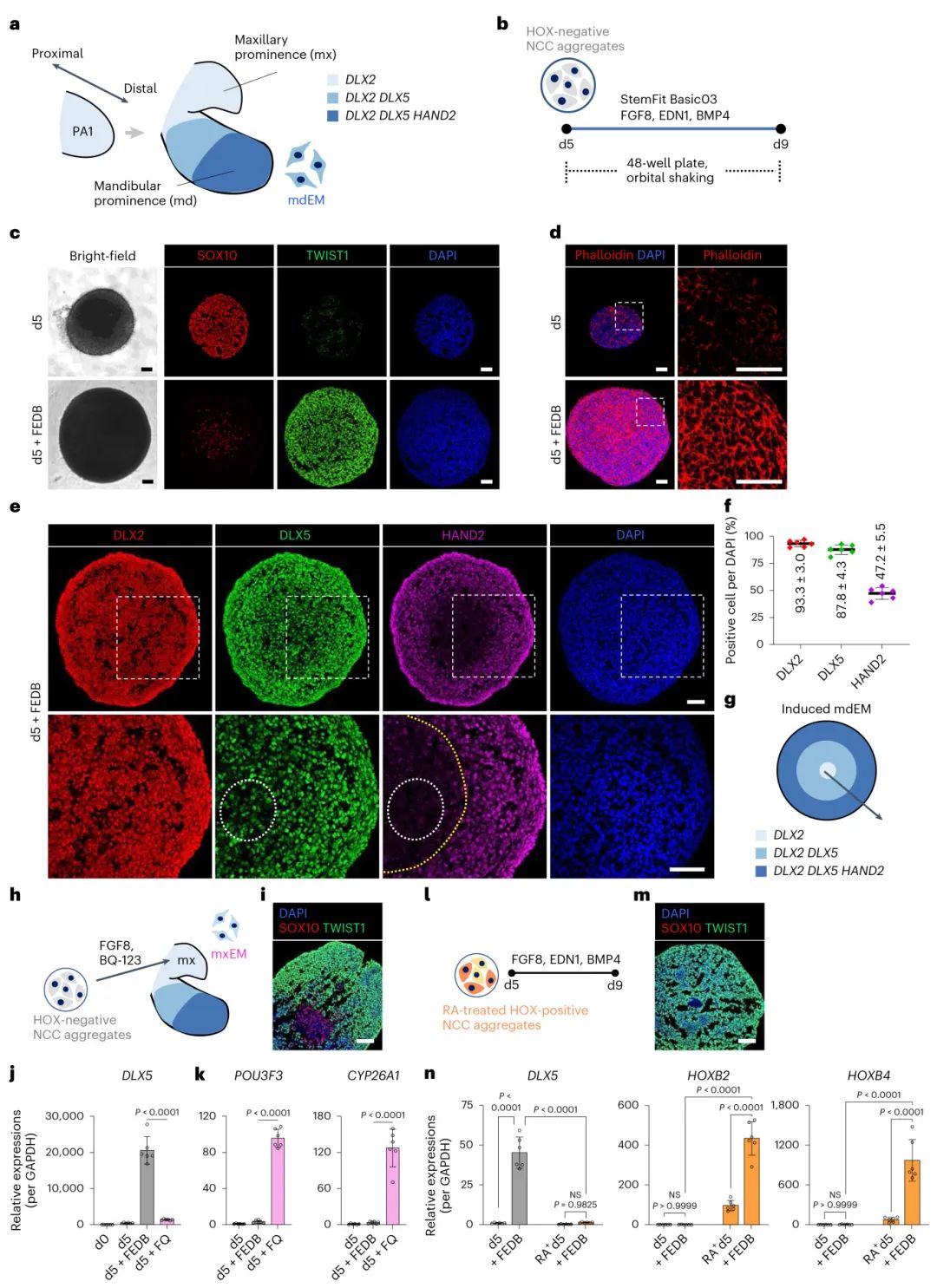
图2 NCC聚集体向mdEM的定向分化
3,重现下颌骨后期区域模式化
为了验证诱导的mdEM是否具有发育准确性,研究者进一步诱导了mdEM的后期区域模式化。通过模拟胚胎发育中的上皮信号,成功将mdEM分化为两个不同的区域:远端帽区域和近端-口侧臼齿区域。对于远端帽诱导,使用高浓度BMP4、EDN1和低浓度FGF2的组合,显著上调了主要远端帽标记物HAND1以及其他远端标记物。免疫染色显示DLX5表达降低,HAND1在外层区域清晰检测到。对于近端-口侧区域诱导,使用FGF8、SAG(Hedgehog信号激动剂)、BQ-123和LDN193189的组合,有效诱导了近端-口侧相关基因的表达。这些标记物的表达模式在远端帽和臼齿区域诱导之间是互斥的,证实了区域特异性诱导的成功。
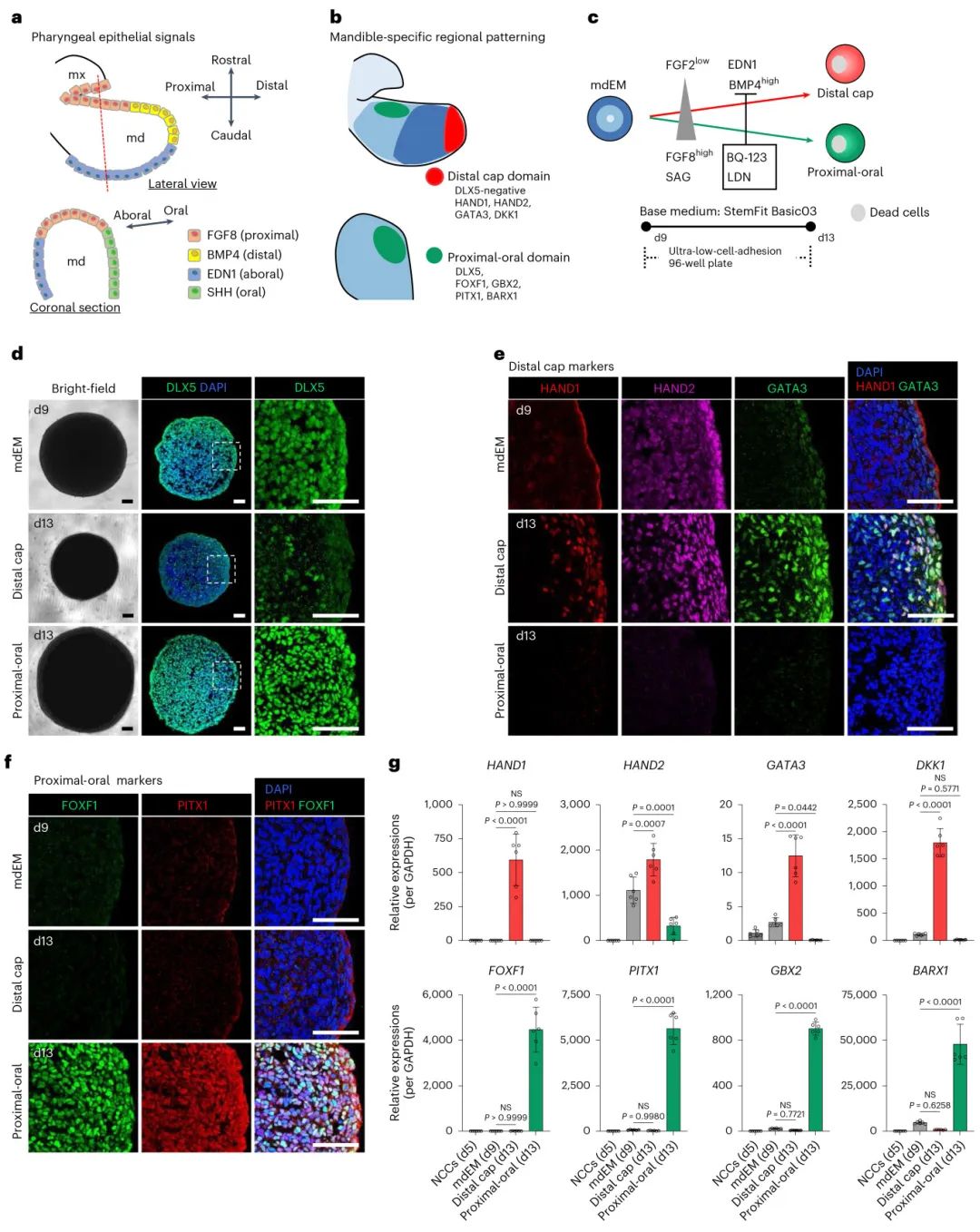
图3 mdEM再现了下颌骨的区域模式
4, 生成具有三维骨细胞网络的类颌骨器官
通过将mdEM置于无异种成分的成骨诱导培养基中直接培养,成功模拟了膜内骨化过程。经过38天培养,获得了直径1.0-1.5毫米的白色聚集体,表现出显著增加的ALP活性和钙含量。茜素红和von Kossa染色证实了矿化组织的形成。组织学分析显示,这些类器官形成了具有嗜酸性亲和力和致密基质的骨样组织,主要骨基质蛋白COLI大量表达,非胶原骨蛋白OCN和OPN也被检测到。细胞特征分析显示,ALP+SP7+成骨细胞呈立方形状排列在组织表面层,大量细胞分化为具有树突突起的PDPN+PHEX+早期骨细胞。在骨基质内,SOST+成熟骨细胞形成了三维树突网络,成功重现了天然骨组织中骨细胞的三维网络结构。
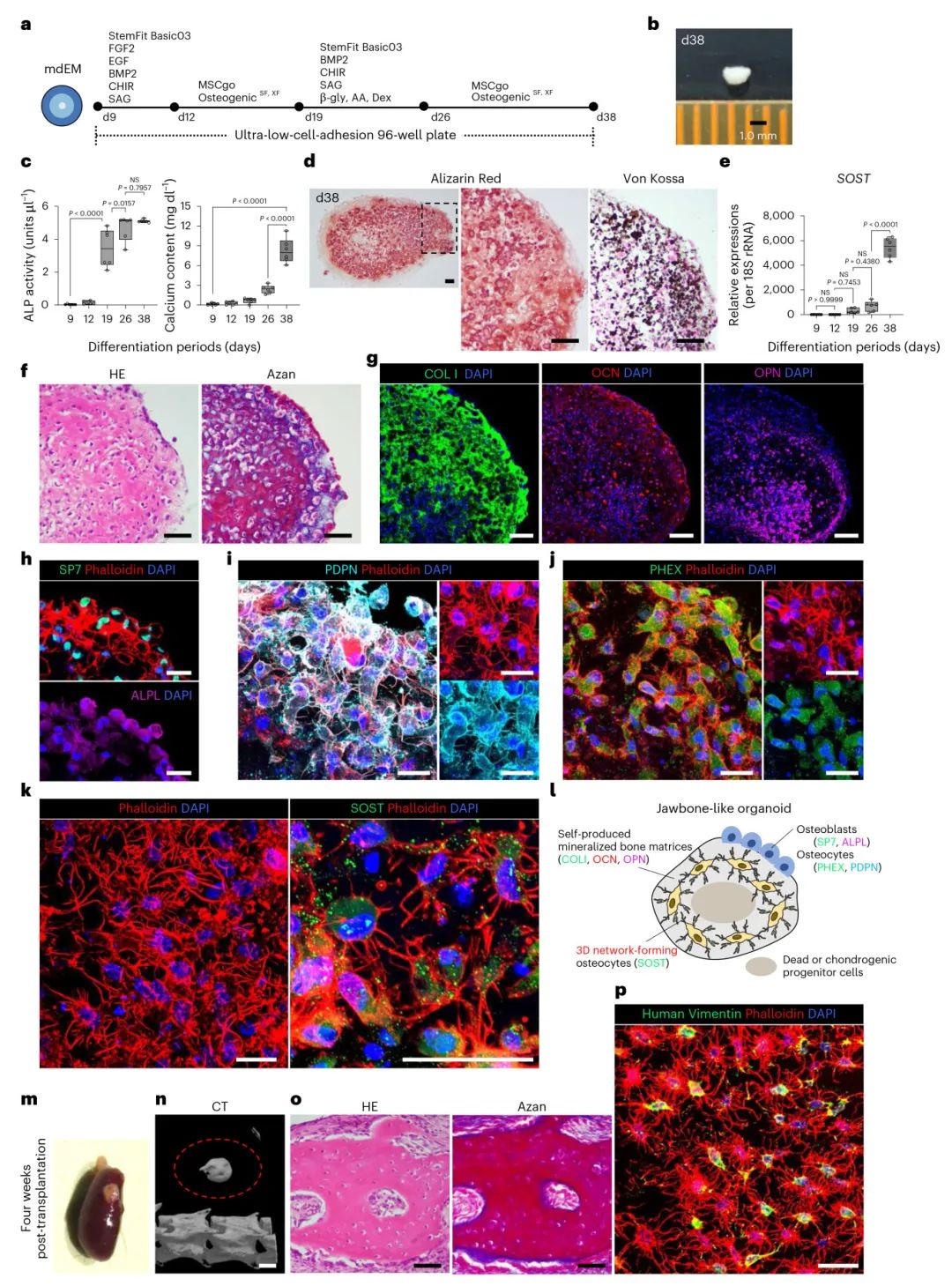
图4 颌骨样类器官的生成与表征
5,体内骨再生能力验证
为了评估类颌骨器官的再生潜力,研究者将三个类器官直接移植到NSG小鼠下颌骨缺损中。四周后的微CT分析显示,器官移植组的矿化组织量显著增加,与骨移植组相似。组织学检查证实,移植的类颌骨器官成功促进了骨再生,形成了与宿主骨骼结构相似的成熟骨组织。免疫染色证实了来源于供体人细胞的骨基质蛋白的存在,并且在骨基质内,来源于供体的人骨细胞和来源于宿主的小鼠骨细胞共同形成了树突细胞网络。TRAP阳性破骨细胞沿新形成的骨骼观察到,表明存在活跃的骨重塑过程。
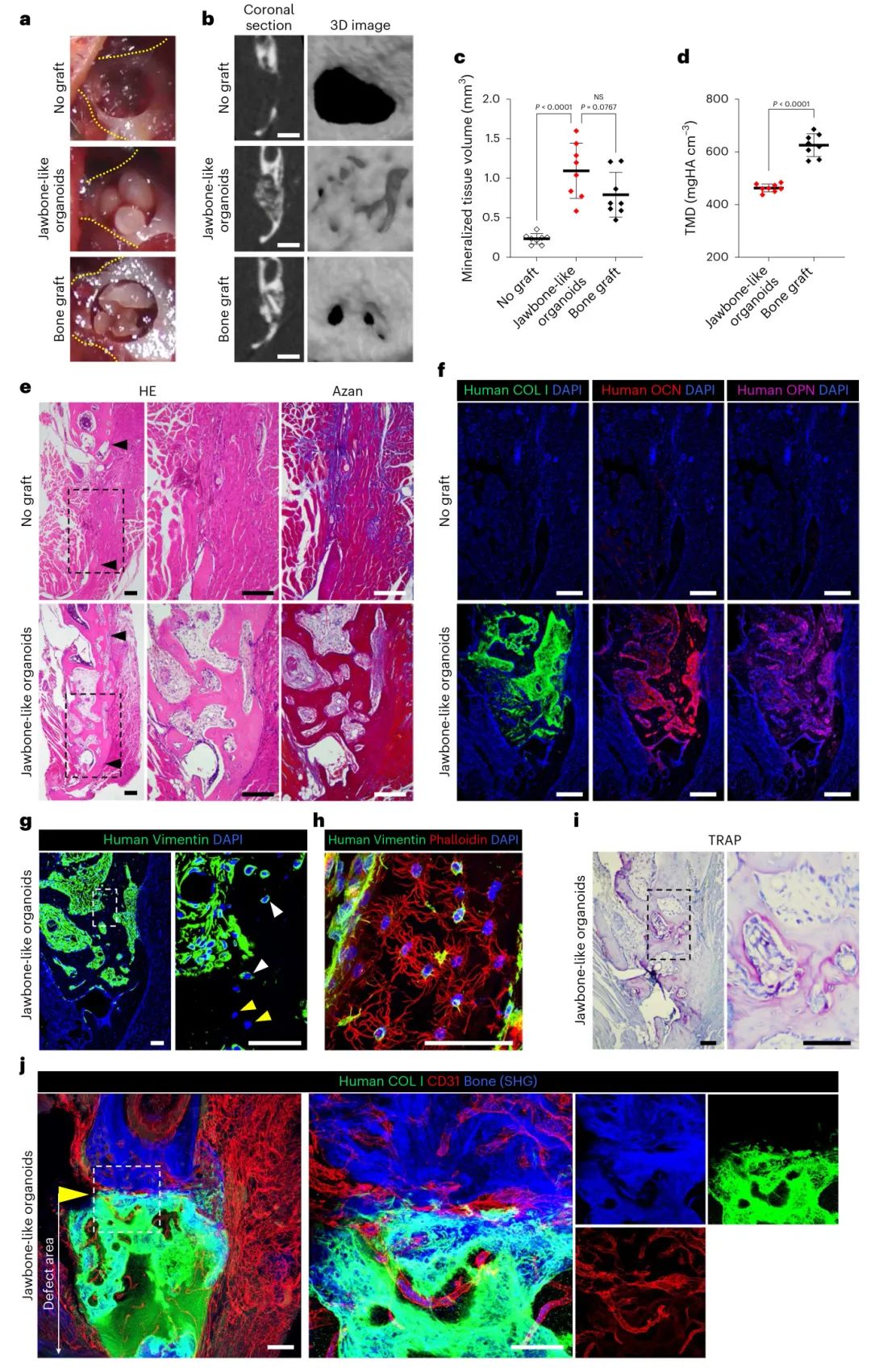
图5 颌骨样类器官促进颌骨形成
6,成骨不全症疾病模型的成功建立
利用成骨不全症(OI)患者来源的iPSCs,研究者成功建立了疾病模型。从携带COLIA1基因自发显性突变的OI患者iPSCs以及基因校正的对照iPSCs生成类颌骨器官。结果显示,OI来源的类器官表现出典型的疾病表型:胶原杂交肽阳性染色表明产生了错误折叠的三螺旋链,骨细胞树突突起形成受损,移植后形成的矿化组织较少且密度较低。组织学分析显示OI类器官形成了茜素蓝染色的未成熟骨组织,骨细胞表现出OI骨特征的典型特征,部分骨细胞发生凋亡。这些异常特征在基因校正的对照组中得到恢复,证实了该模型在疾病研究中的有效性。
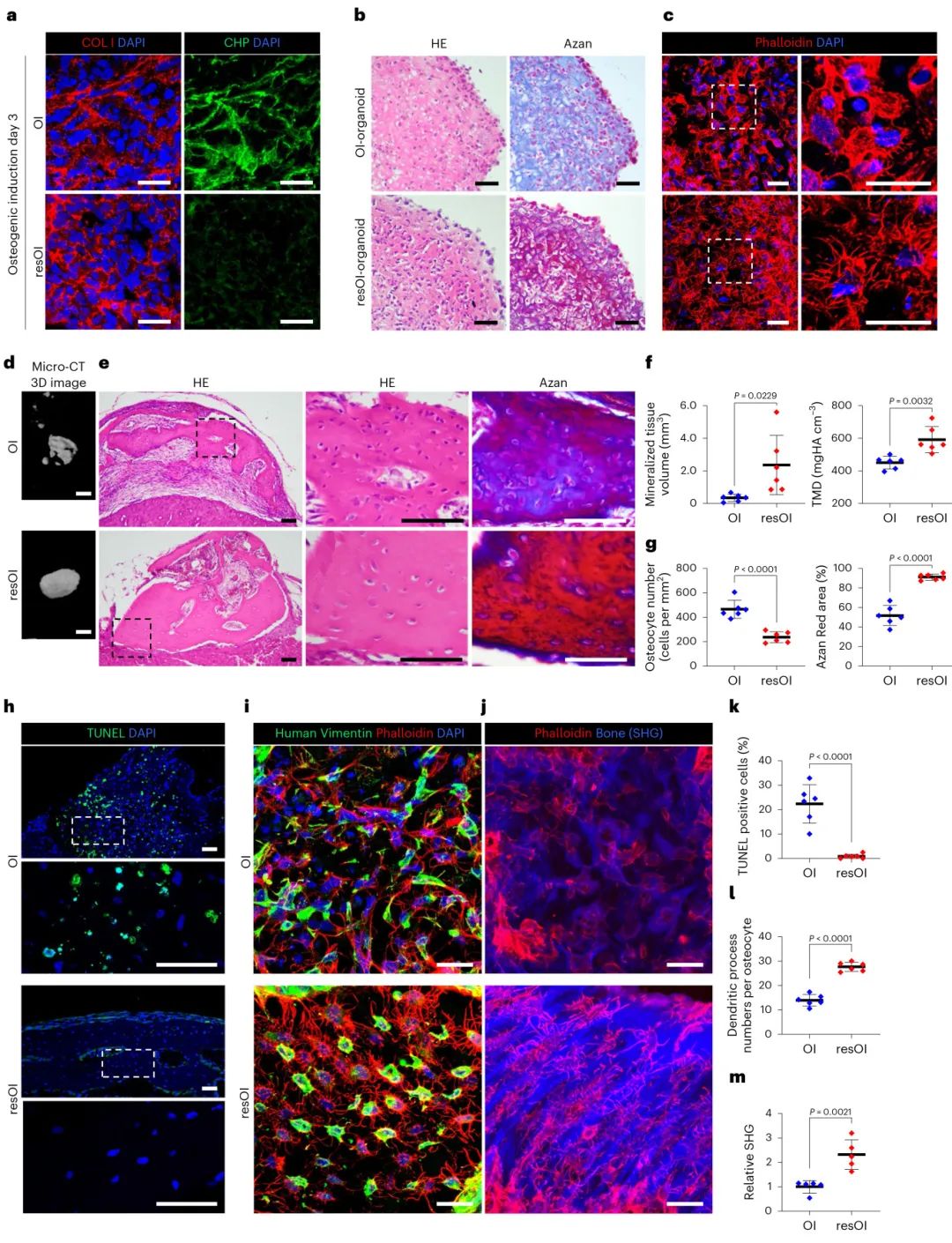
图6 OI疾病表型的总结
本研究建立了从人iPSCs生成类颌骨器官的完整方法体系,为颌骨胚胎学、病理生理学研究以及治疗方法开发奠定了重要基础。该研究实现了在体外重现颌骨发育的完整过程,从HOX阴性NCCs到mdEM,再到功能性骨组织的形成,为理解人类颌骨发育机制提供了独特的实验模型。类颌骨器官成功重现了三维骨细胞网络这一天然骨组织的关键特征,克服了以往二维培养模型的局限性,为骨细胞生物学功能研究提供了更接近生理状态的实验平台。这一模型有望用于药物筛选和个性化治疗方案的开发,对于推进骨科疾病的精准医学具有重要意义。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:卵巢早衰有新希望!干细胞新来源助力修复化疗损伤,稳效又可控
下一篇:PTH1R驱动的cAMP-pPKA-pCREB轴在发育性多囊肾病中的致囊作用